山葡萄UDP-葡萄糖:类黄酮5-O-葡萄糖基转移酶(5GT)等位基因的克隆与分析
李丹丹,傅佩宁,杨宏志,朱磊,梁英
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
(2.中国农业大学食品科学与营养工程学院,北京 100000)
花色苷是葡萄果皮呈现多种颜色的主要原因,而糖基转移酶是生成花色苷的关键酶[1]。研究表明糖基转移酶几乎存在于所有的生物体中,直接参与低聚糖、单糖苷和聚糖苷等生物合成,目前已形成超基因家族[2]。葡萄中最常见的两种糖基转移酶是 UDP-葡萄糖:类黄酮3-O-葡萄糖基转移酶(UDP-Glucose:flavonoid-3-O-Glucosyltransferase,3GT)和 UDP-葡萄糖:类黄酮5-O-葡萄糖基转移酶(UDP-Glucose:flavonoid-5-O-Glucosyltransferase,5GT),二者属于 GT1家族中不同的亚家族[3]。花色素在3GT的作用下生成 3-O-单葡糖苷,而3-O-单葡糖苷在5GT作用下进一步反应生成3,5-O-双葡糖苷。
葡萄中3GT的研究报道较多,而5GT报道相对较少。植物中5GT的研究最早是从花卉中开始的,花卉植物中的 5-O-糖基化作用是使花色多样化的重要原因。目前已在很多植物中发现了能催化3-O-单葡糖苷生成3,5-O-双葡糖苷的5GT,最早发现于朝颜剪秋罗(Silene dioica)[4]、矮牵牛(Petunia hybrid)[5]、紫罗兰(Matthiola incana)[6]和紫苏(Perilla frutescens)[7]中,后续又在大丽花(Dahlia variabilis)[8]、花菖蒲(Iris ensata)[9]、荷兰鸢尾(Iris hollandica)[10]、三花龙胆(Gentiana triflora)[11]、康乃馨(Dianthus caryophyllus)[12]和芍药(Paeonia lactiflora)[13]等多种鲜花中发现。在野生马铃薯(Solanum Sogarandinum)[14]、拟南芥(Arabidopsis thaliana)[15]和茄子(Solanum melongena)[16]等植物中也发现了5GT。对于葡萄中双糖苷花色苷的研究,Jánváry 等[17]在欧美杂交葡萄品种‘Regent’中克隆出 2个功能不同的5GT等位基因,分别为来自‘Chambourcin’能催化 3-O-单葡糖苷生成 3,5-O-双葡糖苷的Cha5GT,和‘Diana’不能催化合成 3,5-O-双葡糖苷的Dia5GT,并证实Dia5GT不能合成双糖苷花色苷是由氨基酸突变和提前终止密码子导致 C-末端的截断造成的,说明欧亚种葡萄不能合成双糖苷花色苷的原因是5GT等位基因由于突变而丧失5GT酶活性。但近期有报道称在欧亚种葡萄中检测到痕量级双糖苷花色苷[18~20]。Yang等[19]在欧亚种葡萄中发现多个丧失功能的5GT等位基因。He等[21]在山葡萄‘左山一’中克隆出一个5GT基因,并通过异源表达证实其能够催化合成3,5-O-双葡糖苷。
山葡萄(Vitis amurensisRupr)在我国主要分布在东北三省,具有极强的抗寒能力。山葡萄果实成熟后呈紫黑色,具有粒小皮厚、汁少籽多、酸高糖低、单宁多、色素浓等特点,不宜鲜食,主要用于酿酒[22~24]。山葡萄酒是中国独有的特殊葡萄酒种,颜色呈宝石红,因其色泽浓郁、果香独特和口感醇厚等特点而广受消费者喜爱[25]。但山葡萄中存在大量双糖苷花色苷,严重影响葡萄酒的陈酿品质。目前,关于山葡萄双糖苷花色苷合成机制的研究较少,本研究选取了4种酿酒葡萄品种,分别是欧洲种‘赤霞珠’、山葡萄‘左山一’、山欧杂交品种‘哈桑’和‘左红一’为实验材料,通过PCR等技术克隆5GT等位基因,分析山葡萄及山欧杂交品种中5GT等位基因的差异,为解析山葡萄及其杂交品种间糖基化花色苷组成差异的机制提供基础数据。
1 材料与方法
1.1 植物材料
‘赤霞珠’(V. viniferaL.cvCabernet Sauvignon)、‘左山 一 ’(V. amurensisRupr)、 ‘哈 桑 ’(V. vinifera,V.amurensis)、‘左红一’(V. vinifera,V. amurensis)的叶片采集于中国农业大学北京上庄实验站葡萄种质资源圃,取葡萄枝顶端第五片完全展开的无病害幼叶,用镊子装进5 mL离心管中,置于液氮罐中速冻,保存于-80 ℃冰箱。
1.2 基因组DNA提取
取适量葡萄叶片于液氮中研磨成粉,用优化改良的CTAB法提取高质量葡萄基因组DNA(gDNA)[26],用1%琼脂糖凝胶电泳和Nano-drop浓度仪检测DNA质量,-20 ℃保存备用。
1.3 PCR扩增
引用Jánváry等[17]克隆欧亚种葡萄中5GT的引物,Forward Primer:5’-CACTTTCCACCTGAGACACC-3’和 Reverse Primer:5’-CAGTACATCAAACGCCACTC-3’,以葡萄gDNA为模板,通过PCR扩增得到目的片段,PCR产物预期大小为1455 bp。PCR反应体系为50 μL,包括 35 μL ddH2O,4 μL dNTP,5 μL 10×pfu reaction buffer,正反引物各 2 μL,1.5 μL gDNA,0.5 μL pfu聚合酶。反应条件为95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸240 s,35个循环,72 ℃延伸10 min,4 ℃保存。
1.4 TA克隆与鉴定
通过1%的琼脂糖凝胶电泳检测PCR产物大小是否与预期一致,并用琼脂糖凝胶回收试剂盒纯化回收目的片段。将纯化的目的基因连接到pLB载体上,再用热激法转化到大肠杆菌感受态细胞DH-5α中,转化成功后挑取单菌落,进行菌落PCR,通过1%琼脂糖凝胶电泳鉴定阳性克隆,并随机选取阳性克隆送至博迈德生物技术有限公司测序。
1.5 序列分析
序列拼接利用SeqMan软件完成;序列校准、开放阅读框查找及氨基酸序列翻译利用 Editseq软件完成;多序列比对利用DNAMAN8.0软件完成;同源性序列检索利用 NCBI数据库中 BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)完成。
1.6 生物信息学分析
系统进化树的构建利用MEGA5.1软件完成,采用Neighbor-joining法;蛋白跨膜区分析和预测利用在线软件 THXHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)完成;氨基酸序列分析利用蛋白质家族数据库 Pfam24.0(http://pfam.sanger.ac.uk/search/sequence)完成;信号肽分析和预测利用在线软件 SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)完成;亚细胞定位预测和分析利用在线软件TargetP1.1(http://www.cbs.dtu.dk/services/TargetP/) 完成;预测5GT蛋白质二级结构利用在线软件GOR(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?pa ge=npsa_gor4.html),预测理化性质等信息有在线软件ProtParam(http://web.expasy.org/protparam/)完成;预测蛋白质三维立体结构利用在线网站 Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/)完成。
2 结果与分析
2.1 gDNA质量检测
通过改良的CTAB法提取葡萄幼叶中gDNA,经1%琼脂糖凝胶电泳检验,条带清晰完整,没有拖尾和弥散现象,无蛋白污染或降解。
通过 Nano-drop浓度仪测定 DNA浓度,均在1000~1300 ng/μL 范围内,OD260/280值在1.8~2.0 范围,OD230/280值在2.0~2.2范围,DNA质量较好,无杂质污染,可以用于后续实验。
2.2 5GT等位基因的克隆
葡萄中5GT基因没有内含子[19],将NCBI上发表的‘左山一’Va5GT(KF996717.1)核苷酸序列放入葡萄基因组网站(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中 BLAST,找到黑比诺中一个位于9号染色体上的5GT基因,全长1395 bp,两条核苷酸序列比对同源性>99%,我们确定位于9号染色体上的5GT基因组序列没有内含子。将测序结果拼接后与Jánváry 等[17]在欧美杂种葡萄‘Regent’中发现的Cha5GT和 NCBI上已发表的山葡萄Va5GT(KF996717.1)比对后发现同源性>99%,说明 7个目的基因均为5GT等位基因。
2.3 序列分析
用软件找到7个5GT等位基因的开放阅读框,将其翻译成氨基酸序列,再与Cha5GT、Dia5GT(由慕尼黑大学的施瓦布教授提供)、NCBI上已发表的山葡萄Va5GT(KF996717.1)、圆叶葡萄5GT(KT327064.1)和已经完成全基因组测序的欧亚种葡萄‘黑比诺’一起进行序列比对,结果如图 1。通过葡萄基因组网站BLAST确定以上5GT基因均位于9号染色体上。

图1 5GT等位基因多序列比对图Fig.1 Multiple sequence alignment of 5GT alleles
从‘赤霞珠’中克隆出两个5GT等位基因,命名为VvCS5GT1和VvCS5GT2。VvCS5GT1核苷酸序列全长1394 bp,在欧亚种葡萄中普遍存在,由于第902位碱基缺失,导致其氨基酸序列从第301个氨基酸开始移码突变(G301#),并在第328位产生提前终止密码子(E328*),造成C-末端的截断,丧失UGT家族均有的一个由44个氨基酸组成的保守序列(PSPG-box)[27~29]。而VvCS5GT2比VvCS5GT1在欧亚种葡萄中相对少见,只有8%的比例存在[19]。与VvCS5GT1相比,VvCS5GT2缺失第1182和1183位‘AG’两个碱基,因此全长仅1392 bp。用Editseq软件寻找开放阅读框发现两个基因的开放阅读框完全相同,都是924 bp,编码307个氨基酸,预测分子量为33.57 ku,等电点为4.768。与有正常5GT酶功能的Cha-5GT和Va5GT相比,VvCS5GT1和VvCS5GT2的序列特征是由于碱基缺失产生提前终止密码子和移码突变导致肽链缩短,因此推测VvCS5GT1和VvCS5GT2的转录产物均丧失5GT酶的正常功能,不能生成双糖苷花色苷,这与Yang等[19]人和 Xing等[20]人的结论相符。‘赤霞珠’中的两个5GT等位基因VvCS5GT1和VvCS5GT2与其他葡萄品种5GT基因序列比对发现还存在两个氨基酸突变P78L(第78个氨基酸由P变成L)和D248Y,这也许是‘赤霞珠’5GT的品种特征性突变。
‘左山一’中得到 2个5GT等位基因,命名为VaZSY5GT1和VaZSY5GT2,二者之间有3处碱基突变,产生3处氨基酸差异,分别为E76D、V208A,及第703位碱基缺失导致VaZSY5GT2从第234个氨基酸开始移码突变(V236#)并产生提前终止密码子(R302*)。VaZSY5GT1全长为1395 bp,开放阅读框为1395 bp,编码464个氨基酸,预测分子量为51.48 ku,等电点为5.069。VaZSY5GT2全长894 bp,编码297个氨基酸,预测分子量33.02 ku,等电点6.424。VaZSY5GT1与NCBI上发表的山葡萄‘左山一’Va5GT同源性高达99.93%,核苷酸序列只有一个碱基差异,即氨基酸差异R412K,与Cha5GT序列同源性高达99.71%,只有4个碱基差异,氨基酸变化为D76E、A208V、A259S、L372M,推测VaZSY5GT1有5GT酶功能,而VaZSY5GT2因移码突变和C-末端截断丧失此酶功能。
‘哈桑’中得到 2个5GT等位基因,命名为Vv×VaHS5GT1和Vv×VaHS5GT2,两者之间共有 16处碱基差异,是四种葡萄中内部差异最大的品种。其中5处是无义突变,所以存在11处氨基酸差异。非保守区氨基酸突变有I93M、S103G、K187N、Y262C、S283P、ENEE316-319·、T383P、E389K、A395G、R422G,保守区氨基酸突变仅有 E343D。Vv×VaHS5GT1核苷酸序列全长为1395 bp,开放阅读框也为1395 bp,编码464个氨基酸,预测分子量为51.66 ku,等电点为4.976;Vv×VaHS5GT2全长为1383bp,开放阅读框为1383 bp,编码460个氨基酸,预测分子量为50.95 ku,等电点为5.093。将Vv×VaHS5GT1与其他5GT比对发现几处错义突变M93I、G113W、N187K、I282M、K318E、K389E、G422R,没有碱基缺失、移码突变和提前终止密码子;而将Vv×VaHS5GT2与其他5GT比对发现不仅有错义突变S103G、G113W、Y262C、I282M、S283P、E343D、T383P,还有因缺失 12个碱基导致的框内缺失突变ENKE316-319·,其中S103G、S283P、ENKE316-319·、T383P四处氨基酸突变在甜冬葡萄(V. cinerea)中也存在,而且甜冬葡萄中双糖苷花色苷含量<15%[18,28~30],‘哈桑’中双糖苷花色苷占总花色苷含量的10%[31]。Vv×VaHS5GT1被推测可以正常发挥5GT酶功能,Vv×VaHS5GT2由于氨基酸缺失、错义突变则可能丧失5GT酶正常功能。G113W、I282M突变在Vv×VaHS5GT1和Vv×VaHS5GT2中均有出现,且只存在于‘哈桑’中,可推测‘哈桑’5GT品种特征性突变。
‘左红一’中克隆出两个5GT等位基因,其中一个命名为Vv×VaZHY5GT,另一个5GT基因经比对发现和‘左山一’中VaZSY5GT2核苷酸序列完全相同,即‘左红一’与‘左山一’拥有一个共同的5GT基因VaZSY5GT2。Vv×VaZHY5GT全长1395 bp,开放阅读框为1395 bp,编码464个氨基酸,预测分子量为51.43 ku,等电点为 5.069;Vv×VaZHY5GT与VaZSY5GT1只有一个碱基差异T1195A,氨基酸变化为L399M。将Vv×VaZHY5GT与有功能的Va5GT和Cha5GT序列比对发现同源性>99%,且没有提前终止密码子或移码突变,只有几个位于非保守区的错义突变,而‘左红一’中双糖苷花色苷占总花色苷含量的31%[31],因此推测Vv×VaZHY5GT可以催化合成双糖苷花色苷。
将所得5GT基因序列在葡萄基因组网站(http://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中BLAST,找到‘黑比诺’5GT基因,全长1395 bp,与Va5GT和Cha5GT的碱基序列同源性>99%,开放阅读框为1203 bp,编码400个氨基酸,从第396个氨基酸开始移码突变并存在提前终止密码子,因此推测‘黑比诺’5GT基因没有功能。NCBI上发表的圆叶葡萄5GT基因部分核苷酸序列长1394 bp,部分蛋白质序列由464个氨基酸组成。与其他5GT基因序列比对后,发现圆叶葡萄5GT没有终止密码子,但序列同源性较高,只有三个圆叶葡萄品种特征性等位变异N20K、S286T和Q462L。除此之外,圆叶葡萄5GT与Cha5GT有2处等位变异D76E和A208V,但是这两个氨基酸位置保守性非常低,Vv×VaZHY5GT、VaZSY5GT1、Va5GT和圆叶葡萄5GT的第76个和第208个氨基酸为谷氨酸(E)和缬氨酸(V),而在VvCS5GT1、VvCS5GT2、VaZSY5GT2、Vv×VaHS5GT1、Vv×VaHS5GT2、‘黑比诺’5GT、Cha5GT和Dia5GT中为天冬氨酸(D)和丙氨酸(A),可见这两个氨基酸位置不影响5GT酶的功能。此外,圆叶葡萄中只存在双糖苷花色苷[31],因此推测圆叶葡萄5GT有功能。
2.4 系统进化树的构建
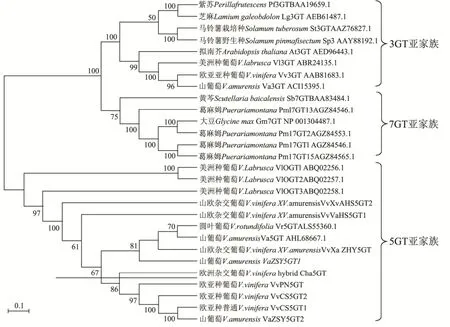
图2 系统进化树Fig.2 Phylogenetic tree
将所得5GT序列VvCS5GT1、VvCS5GT2、VaZSY5GT1、VaZSY5GT2、Vv×VaHS5GT1、Vv×VaHS5GT2、Vv×VaZHY5GT置于 NCBI数据库中BLASTP,找到其他葡萄糖基转移酶蛋白质序列,用MEGA5.1软件邻接法构建系统进化树,结果如图2。
在NCBI中搜索与花色苷生物合成有关的葡萄糖基转移酶基因,将其与本研究克隆的7个5GT序列比对并用邻接法构建系统进化树。如图2所示,进化树根据区域选择性分成三簇,根据每簇的基因组成判断三个簇为UGT家族中的三个亚家族,分别为3GT亚家族,7GT亚家族和5GT亚家族。从‘赤霞珠’、‘哈桑’、‘左红一’和‘左山一’中克隆出的7个5GT基因全部位于5GT亚家族,而且被推测在葡萄中不能合成双糖苷花色苷的无功能5GT基因除Vv×VaHS5GT2外全部聚集在横线下方,特点是均存在移码突变和提前终止密码子,而有功能的5GT基因则聚集在横线上方,聚集紧密说明遗传距离较近。
Vv×VaHS5GT2虽然被推测为无功能5GT基因,但其与Vv×VaHS5GT1序列同源性最高,且没有移码突变或提前终止密码子,故与划分在横线上方的Vv×VaHS5GT1遗传距离较近。
2.5 亚细胞定位预测
通过 THXHMM2.0在线软件(http://www.cbs.dtu.dk/ services/TMHMM/)对7个5GT等位基因进行蛋白跨膜区分析和预测,结果表明均不存在跨膜区,不属于膜结合蛋白。用 Pfam24.0在线网站(http://pfam.sanger.ac.uk/search/sequence)分析蛋白质,结果表明7个5GT均属于GT1家族,GT-B型折叠。用 SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)预测和分析以上7个5GT蛋白信号肽,结果表明均不属于膜结合蛋白,无信号肽,非分泌蛋白。通过TargetP1.1(http://www.cbs.dtu.dk/services/TargetP/) 对5GT蛋白进行亚细胞定位预测和分析,结果如表1,说明5GT均存在于细胞中除线粒体、叶绿体外的其他部位,且再次验证不存在信号肽。

表1 亚细胞定位分析表Table 1 Subcellular localization analysis
2.6 蛋白质结构预测
通过 GOR 网站(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测 5GT蛋白质二级结构,结果表明:VvCS5GT1中α-螺旋占37.46%,延伸链占14.98%,无规则卷曲占47.56%;VvCS5GT2中α-螺旋占37.46%,延伸链占14.98%,无规则卷曲占 47.56%;VaZSY5GT1中α-螺旋占33.62%,延伸链占20.47%,无规则卷曲占45.91%;VaZSY5GT2中α-螺旋占36.53%,延伸链占21.60%,无规则卷曲占 41.87%;Vv×VaHS5GT1中α-螺旋占38.15%,延伸链占17.89%,无规则卷曲占43.97%;Vv×VaHS5GT2中α-螺旋占33.70%,延伸链占19.78%,无规则卷曲占 46.52%;Vv×VaZHY5GT中α-螺旋占34.70%,延伸链占19.83%,无规则卷曲占45.47%。
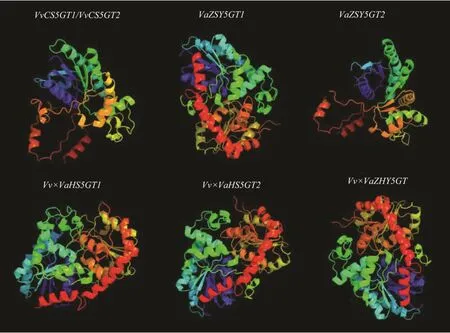
图3 三级结构预测图Fig.3 Tertiary structure prediction
用ProtParam(http://web.expasy.org/protparam/)预测5GT蛋白质理化性质,结果如表2。肽链相对完整的Vv×VaHS5GT1、Vv×VaHS5GT2、Vv×VaZHY5GT和VaZSY5GT1消光系数较大,而由于提前终止密码子而截断的VvCS5GT1、VvCS5GT2、VaZSY5GT2消光系数相对较小,说明肽链缩短对消光系数有一定影响。7个5GT等位基因的体外半衰期均达到30 h,不稳定系数均>40,因此均为不稳定蛋白质。亲水性数值越低蛋白质亲水性越强,数值越高疏水性越强,VaZSY5GT2为疏水性蛋白,其余5GT均有一定亲水性。用 Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/)预测5GT蛋白质三维立体结构,如图 3所示,VvCS5GT1和VvCS5GT2拥有相同三级结构,前面被推测为有5GT酶功能的Vv×VaHS5GT1、Vv×VaZHY5GT和VaZSY5GT1蛋白结构折叠紧密且相对完整,而被推测为无5GT酶功能的VvCS5GT1、VvCS5GT2、VaZSY5GT2结构均松散且不完整。虽然Vv×VaHS5GT2蛋白结构相对完整,但与Vv×VaHS5GT1相比可以看出部分蛋白结构缺失。

表2 5GT蛋白质理化性质的预测Table 2 Prediction of physicochemical properties of 5GT protein
3 讨论
葡萄中糖基化花色苷包括单糖苷花色苷和双糖苷花色苷,在不同葡萄品种中糖基化花色苷的组成差异明显,如山葡萄‘左山一’、山欧杂种葡萄‘左红一’和‘哈桑’中双糖苷花色苷分别占总花色苷含量的82%、31%和10%[31],而决定葡萄糖基化花色苷组成的重要原因是双糖苷花色苷的关键酶基因5GT的基因型。因此,本研究选择‘左山一’、‘左红一’和‘哈桑’这3个山葡萄/山欧杂交品种和 1个欧亚种葡萄‘赤霞珠’作为实验材料,通过基因克隆等技术得到5GT等位基因的核苷酸序列,探究5GT等位基因的核苷酸突变情况和氨基酸组成差异,并利用生物信息学软件对5GT等位基因进行结构分析和功能预测。在实验过程中,四种葡萄样品共送样测序近100个单克隆,此外还有PCR产物直接测序以及分段测序多个样品,而且实验期间换过高保真聚合酶、DNA模板、引物和测序公司等实验条件以保证实验结果的准确性。
Yang等[19]人在8个葡萄种中共发现54个5GT等位基因,并按照突变特点分类。其中36个不存在移码突变或提前终止密码子的5GT属于W型,可能有5GT酶功能,剩余18个5GT基因由于移码突变或提前终止密码子可能丧失5GT酶活性,根据移码突变或终止密码子的位置分成A~G七种类型。Yang等[19]人发现的54个5GT等位基因中有6个与本研究结果一致,VvCS5GT1与Yang等[19]人发现的5GT基因型A1一致,VvCS5GT2与A2一致,A1和A2只存在于欧亚种野生型(V. viniferassp.sylvestris)葡萄和欧亚种栽培品种(V.viniferassp.vinifera)中,A型5GT基因的突变特征是从第301个氨基酸开始移码突变(G301#)。VaZSY5GT2与B1一致,B1不仅存在于欧亚种葡萄(V.vinifera)中,还在一些杂交品种中出现,B型突变特征是从第 234个氨基酸开始移码突变(V236#)。VaZSY5GT1与 W5一致,W5来自山葡萄(V.amurensis),Vv×VaHS5GT2与W23一致,W23来自甜冬葡萄(V. cinerea),Vv×VaHS5GT1与W19一致,而 W19在甜冬葡萄(V. cinerea)、美洲葡萄(V.labrusca)、夏葡萄(V. aestivalis)以及一些杂交葡萄品种中均有出现。只有Vv×VaZHY5GT不存在于Yang等[19]发现的54个5GT等位基因中,但与W5相似性最高,只有一个碱基差异 A1195T,相应的氨基酸变化为M399L,可能是一个未被发现的新5GT基因型。He等[21]在‘左山一’中克隆出一个Va5GT,通过研究其表达及生化特征证实其有5GT酶活性,可以合成双糖苷花色苷。而本研究从‘左山一’中克隆的VaZSY5GT1与Va5GT比对后发现有一个碱基差异G1235A,即氨基酸差异R412K了,但在Yang等人[19]报道的54个5GT等位基因中并未找到与Va5GT完全相同的基因型,Va5GT可能也是一个新的5GT等位基因。
虽然基因突变的随机性很大,但也能发现一些突变规律,如Vv×VaHS5GT2和甜冬葡萄都在碱基位置947-958缺失12个碱基,造成连续四个氨基酸框内缺失(ENKE316-319·),Vv×VaHS5GT1和夏葡萄(V.aestivalis)在该区域存在共同的氨基酸突变 K318E,说明该区域是突变热点区,氨基酸的组成和数量都是可变的[19]。另一个突变规律是第 76位氨基酸存在三种突变形式,D76E出现在山葡萄和圆叶葡萄中,D76N出现在欧亚种葡萄中,D76Y也出现在圆叶葡萄中[19]。
以被证实有功能的5GT-Cha为参照序列,根据突变特征,将5GT等位基因分成三种类型:Ⅰ型、Ⅱ型和Ⅲ型。Ⅰ型5GT等位基因的突变特征是存在提前终止密码子和移码突变,包括VvCS5GT1、VvCS5GT2、VaZSY5GT2、Dia5GT和 ‘黑 比 诺 ’5GT; 而Vv×VaHS5GT2属于Ⅱ型突变,特征是框内缺失突变,无移码突变或提前终止密码子;Ⅲ型突变特征是仅发生氨基酸置换,包括Vv×VaHS5GT2、Vv×VaZHY5GT、VaZSY5GT1、Va5GT和圆叶葡萄5GT。显然,Ⅰ型和Ⅱ型突变都可能使5GT酶失去活性,而Ⅲ型突变则不会影响5GT酶活性。这与前面序列分析的结果相符,与Yang等人[19]的结果也一致。
VvCS5GT1、VvCS5GT2、VaZSY5GT2中发生肽链截断,因此推测其编码的蛋白质不能正常发挥5GT酶功能,从而使葡萄中的双糖苷花色苷含量降低。‘赤霞珠’中 2个5GT基因均没有功能,这也许是‘赤霞珠’中几乎不含有双糖苷花色苷的原因,因此纯欧亚种葡萄酿造的葡萄酒陈年潜力更好。‘哈桑’、‘左红一’和‘左山一’中均含有一个功能性5GT等位基因,但双糖苷花色苷占比却有明显差异,有一种可能性是其他染色体上也存在5GT等位基因,说明位于9号染色体上的5GT等位基因还不足以解释山葡萄及其杂交品种中花色苷的组成差异。还有一种可能是基因序列差异导致转录产物的酶功能和活性不同,使双糖苷花色苷合成量不同。Xing等[20]人在欧亚种葡萄(V. vinifera)‘赤霞珠’中发现5个5GT候选基因Vv5GT1、Vv5GT2、Vv5GT3、Vv5GT4、Vv5GT5,其中Vv5GT1就是本研究中的VvCS5GT1和Yang等人[19]报道的A1,其余四个基因经比对发现Vv5GT2位于 17号染色体,而Vv5GT3、Vv5GT4和Vv5GT5则位于5号染色体。Hall等人[33]在美洲种葡萄(V. labrusca)中发现的四个类似5GT基因OGT1、OGT2、OGT3、OGT4经比对发现位于5号染色体上。因此,继续在其他染色体上寻找更多的5GT等位基因并且验证基因功能,是我们下一步研究的重要内容,为探究不同山葡萄品种间糖基化花色苷组成差异的机制奠定基础。
4 结论
从‘赤霞珠’、‘左山一’、‘哈桑’、‘左红一’4 个葡萄品种中共克隆出7个等位基因,均位于9号染色体上。‘左红一’和‘左山一’中有一个相同的5GT等位基因。经序列比对发现VvCS5GT1、VvCS5GT2、Vv×VaHS5GT2、VaZSY5GT2中存在氨基酸缺失、移码突变或提前终止密码子,因此推测这4个5GT等位基因失去5GT酶活性,不能合成双糖苷花色苷;而Vv×VaHS5GT1、Vv×VaZHY5GT、VaZSY5GT1仅有基础氨基酸置换,与有功能的Cha5GT一致性>99%,因此推测这三个序列可以合成双糖苷花色苷。

