PCI术对老年急性冠状动脉综合征患者血清HMGB1与SAA水平表达的影响
张英武,段军仓,陈少泽,瞿德涛
(石河子大学医学院第一附属医院心内二科,新疆石河子 832008)
急性冠状动脉综合征(ACS)为临床常见的急性血管综合征,主要因冠状动脉内不稳定导致斑块侵袭或破裂,使血管闭塞,导致血栓形成所致[1]。内膜的浅表糜烂和不稳定斑块的纤维帽破裂是ACS的主要致病机制。杨彦等[2]研究显示,在易损斑块的形成中炎性反应可起到至关重要的作用,能引起不稳定斑块破裂。血清淀粉样蛋白A(SAA)是炎症信号触发剂,也是炎性标志物,在机体炎性反应发生、发展中发挥重要的作用;高迁移率族蛋白B1(HMGB1)为非特异性的炎性因子,在动脉粥样硬化病变的坏死核心区HMGB1有较高的表达[3]。经皮冠状动脉介入(PCI)具有穿刺创伤小、止血方便、血管并发症少等优势,被临床广泛应用于ACS的救治中。本研究以在本院接受治疗的ACS患者为观察对象,分析PCI术对老年ACS患者血清HMGB1、SAA表达水平的影响,现报道如下。
1 资料与方法
1.1一般资料 选择2016年2月至2017年3月本院收治的ACS患者80例,根据治疗方式不同将患者分为两组,各40例。纳入标准:(1)符合《不稳定型心绞痛和非ST段抬高心肌梗死诊断与治疗指南》[4]中ACS的相关诊断标准,且经冠状动脉造影确诊;(2)均对本研究知情,且自愿签署知情同意书;(3)凝血功能正常;(4)无手术禁忌证。排除标准:(1)合并严重的风湿免疫性疾病、感染性疾病、恶性肿瘤者;(2)肝、肾等重要器官严重功能不全者;(3)精神异常,依从性差者;(4)既往有PCI史、溶栓史、冠状动脉搭桥术史者;(5)合并肥厚型心肌病、扩张性心肌病等基础疾病者。试验组中男26例,女14例;年龄60~82岁,平均(72.65±2.56)岁;合并高血压28例,糖尿病9例;有饮酒史6例,吸烟史23例;体质量指数(BMI)21~28 kg/m2,平均(24.26±2.31)kg/m2。对照组中男28例,女12例;年龄61~81岁,平均(72.64±2.55)岁;合并高血压27例,糖尿病10例;有饮酒史5例,吸烟史24例;BMI 21~29 kg/m2,平均(24.28±2.29)kg/m2。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可对比性。
1.2方法
1.2.1治疗方法
1.2.1.1对照组 实施常规药物治疗:口服阿司匹林片(湖南恒伟药业股份有限公司,批号:国药准字H43020919),每天1次,每次100 mg;氯吡格雷片(深圳信立泰药业股份有限公司,批号:国药准字H20120035),每天1次,每次75 mg,并予以常规β-受体阻滞剂、他汀类调脂药、血管紧张素转换酶抑制剂(ACEI)等药物治疗。
1.2.1.2试验组 予以PCI术治疗,术前顿服氯吡格雷300 mg、阿司匹林300 mg。常规消毒铺巾后,予以患者局部麻醉。对右侧桡动脉行seldinger法穿刺,直至有鲜红色动脉血液喷出为止,而后将短引导丝置入后,将穿刺针退出。将6F的动脉鞘沿导丝置入,将2 500 U肝素钠(康普药业股份有限公司,批号:国药准字H43020294)经外鞘管侧孔注入以抗凝。分别使用Judkins左、右冠状动脉造影管以碘海醇注射液实施冠状动脉造影术。如患者存在钙化病变、迁曲血管病变等特殊病变时,可予以Amplazt、EBU等导管增加支撑力。如有冠状动脉狭窄大于管腔直径的75%的患者,则需予以支架植入术+经皮冠状动脉腔内成形术,支架植入前需追加肝素50~70 U/kg ,根据患者病情酌情将硝酸甘油注入冠脉内。球囊导管的选择原则为靶血管的直径与球囊1.1∶1.0,在病变冠状动脉开口处送至指引导管后,经指引导管将指引导丝推送至狭窄处远端,并将球囊沿引导丝置入,以8~14大气压对支架实施10~20 s的扩张、释放。扩张后再次实施造影,对冠状动脉狭窄程度进行观察,同时探查内膜是否撕裂。如扩张效果不满意,可再次实施扩张,直至取得最佳扩张效果。以血管直径与支架1∶1的原则选择适宜的支架,并根据患者病变长度和血管狭窄支数选择置入支架数量,在狭窄部位准确放置支架后,再次实施球囊加压,以扩张支架。扩张满意后释放压力,将球囊撤回。对支架术后靶病变处治疗效果进行观察,满意后将指引导管和导丝撤出。
1.2.2观察指标 (1)血清HMGB1、SAA。采集所有患者治疗前、治疗后3个月5 mL空腹肘正中静脉血,而后置入促凝管内,进行3 000 r/min离心10 min,取上清液,采用酶联免疫吸附试验进行测定(仪器:美国bio-radimark酶标仪;HMGB1试纸盒由上海蓝基生物科技有限公司提供;SAA试纸盒购自南京新华美卫生用品有限公司)。(2)临床疗效。参考《各类脑血管病分类诊断要点》[5]相关标准对两组临床疗效进行评估,治愈:临床症状基本消失,无心功能不全和心律失常,轻体力活动无不适感发生,心肌酶指标正常;显效:临床症状明显改善、无心功能不全和心律失常,轻体力活动时心前区偶有疼痛、憋闷、心悸,心肌酶指标正常;有效:临床症状有所好转,伴有心功能不全和心律失常;无效:临床症状无变化,有明显的心功能不全和心律失常。治疗总有效率=(治愈例数+显效例数+有效例数)/患者总例数×100%。(3)心功能指标。治疗后3个月,采用平衡法核素心室造影和多普勒彩色超声心动图对两组患者心功能各项指标进行检查,包括左心室射血分数(LVEF)、左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)。

2 结 果
2.1两组患者血清HMGB1及SAA水平比较 治疗前两组患者血清HMGB1、SAA水平比较,差异无统计学意义(P>0.05);治疗后对照组、试验组患者血清HMGB1、SAA水平均较治疗前降低(HMGB1:t=79.995、13.908;SAA:t=133.105、31.896,P=0.000),且试验组患者血清HMGB1、SAA水平高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者治疗前后血清HMGB1水平比较(n=40,±s,ng/L)
注:**P<0.05,与同组治疗前比较
2.2两组患者心功能比较 治疗前两组患者LVEF、LVEDD、LVESD比较,差异无统计学意义(P>0.05);治疗后对照组、试验组患者LVEF、LVEDD、LVESD水平与治疗前相比均有明显改善(LVEF:t=27.656、69.033;LVEDD:t=25.586、34.695;LVESD:t=53.299、64.917,P=0.000),且试验组患者LVEF高于对照组,LVEDD、LVESD低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者心功能各项指标比较(n=40,±s)
*:P<0.05,与同组治疗前比较
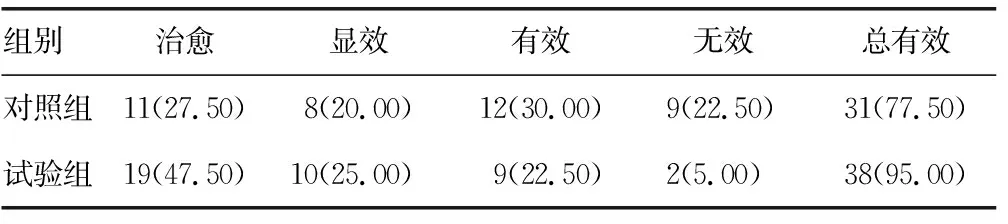
表3 两组患者临床疗效比较[n=40,n(%)]
2.3两组临床疗效比较 试验组治疗总有效率与对照组相比较高,差异有统计学意义(χ2=5.165,P=0.023),见表3。
3 讨 论
ACS发生的主要原因为:(1)血小板释放、黏附、聚集;(2)冠状动脉内斑块破裂;(3)管腔阻塞或狭窄等因素导致心肌缺血、缺氧或坏死。ACS的发生与炎性反应密切相关,炎症能增强脂质涌入、减薄纤维帽、刺激新血管的生成、扩大脂质核心等,导致不稳定斑块破裂,引起血栓形成,增加急性缺血事件发生的危险性[6-7]。
SAA由肝细胞受肿瘤坏死因子、白细胞介素(IL)-1和IL-6刺激而生成与释放。正常条件下血清SAA水平较低,当机体受到感染、外伤、肿瘤等损伤或炎症刺激时,其可在8~12 h达到峰值,但其半衰期仅有50 min左右。炎症急性期SAA水平会出现明显升高,可能会参与患者的防御反应,在机体炎性反应发生与进展中发挥重要的作用[8-9]。血清SAA水平与机体病变程度具有密切联系[10]。HMGB1为高迁移率族蛋白(HMG)中惟一能够被释放到细胞外的非特异性、敏感性的促炎因子。HMGB1在动脉硬化炎性反应中可起到重要作用,在动脉粥样硬化斑块病变的坏死核心中表达较高,可诱发局部炎症[11-12]。在细胞外,HMGB1可直接刺激炎症细胞,促使其产生炎性因子,包括干扰素、肿瘤坏死因子、超敏C-反应蛋白等,而上述炎性因子能促进HMGB1的生成,进而促进不稳定斑块形成和动脉粥样硬化,引起不稳定型斑块破裂,导致冠状动脉阻塞,引起ACS发生[13]。PCI术将狭窄冠状动脉管腔经心导管疏通,进而将梗死相关冠状动脉开通。本研究结果显示,治疗后试验组HMGB1水平高于对照组;与对照组相比,试验组SAA水平明显提高,说明PCI治疗容易提高ACS患者血清HMGB1、SAA水平,增加炎性反应。分析原因:PCI手术为机械损伤血管过程,可撕裂冠状动脉靶病变区粥样硬化斑块,导致靶血管内膜损伤,进而促发炎症和免疫机制,促使炎性因子激活,促进血管平滑肌细胞增殖、分化,导致局部炎性反应加重。
ACS心肌缺血会导致患者心肌细胞坏死、减退甚至丧失原有的收缩功能,减少每搏心输出量和心排出量,增加心室舒张末期容量,增大心室收缩时心室容量[14]。PCI经心导管技术将闭塞或狭窄的冠状动脉管腔疏通,重建血运,利于局部心肌运动早期恢复,改善左心室的收缩和舒张功能[15]。本研究中,治疗后试验组LVEF高于对照组,LVEDD、LVESD低于对照组;试验组治疗总有效率高于对照组,提示采用PCI治疗ACS能有效改善患者心功能,提高临床疗效。分析原因在于PCI可将狭窄的血管开通,改善与其相关的血运,创建侧支循环,改善心肌缺血,进而恢复患者心肌功能。PCI再灌注时间有约50 min的延迟,临床可在患者发病后及时给予相应的溶栓药物治疗,然后再根据患者情况实施PCI治疗,能有效改善再灌注时间延迟的缺点[11]。本研究仍存在一定的不足,如纳入样本量较小,未对患者实施长期随访等,故后期仍需加大样本量、延长观察时间,进行深入研究。
综上所述,ACS患者实施PCI治疗,能有效提高临床疗效,改善心功能,但会提高血清HMGB1、SAA水平,增加炎性反应,临床应予以相应的抗炎药物治疗。
[1]韩清丽.急性冠状动脉综合征药物治疗与介入治疗对比分析[J].中国心血管病研究,2003,1(2):132-133.
[2]杨彦,陈长春,王雅莉,等.急性冠脉综合征患者急诊PCI术后心力衰竭的危险因素分析及护理干预[J].现代生物医学进展,2016,16(18):3562-3565.
[3]LEVINE G N,JEONG Y H,GOTO S,et al.World heart federation expert consensus statement on antiplatelet therapy in East Asian patients with ACS or undergoing PCI[J].Glob Heart,2014,9(4):457-467.
[4]中华医学会心血管病分会.不稳定性心绞痛和非ST段抬高心肌梗死诊断与治疗指南[J].中华心血管病杂志,2007,35(14):295-304.
[5]王新德.各类脑血管病分类诊断要点[J].中华神经科杂志,1996,29(6):379-380.
[6]郭晓碧,王芳,陈扬达.高龄急性冠状动脉综合征经皮冠状动脉介入治疗患者近期死亡的预测因素[J].中国心血管病研究,2016,14(3):237-241.
[7]DE LUCA G,VERDOIA M,SCHAFFER A,et al.Switching from high-dose clopidogrel to prasugrel in ACS patients undergoing PCI:a single-center experience[J].J Thromb Thrombolysis,2014,38(3):388-394.
[8]王晓冬,林林东,龚娅.冠心病患者APN SAA水平与冠状动脉病变的相关性分析[J].浙江临床医学,2016,18(4):752-753.
[9]许浩,杨汉东,闵新文,等.急性冠脉综合征急诊PCI心血管不良事件与血清肌钙蛋白水平的关系[J].海南医学,2016,27(1):32-34.
[10]SHEHATA M,FAYEZ G,NASSAR A.Intensive statin therapy in NSTE-ACS patients undergoing PCI:clinical and biochemical effects[J].Tex Heart Inst J,2015,42(6):528-536.
[11]周选民,刘梅讯,李小力,等.急性冠脉综合征患者接受经皮冠脉介入治疗后血浆IL-12水平变化及相关性分析[J].中国医药导报,2016,13(16):19-22.
[12]刘强,戚昉,龙似维.丁苯酞对缺血性脑卒中老年患者的疗效及其血清高迁移率族蛋白B1、白细胞介素-18和-23的影响[J].中国老年学杂志,2014,34(10):2704-2705.
[13]KIM J S,HAN D C,JEONG Y H,et al.Antiplatelet effect of ticagrelor compared to tirofiban in non-ST-segment elevation ACS patients undergoing PCI.The result of the TE-CLOT trial[J].Thromb Haemost,2016,115(1):213-221.
[14]程小兵,潘文博,钟万生,等.急性冠脉综合征患者PCI术后超敏C反应蛋白、脑钠肽水平的预后价值[J].中国循证心血管医学杂志,2015,7(6):839-842.
[15]田新利,李俊峡.非ST段抬高急性冠脉综合征合并心房颤动经皮冠状动脉介入术后抗栓1例报告并文献复习[J].中国医刊,2016,51(7):29-31.

