Hsp90AB1在狂犬病病毒复制过程中的功能初探
许运斌,孙玉章,刘 娟,颜 焰,高兴红,罗 果,王 欢
(1.遵义医学院 贵州省普通高等学校传染病与生物安全特色重点实验室,贵州遵义 563000;2.青岛蔚蓝生物股份有限公司, 国家动物用保健品工程技术研究中心, 山东青岛 266000;3.浙江大学 农业部动物病毒学重点实验室,浙江杭州 310058)
狂犬病(Rabies)是由弹状病毒科狂犬病病毒属嗜神经性RNA病毒狂犬病病毒(Rabies virus,RABV)引起的一种人兽共患病。患病动物的咬伤和抓伤是RABV经典传播路径。RABV在外周伤口完成首轮的复制后能够逆着神经轴突运输至中枢神经系统。狂犬病的潜伏期从1周至数月不等。狂犬病以极少的神经病变与温和的中枢神经系统炎症为特征。其临床表现主要有狂躁型和麻痹型两种形式。暴露后及时的免疫接种是预防狂犬病唯一有效的方法。人类对狂犬病的了解经历了悠久的认识历程,随着病毒学的不断发展,人们对狂犬病病毒的认识也更加深入,在狂犬病疫苗研发方面取得了丰硕的成果,在狂犬病病毒致病机制解析方面也取得一定的研究成绩。但狂犬病一旦发病,仍无治愈希望,而且人类对狂犬病病毒感染的发病过程及其致死机制仍知之甚少。因此,为了确保人类健康和公共卫生安全,有必要对RABV的致病机理进行更为深入和全面的研究。
热休克蛋白90(Hsp90)是一类保守的分子伴侣蛋白,在真核细胞中普遍表达,它在蛋白折叠、成熟和稳定性方面起着重要的作用,进而维持细胞的稳态和生存[1-2]。Hsp90蛋白包含有3个功能结构区域,即N端结构区域(NBD)负责与ATP的互作并具有ATP酶的活性,中间区域(MD)负责客户蛋白和其他辅助伴侣蛋白的结合,C端区域负责Hsp90的二聚化[3]。Hsp90抑制剂诸如格尔德霉素(GA)及其衍生物烯丙基氨基格尔德霉素(17-AAG)能够结合Hsp90的NBD进而抑制其伴侣活性,接着导致其客户蛋白的错误折叠和最终的降解[4]。已有研究发现Hsp90抑制剂能够引发Hsp90客户蛋白如细胞蛋白和微生物蛋白通过蛋白酶体或自噬途径降解[5-8]。
实验室前期研究发现细胞周期蛋白37(cdc37)依赖和非依赖Hsp90亚型蛋白Hsp90AA1结合的途径稳定P蛋白进而促进RABV的感染[9],而Hsp90另一亚型蛋白Hsp90AB1在RABV复制过程中的作用尚不清楚。本研究在细胞水平上对Hsp90AB1蛋白在RABV复制过程中的作用方式进行初步分析,有助于揭示RABV的复制机制,为有效预防和控制狂犬病提供基础理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞培养和病毒感染 鼠神经瘤母细胞N2a培养于含50 mL/L胎牛血清的DMEM培养基。狂犬病病毒HEP-Flury毒株在N2a细胞中扩繁,测定病毒滴度,分装,保存于-70℃;N2a细胞铺至6孔板或12孔板,待培养指定时间后进行HEP-Flury毒株的感作2 h,之后换液进行相关药物处理或不进行药物处理,最后在指定感染时间收获相关病毒感染样品。
1.1.2 抗体和药物 狂犬病病毒N蛋白鼠单克隆抗体1D3和P蛋白鼠单克隆抗体7B3由本实验室制备;β-actin和Hsp90AB1鼠单抗购自杭州华安生物技术有限公司;GAPDH兔多抗购自杭州贤至生物技术有限公司;FITC标记的羊抗鼠IgG、HRP标记的羊抗鼠IgG和HRP标记的羊抗兔IgG购自KPL公司;Hsp90抑制剂格尔德霉素(geldanamycin,GA)购自Sigma公司。
1.1.3 真核表达载体构建及其转染 小鼠全长的Hsp90AB1基因通过PCR从N2a细胞cDNA中获得,然后克隆至PCI-neo(Promega)。构建该载体的特异性引物:上游引物5′-CCGCTCGAG ATG CCT GAG GAA GTG CAC CA-3′(XhoⅠ);下游引物5′-GCTCTAGA TTA ATC CAC CTC TTC CAT GC-3′(XbaⅠ)。真核表达载体的转染采用ExFectTM转染试剂(Vazyme),具体操作步骤参考该转染试剂说明书。
1.1.4 shRNA干扰质粒构建及其转染 N2a细胞中Hsp90AB1基因的敲降采用载体介导的shRNA干扰方法。pcDNA6.2-GW/EmGFP-miR(Invitrogen公司)载体介导的shRNA用于干扰HspAB1(NM-008302.3,靶序列:GCGCATGGAAGAGGTGGATTA),阴性对照序列为GTCTCCACGCGCAGTACATTT。shRNA质粒的转染采用ExFectTM转染试剂(Vazyme),具体操作步骤参考该转染试剂说明书。
1.2 方法
1.2.1 细胞的药物处理 病毒感染的细胞由不同工作浓度的GA药物在样品收获前处理指定的时间。二甲基亚砜(DMSO)作为上述药物的溶剂而用于未用药物处理的对照。
1.2.2 间接免疫荧光试验(IFA) 病毒感染后的N2a细胞在弃去细胞上清后进行80%预冷丙酮于-20℃ 30 min固定;弃去丙酮,用pH7.4的1×PBS漂洗3次,每次5 min;一抗为1∶1 000稀释的抗RABV N蛋白单抗腹水1D3,150 μL/孔,37℃孵育1.5 h;1×PBS漂洗3次,每次5 min,二抗为1∶400标记FITC标记的羊抗鼠IgG,100 μl/孔,37℃孵育1 h;1×PBS漂洗3次,每次5 min;荧光显微镜观察结果并拍照。该试验用于病毒滴度TCID50的测定。
1.2.3 病毒滴度TCID50的测定 用96孔细胞培养板对收集的细胞上清病毒(细胞毒)进行病毒滴度TCID50的测定。生长良好的N2a细胞传代后铺至96孔细胞培养板中,然后培养于37℃、体积分数为5% CO2细胞培养箱。待细胞密度培养至80%~90%,进行下面的接毒试验。将保存于-70℃冰箱的细胞毒10倍梯度稀释至10-6,取梯度稀释好的病毒样品接种于96孔细胞,100 μL/孔,每个稀释度设置6个重复孔,接着于37℃、体积分数为5% CO2细胞培养箱继续培养。在病毒感染48 h后,弃去细胞上清,以80%预冷丙酮于-20℃固定30 min。之后以抗N蛋白单抗腹水1D3进行IFA测定,观察并记录各孔免疫荧光阴阳性信号情况。接着按照Reed-Muench法计算TCID50。在结果2.1和2.3柱状图B中病毒滴度的相对水平(Relative level)是药物处理组或基因敲降组TCID50与对照组TCID50的比值。
1.2.4 免疫印迹 全细胞蛋白样品采用SDS裂解液裂解(50 mmol/L Tris-HCl pH 7.4,10 g/L SDS,10 g/L Triton X-100,1 mmol/L PMSF),冰上裂解5 min,然后与SDS 4×蛋白上样缓冲液(Takara公司)混合并煮沸变性10 min。接着对煮沸变性后的蛋白样品进行4℃、12 000 r/min离心10 min,取煮沸过的蛋白样品上清进行SDS-PAGE,然后通过半干转移法将蛋白转移至NC膜上,最后进行免疫印迹分析。将NC膜置于50 g/L脱脂奶中4℃封闭过夜,之后PBS漂洗3次,5 min/次,加入含有一抗的50 g/L BSA缓冲液中,4℃摇床缓慢孵育过夜,弃去一抗,用PBS漂洗NC膜3次,5 min/次。然后加入含有二抗HRP-YKT或HRP-YKS(KPL)的50 g/L脱脂奶中,37℃摇床缓慢孵育1 h。之后PBS 4℃摇床漂洗过夜。最后采用扫描仪ImageScanner III(GE Healthcare公司)对NC膜进行ECL显色拍照。
1.2.5 实时荧光定量RT-PCR 细胞总RNA采用TRIZOL裂解液(Invitrogen公司)并按照产品说明书进行抽提。抽提出来的总RNA采用反转录试剂盒RevertAid first strand cDNA synthesis kit(Fermentas公司)反转成单链cDNA。狂犬病病毒反基因组RNA的反转录采用特异性引物进行,病毒mRNA和内参GAPDH mRNA的反转录采用Oligo(dT)20进行。实时荧光定量RT-PCR采用7500型荧光定量PCR系统(ABI公司)和1×SYBR premix EX-Taq(Takara公司)进行。PCR的条件参数如下:50℃ 2 min,95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。溶解曲线采用系统默认的PCR程序获得。定量数据的结果分析采用7500型2.0.6版本的软件进行。定量分析病毒mRNA和反基因组的差异表达水平采用相对定量的方法(ΔΔCt法)。病毒反基因组RNA分别采用特异性引物5′-AAGGAGTTGAATGACAGGGTGCCA-3′进行反转录,之后再采用特异性引物5′-AAGGAGTTGAATGACAGGGTGCCA-3′和5′-ACTTGGGATGGTTCGAAAGGAGGA-3′进行实时荧光定量RT-PCR;病毒N基因mRNA水平的实时荧光定量RT-PCR采用特异性引物5′-AGCAGCAATGCAGTTCTTTGAGGG-3′和5′-TTGTCAGTTCCATGCCTCCTGTCA-3′;GAPDH基因mRNA水平的实时荧光定量RT-PCR采用特异性引物5′-TCAACAGCAACTCCCACTCTTCCA-3′ 和5′-ACCCTGTTGCTGTAGCCGTATTCA-3′[9]。
1.2.6 细胞活力的测定 N2a细胞的活力采用CCK-8试剂盒(上海碧云天生物技术有限公司)进行测定。N2a细胞以2×104个细胞/孔铺至96孔板,采用含50 mL/L胎牛血清的DMEM培养,并在药物处理前培养12 h。接着N2a加入100 μL含不同工作浓度的药物GA进行处理。在药物处理24 h后,N2a细胞加入20 μL CCK-8溶液,然后继续在37℃、体积分数为5% CO2培养条件孵育2 h,采用酶标仪(BioTek全波长)对450nm的吸光度进行测定。
1.2.7 生物学统计分析 采用SPSS 13.0生物软件t检验对各组数据统计学显著差异水平进行分析。*P<0.05、**P<0.01和***P<0.001由SPSS 13.0软件计算获得。
2 结果
2.1 Hsp90抑制剂对RABV感染的影响
首先对长满单层的N2a细胞进行HEP-Flury毒株的接毒感作2 h,之后换液进行GA不同药物浓度(0、200、400、800 nmol/L)的处理,最后在病毒感染24 h后收获细胞的总蛋白样品,TRizol裂解液样品和上清液样品。对收获的样品分别进行免疫印迹、实时荧光定量RT-PCR和病毒滴度测定等试验,结果显示病毒感染的细胞在GA药物处理后病毒蛋白表达、病毒基因转录、病毒基因组复制和病毒粒子感染力呈剂量依赖性显著降低(P<0.01)。说明RABV的感染依赖于Hsp90(主要包括Hsp90AA1和Hsp90AB1两种亚型蛋白)正常功能的发挥(图1)。

A.免疫印迹分析病毒感染的细胞在GA药物处理后病毒蛋白的表达情况;B.对A试验样品中病毒蛋白、病毒N基因mRNA、病毒反基因组RNA和病毒滴度进行定量分析的情况,其中对A中的N、P蛋白水平采用ImageJ软件进行相对定量分析,对病毒N基因mRNA和反基因组RNA进行实时荧光定量RT-PCR相对定量分析,对病毒滴度的相对水平采用药物处理组TCID50与对照组TCID50的比值表示
A.Immunoblotting analysis of viral protein expressions in GA treated and virus-infected cells; B.Quantitative analysis of viral proteins,viral N mRNA,anti-genomic RNA and virus titer in A described experimental samples.Comparative quantitative analysis of N and P proteins using ImageJ software.Comparative quantitative analysis of virus N mRNA and anti-genomic RNA in RT-PCR.The relative level of virus titer was indicated as the ratio of TCID50between drug treatment group and its control group
图1 Hsp90抑制剂对狂犬病病毒感染影响的分析
Fig.1 Analysis of the effect of Hsp90 inhibitor on RABV infection
2.2 Hsp90抑制剂对细胞活力的影响
为排除Hsp90抑制剂GA药物是通过影响细胞活力进而影响RABV复制周期的可能,本研究分析了GA不同药物浓度对N2a细胞活力的影响。结果显示GA药物终浓度为200 nmol/L、400 nmol/L和800 nmol/L对N2a细胞活力无显著影响。说明GA药物对细胞的处理直接而不是通过细胞活力影响了RABV复制周期的影响(图2)。
2.3 Hsp90AB1干扰对RABV感染的影响
实验室前期研究已发现Hsp90AA1可通过与P蛋白的结合进而正调控RABV的感染[10],而Hsp90的另一个亚型蛋白Hsp90AB1是否在RABV感染过程中起作用仍未知,故本研究在GA药物相关试验的基础上采用基因特异性敲降的方法分析了Hsp90AB1基因敲降后对RABV病毒蛋白、病毒转录与复制以及病毒滴度水平的影响。免疫印迹结果显示采用shRNA敲降Hsp90AB1后均能够导致病毒N和P蛋白水平的显著下降。实时荧光定量RT-PCR结果显示Hsp90AB1干扰后能够显著抑制病毒的转录,而对病毒复制无影响。病毒滴度测定结果显示Hsp90AB1的干扰对病毒粒子感染力无显著影响。上述结果表明Hsp90AB1可在蛋白表达水平或病毒转录水平正调控RABV的感染(图3)。
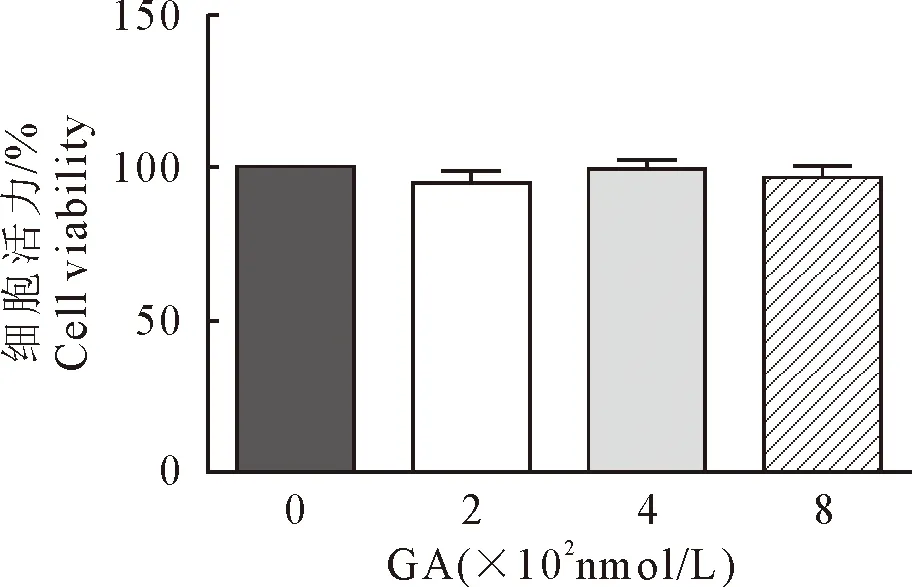
图2 不同工作浓度GA药物对N2a细胞活力的影响
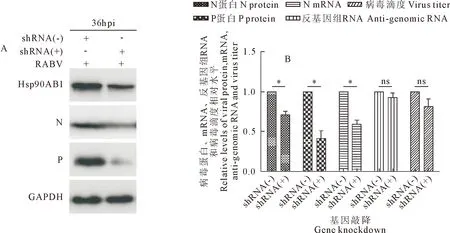
A.免疫印迹分析病毒感染的细胞在Hsp90AB1基因敲降后病毒蛋白的表达情况;B.对A试验样品中病毒蛋白、病毒N基因mRNA、病毒反基因组RNA和病毒滴度进行定量分析的情况,其中对A中的N、P蛋白水平采用ImageJ软件进行相对定量分析,对病毒N基因mRNA和反基因组RNA进行实时荧光定量RT-PCR相对定量分析,对病毒滴度的相对水平采用基因敲降组TCID50与对照组TCID50的比值表示
A.Immunoblotting analysis of viral protein expressions in Hsp90AB1 knockdown-and virus-infected cells; B.Quantitative analysis of viral proteins,viral N mRNA,anti-genomic RNA and virus titer in A described experimental samples.Comparative quantitative analysis of N and P proteins described in A using ImageJ software.Comparative quantitative analysis of virus N mRNA and anti-genomic RNA in RT-PCR.The relative level of virus titer was indicated as the ratio of TCID50between Hsp90AB1 knockdown group and its control group
图3 Hsp90AB1的敲降对狂犬病病毒感染影响的分析
Fig.3 Analysis of the effect of Hsp90AB1 knockdown on RABV infection
3 讨论
病毒作为一种专门在细胞内寄生的微生物,已经进化成能够利用许多宿主蛋白满足自己高效的复制和传播。细胞内的蛋白能够参与病毒生活周期的多个阶段。诸多研究表明RABV可利用宿主细胞蛋白Hsp70、Hsp90AA1/Cdc37、CCTγ和TLR3等促进其感染[9-12]。尽管如此,挖掘更多参与RABV感染的宿主蛋白对于阐明RABV复杂的复制机制非常重要,而且这对未来开发治疗和防控狂犬病的新策略也是十分有利。
作为伴侣蛋白,Hsp90在哺乳动物细胞中无所不在,它能够参与大量客户蛋白稳定性和活性的维持[1-2]。近期有研究系统分析了Hsp90与宿主蛋白的互作,该研究最终发现Hsp90能够与7% 的转录因子、60%的蛋白激酶和30%的泛素连接酶结合[13]。而客户蛋白病毒蛋白和客户蛋白宿主蛋白一样,也需要Hsp90促进其成熟和维持其稳定性。本实验室近期研究发现在RABV感染过程中Hsp90亚型蛋白Hsp90AA1、Cdc37能够被部分募集至NBs,通过与P蛋白相互作用使之处于稳定状态,进而促进RABV的感染[10]。那作为Hsp90另一亚型蛋白Hsp90AB1是否也在RABV感染过程中发挥着重要作用?本研究通过RNA干扰试验发现,Hsp90AB1可在基因转录或蛋白表达水平上影响RABV的复制,初步发现了Hsp90AB1蛋白在RABV感染过程中的作用方式。至于在Hsp90AB1基因敲降的情况下病毒反基因组和病毒滴度水平未有变化,原因可能是Hsp90AB1基因敲降导致的病毒基因转录或蛋白表达水平的降低未能显著影响病毒复制水平和病毒粒子的组装,这有待进一步通过基因敲除或基因突变后功能性破坏相关试验加以深入研究。遗憾的是,在病毒感染或真核表达情况下,本研究通过免疫共沉淀试验并未发现Hsp90AB1与RABV病毒P或N蛋白的相互作用(试验数据未给出),Hsp90AB1在RABV复制过程中具体的作用方式和作用机理有待更为深入的研究,为解析RABV复杂的复制机理和未来制定狂犬病的治疗策略提供理论依据。
参考文献:
[1] Taipale M,Jarosz D F,Lindquist S.HSP90 at the hub of protein homeostasis:emerging mechanistic insights[J].Nat Rev Mol Cell Biol,2010,11(7):515-528.
[2] Borkovich K A,Farrelly F W,Finkelstein D B,et al.hsp82 is an essential protein that is required in higher concentrations for growth of cells at higher temperatures[J].Mol Cell Biol,1989,9(9):3919-3930.
[3] Ratzke C,Mickler M,Hellenkamp B,et al.Dynamics of heat shock protein 90 C-terminal dimerization is an important part of its conformational cycle[J].Proc Natl Acad Sci USA,2010,107(37):16101-16106.
[4] Grenert J P,Sullivan W P,Fadden P,et al.The amino-terminal domain of heat shock protein 90 (hsp90) that binds geldanamycin is an ATP/ADP switch domain that regulates hsp90 conformation[J].J Biol Chem,1997,272(38):23843-23850.
[5] Dai C,Whitesell L.HSP90:a rising star on the horizon of anticancer targets[J].Future Oncol,2005,1(4):529-540.
[6] Qing G,Yan P,Xiao G.Hsp90 inhibition results in autophagy-mediated proteasome-independent degradation of IkappaB kinase (IKK)[J].Cell Res,2006,16(11):895-901.
[7] Zhang H,Burrows F.Targeting multiple signal transduction pathways through inhibition of Hsp90[J].J Mol Med (Berl),2004,82(8):488-499.
[8] Chen W,Sin S H,Wen K W,et al.Hsp90 inhibitors are efficacious against Kaposi Sarcoma by enhancing the degradation of the essential viral gene LANA,of the viral co-receptor EphA2 as well as other client proteins[J].PLoS Pathog,2012,8(11):e1003048.
[9] Zhang J,Wu X,Zan J,et al.Cellular chaperonin CCTgamma contributes to rabies virus replication during infection[J].J Virol,2013,87(13):7608-7621.
[10] Xu Y,Liu F,Liu J,et al.The co-chaperone Cdc37 regulates the rabies virus phosphoprotein stability by targeting to Hsp90AA1 machinery[J].Sci Rep,2016,6:27123.
[11] Lahaye X,Vidy A,Fouquet B,et al.Hsp70 protein positively regulates rabies virus infection[J].J Virol,2012,86(9):4743-4751.
[12] Menager P,Roux P,Megret F,et al.Toll-like receptor 3 (TLR3) plays a major role in the formation of rabies virus Negri Bodies[J].PLoS Pathog,2009,5(2):e1000315.
[13] Taipale M,Krykbaeva I,Koeva M,et al.Quantitative analysis of HSP90-client interactions reveals principles of substrate recognition[J].Cell,2012,150(5):987-1001.

