猪圆环病毒2型间接ELISA抗体检测试剂盒研制及应用
李 爽,荣桂芬,盛英霞,陈银辉,温 凯,华利忠,熊雅婷,杨若松*
(1.北京维德维康生物技术有限公司,北京 100095;2.山东省畜牧兽医信息中心,山东济南 250022;3.江苏省农业科学院兽医研究所,南京江苏 210014)
猪圆环病毒2型(Porcine circovirus 2,PCV-2)隶属于圆环病毒科,是一种较小的、无包膜的、环状排列的单链DNA病毒[1]。猪圆环病毒2型相对于猪圆环病毒1型来说,具有致病性,可引起猪圆环病毒病。在猪生长发育过程中,PCV-2的感染与多种临床表现密切相关,通常归结为PCV-2相关疾病(PCVAD),包括全身性疾病、肠炎和肺炎[2]。除了引起PCVAD外,PCV-2感染可能导致延长亚临床疾病的病发期,这可能对猪的育肥以及猪肉品质产生消极的影响[3-4]。
1974年,研究者们首次发现在永久性传代的猪肾细胞系中存在一种病毒样的“圆形小颗粒”,8年后,被证实是一种新的病毒——猪圆环病毒。1996年,加拿大学者从患断奶后仔猪多系统衰竭综合征的猪体内分离到 PCV变异株,将其命名为PCV-2[5]。2000年,我国猪场首次发现了PCV-2。猪圆环病毒病作为对全球养猪业具有重大威胁的主要疾病之一[6],也是我国重点原种猪场监测疫病之一。因此,一个好的临床诊断关乎着PCV-2的监测与净化。当前,临床上诊断主要是PCV-2间接ELISA方法。市场上,现有的试剂盒参差不齐,可选择性偏少,故而进行符合市场需求的商品化试剂盒研究。PCV基因组由一条共价闭合环状单股DNA构成,包含2个大的开放阅读框架ORF1和ORF2,分别编码病毒蛋白复制酶(Rep)和病毒衣壳蛋白(Cap)[7]。Cap蛋白具有良好的免疫原性和反应原性,可以进行较好的血清学诊断。本研究以此为包被抗原,建立ELISA方法并优化反应条件,最终形成产品,进行猪圆环病毒2型的血清学诊断。
1 材料与方法
1.1 材料
PCV-2原核表达重组Cap纯化蛋白由本公司合成、表达及纯化;辣根过氧化物酶(HRP)羊抗猪购自亿米诺公司;TMB底物显色液为本公司自备;PCV-2阴阳性对照血清由本公司实验室制备;样本血清为本公司样本库保存;胎牛血清购自美国Gibco公司;96孔可拆式酶标板、酶标仪购自美国Thermo公司;猪圆环病毒2型抗体ELISA检测试剂盒购自于韩国金诺公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 猪圆环病毒2型间接ELISA的建立及优化 对抗原包被量、抗原包被条件、封闭液成分、孵育温度、样品稀释液和二抗稀释液成分,二抗稀释度等进行优化,根据P/N值建立最佳条件。
1.2.2 猪圆环病毒2型间接ELISA反应体系的确立 取酶标板(根据样品多少,可拆开分次使用),将待检血清进行1∶50稀释,取100 μL加至酶标板中。同时设阴、阳性对照各2孔,取阴阳性对照取100 μL加入孔中(不用稀释)。轻轻振匀孔中样品,盖上盖板膜,置室温下温育30 min。弃去孔中的溶液,每孔加入稀释好的洗涤液260 μL,静置30 s后,弃去洗涤液;洗涤4次后在吸水纸上拍干。配制酶结合物工作液:按1∶100,混匀。每孔加酶结合物工作液100 μL,盖上盖板膜,室温(25℃±2℃)下温育30 min。弃去孔中的溶液,洗涤4次后在吸水纸上拍干。将底物A液与底物B液按1∶1混合均匀,加入孔中,100 μL/孔,盖上盖板膜,室温下反应10 min。每孔加入终止液50 μL,5 min内于450 nm/630 nm处测定OD值。
1.2.3 猪圆环病毒2型间接ELISA阴阳性判定标准的建立 利用建立的方法,检测阴性对照血清和阳性对照血清OD450 nm/630 nm差值,并检测通过标杆产品韩国金诺公司产品筛选的20份阴性血清和20份阳性血清OD450 nm/630 nm差值,计算出阴性对照平均OD值和阳性对照平均OD值,以S/P值作为判定阴阳性的标准。
1.2.4 与国外标杆产品的比对 用本自制产品与韩国金诺公司产品对187份猪血清进行检测,后分析本自制产品的敏感性、特异性和符合率。
1.2.5 猪圆环病毒2型抗体检测试剂盒的批间、批内重复性 用3个不同批次组装的试剂盒检测同样5份血清,根据OD450 nm/630 nm差值标准差和变异系数分析其批间重复性。使用同一批次组装的试剂盒检测同样5份血清,根据OD450 nm/630 nm差值标准差和变异系数分析其批内重复性。
1.2.6 猪圆环病毒2型抗体检测试剂盒稳定性试验 4℃条件下,利用同一份血清检测OD450 nm/630 nm差值以及阴阳性对照血清OD450 nm/630 nm差值。检测时间分别为0 d、15 d、1个月、3个月、6个月和12个月。计算3批次的S/P值,探究试剂盒的有效期。
1.2.7 猪圆环病毒2型抗体检测试剂盒的应用 利用自制猪圆环病毒2型抗体检测试剂盒产品对江苏A猪场和B猪场进行猪圆环病毒2型抗体检测。江苏A猪场随机抽取哺乳期、保育期、断奶期、育肥期、怀孕和空怀猪共45份样品进行检测,B猪场检测15头免疫疫苗母猪的基础上,探究后代不同周龄的仔猪抗体水平变化。
2 结果
2.1 猪圆环病毒2型间接ELISA的建立及优化
根据P/N值确定了抗原包被浓度为2 μg/mL,4℃包被过夜,封闭液选用50 mL/L胎牛血清-PBST液,37℃封闭2 h;待检血清以PBS缓冲液按1∶50稀释,室温孵育30 min;酶结合物以自制含防腐剂酶结合物稀释液按照1∶100稀释,室温下孵育30 min;TMB底物显色液,室温下显色10 min;浓硫酸终止显色,用酶标仪450 nm/630 nm波长测定各反应孔的OD值。
2.2 猪圆环病毒2型间接ELISA阴阳性判定标准的建立
对阴性对照血清、阳性对照血清、20份阴性血清和20份阳性血清OD450 nm/630 nm差值(表1)。结果表明,阴性对照OD450 nm/630 nm平均值为0.118,阳性对照OD450 nm/630 nm差值平均值为2.132。综合阴阳性血清结果得出,当阴性对照平均OD值<0.20且阳性对照平均OD值>1.0,试验结果才有效;否则,应进行重复试验。根据公式S/P=(样本OD值-阴性对照平均值)/(阳性对照平均OD值-阴性对照平均值),确定判定方法为S/P≥0.15为阳性;0.15>S/P≥0.1判为可疑;S/P<0.1为阴性。

表1 ELISA检测猪血清结果(OD450 nm/630 nm差值)
2.3 与国外标杆韩国金诺公司产品的比对
与韩国金诺公司产品完成了267份临床样本的比对试验,结果证明,本研究中发明的ELISA产品与标杆产品的阳性符合率为97.8%,阴性符合率为92.8%,总体符合率达到了95%(表2)。
2.4 猪圆环病毒2型抗体检测试剂盒的批间、批内重复性
用3个不同批次组装的试剂盒检测同样5份血清OD450 nm/630 nm差值,结果见表3。批间变异系数在1.20%~6.89%之间,均小于10%。表明猪圆环病毒2型抗体检测试剂盒不同批次间的可重复性比较好。

表2 与国外进口标杆品牌符合度对比结果
使用同一批次组装的试剂盒检测同样5份血清,根据OD450 nm/630 nm差值标准差和变异系数分析其批内重复性(表4)。批内变异系数在0.90%~6.21%之间,均小于10%。表明猪圆环病毒2型抗体检测试剂盒同批次内的可重复性比较好。
2.5 猪圆环病毒2型抗体检测试剂盒4℃保存试验
4℃条件下,测得0 d、15 d、1个月、3个月、6个月、12个月结果,可见4℃条件下,12个月S/P值基本恒定,故可以保存1年(表5)。
2.6 猪圆环病毒2型抗体检测试剂盒的应用
利用本研制猪圆环病毒2型抗体检测试剂盒对江苏A猪场(未免疫)和B猪场(母猪产前1个月免疫勃林格殷格翰圆环灭活疫苗,仔猪出生21后免疫该疫苗)进行猪圆环病毒2型抗体检。江苏A猪场阳性率为82.2%,B猪场免疫母猪及后代的阳性率为98.3%(表6)。对江苏A猪场这45头母猪及育肥猪进行S/P值分析比较得出,断奶和保育时(4周、6周)S/P值较低(图1)。B猪场免疫母猪及后代基本都是阳性,但母猪相对子代的抗体水平高(图2和图3)。
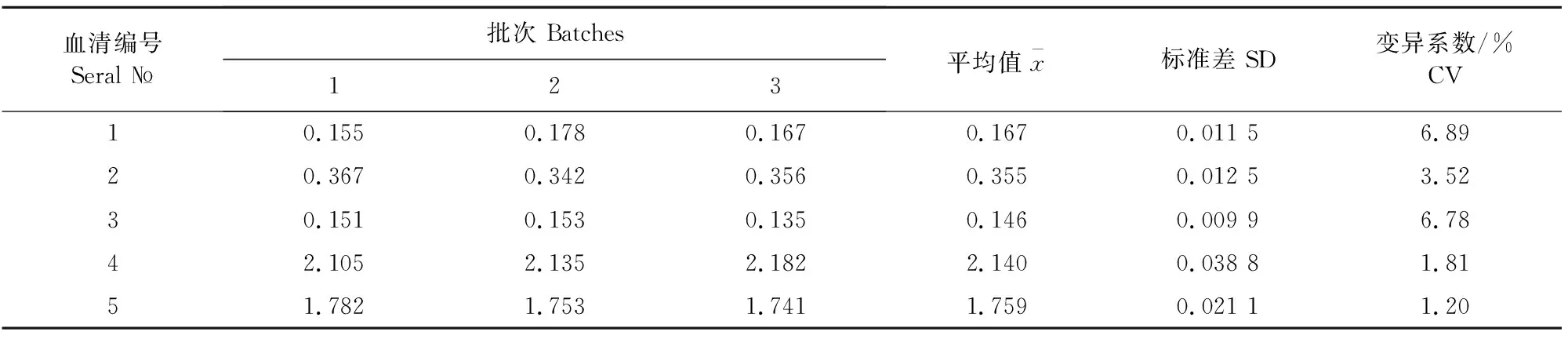
表3 批间重复性试验结果
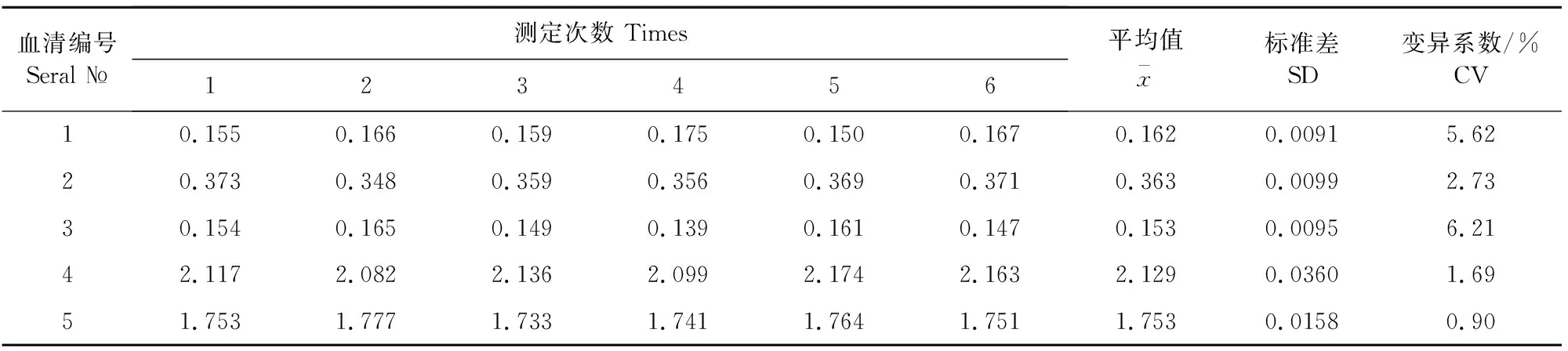
表4 批内重复性试验结果

表5 4℃保存试验(S/P值)
3 讨论
猪圆环病毒病给全球的养猪业带来了巨大的冲击,包括断奶仔猪多系统衰竭综合征、猪皮炎与肾病综合征、呼吸道疾病综合征、增生性坏死性肺炎、新生仔猪先天性震颤与怀孕母猪的繁殖障碍等疾病,而断奶仔猪多系统衰竭综合征致死率最高[8]。猪圆环病毒Cap蛋白为病毒的独特的结构蛋白,是主要的免疫原性蛋白[9-10]。本研究采取低温低诱导剂浓度原核表达获取Cap纯化蛋白,保证了蛋白正常折叠、可溶性表达,防止蛋白异常折叠形成包涵体,尽最大可能维持原有的抗原表位,利于该病的诊断。并且采取大肠杆菌原核表达有利于较短时间获得大量抗原,保证了试剂盒产品原料的供应。

表6 江苏A猪场和B猪场ELISA检测结果

图1 A猪场猪圆环病毒抗体S/P值

图2 B猪场猪圆环病毒抗体S/P值

实线指阳性阈值,虚线为阴性阈值
The solid line refers to the positive threshold,and dashed line is the negative threshold
图3 B猪场猪圆环病毒抗体S/P值及离散度
Fig.3 S/P values and dispersion of PCV-2 antibody
我国国标中,采用PCR方法检测PCV-2抗原来诊断该病。PCV-2抗体竞争ELISA方法以其良好的特异性[11]也被越来越多地应用。免疫组化也是检测PCV-2抗原经典的检测方法。后有生物学家在此方法基础上,使用免疫胶体标记抗体,提高了检测效果。另外,还有免疫荧光的方法。目前,国内外均已有免疫荧光PCV-2检测试剂盒。本产品与本研究参比标杆产品韩国金诺公司猪圆环病毒2型抗体ELISA检测试剂盒同为间接ELISA方法。无论从敏感性、特异性还是总体符合率,二者具有高度一致性。说明本研制产品具有较好的诊断效果,其结果可靠性较好。
利用本研制试剂盒对猪场进行检测,可以看出,猪圆环病毒2型在我国猪场普遍存在,这与文献[12]报道一致。A猪场研究发现,断奶和保育时(4周、6周)抗体水平低,可能是由于体内含有少量母源抗体,一方面含量较低,另一方面抵抗野毒感染。育肥期母源抗体减少,又受到外界感染,导致抗体水平升高。B猪场免疫后,母猪抗体水平较高且与子代基本都为阳性,说明疫苗免疫效果较好。不同周龄的仔猪的抗体消涨变化侧面也印证母源抗体降低,可能又诱发新的感染状况。因此,通过猪圆环病毒2型间接ELISA抗体检测试剂盒的应用,对免疫猪场抗体监测以及带毒猪场的净化具有重要的意义。
参考文献:
[1] Xi X,Mo X,Xiao Y,et al.Production ofEscherichiacoli-based virus-like particle vaccine against porcine circovirus type 2 challenge in piglets:Structure characterization and protective efficacy validation [J].J Biotechnol,2016,223:8-12.
[2] Bucarey S A,Pujol M,Poblete J,et al.Chitosan microparticles loaded with yeast-derived PCV2 virus-like particles elicit antigen-specific cellular immune response in mice after oral administration[J].Virol J,2014,11(1):149.
[3] Oliver-Ferrando S,Segalés J,López-Soria S,et al.Evaluation of natural porcine circovirus type 2 (PCV2) subclinical infection and seroconversion dynamics in piglets vaccinated at different ages [J].Vet Res,2016,47(1):121.
[4] Blomström A L,Fossum C,Wallgren P,et al.Viral metagenomic analysis displays the co-infection situation in healthy and PMWS affected pigs[J].PLoS One,2016,11(12):e0166863.
[5] Kurtz S,Grau-Roma L,Cortey M,et al.Pigs naturally exposed to porcine circovirus type 2 (PCV2) generate antibody responses capable to neutralise PCV2 isolates of different genotypes and geographic origins[J].Vet Res,2014,45(1):29.
[6] Huang Y,Liu Z,Bo R,et al.The enhanced immune response of PCV-2 vaccine usingRehmanniaglutinosapolysaccharide liposome as an adjuvant [J].Int J Biol Macromol,2016,86:929-936.
[7] Zheng G,Lu Q,Wang F,et al.Selection of affinity peptides for the purification potential of porcine circovirus type 2 (PCV2) Cap virus-like particles (VLPs)[J].RSC Adv,2017,7(62):38911-38914.
[8] Tassis P D,Tsakmakidis I,Papatsiros V G,et al.A randomized controlled study on the efficacy of a novel combination vaccine against enzootic pneumonia (Mycoplasmahyopneumoniae) and porcine circovirus type 2 (PCV2) in the presence of strong maternally derived PCV2 immunity in pigs [J].BMC Vet Res,2017,13(1):91.
[9] Fotso G B K,Bernard C,Bigault L,et al.The expression level of gC1qR is down regulated at the early time of infection with porcine circovirus of type 2 (PCV-2) and gC1qR interacts differently with the Cap proteins of porcine circoviruses [J].Virus Res,2016,220:21-32.
[10] Zhu S,Zhang C,Wang J,et al.Immunity elicited by an experimental vaccine based on recombinant flagellin-porcine circovirus type 2 Cap fusion protein in piglets[J].PLoS One,2016,11(2):e0147432.
[11] Han S,Xiao Y,Zheng D,et al.Establishment and application of a competitive enzyme-linked immunosorbent assay differentiating PCV2 antibodies from mixture of PCV1/PCV2 antibodies in pig sera [J].BMC Vet Res,2016,12(1):175.
[12] Zhan Y,Wang N,Zhu Z,et al.In silico analyses of antigenicity and surface structure variation of an emerging porcine circovirus genotype 2b mutant,prevalent in southern China from 2013 to 2015 [J].J Gen Virol,2016,97(4):922-933.

