茶叶中多种氨基酸15N同位素丰度的检测研究
侯 捷,张鹏帅,侯静华,雷 雯,杜晓宁
(上海化工研究院有限公司 国家同位素工程技术研究中心上海分中心上海稳定性同位素工程技术研究中心,上海 200062)
茶叶中富含多种氨基酸,是构成茶叶品质和滋味的重要成分,对茶叶香气的形成有着重要的作用[1]。氨基酸在茶叶加工过程中参与茶叶香气的形成,由氨基酸所转化成的醇类等挥发性物质都是茶叶的香味物质。如茶氨酸可以缓解茶叶的苦涩味增强其甜味,是茶叶品质评价的重要因子之一[2-5],丝氨酸、丙氨酸的甜味,谷氨酸、谷氨酰胺、天冬酰胺具有的鲜甜带酸滋味特性共同影响了茶叶的品质和滋味[6-8]。对茶叶中具有呈味特性的氨基酸(茶氨酸、谷氨酸、谷氨酰胺、天冬酰胺、丝氨酸、丙氨酸)进行含量测定,可以评价茶叶的品质级别[9]。随着代谢组学的发展,通过稳定同位素示踪技术可以追踪目标化合物的合成与代谢过程,进而有效地对目标氨基酸的生成过程进行调控。如利用13CO2研究茶树呼吸作用对茶叶品质的影响;通过对茶树施加15N标记硝态氮、15N标记铵态氮等氮肥,检测茶树体对肥料的转化利用情况,通过氨基酸在茶树体内的代谢积累,进而研究茶树对土壤中不同氮素肥料的利用水平[10-11]。现有文献大多是对不同基质中的氨基酸含量进行分析[12-18],而关于样品中15N标记氨基酸同位素丰度的检测方法的报道较少[19]。本文以茶叶中15N富集氨基酸的同位素丰度检测为例,在优化的衍生化条件下建立气相色谱-质谱联用测定植物中15N富集氨基酸同位素丰度的检测方法,在10%~98%的15N同位素丰度范围内对方法进行验证,并对茶叶中六种目标氨基酸的同位素丰度进行测定。
1 主要仪器与试剂
气相色谱-质谱联用仪:GC-MS/MS,7890B-7000C,美国Agilent公司;HP-5 MS毛细管柱:30 m×0.25 mm×0.25 μm,美国Agilent公司;电子天平:精度0.01 mg,美国OHAUS;真空干燥箱:上海一恒科学仪器有限公司;超声机:上海一恒科学仪器有限公司;涡旋震荡机:上海安谱科技有限公司;氮吹仪:上海安谱科技有限公司;低温高速离心机:韩国Heraeus公司;超纯水系统:美国Merck Millipore 公司。
衍生化试剂N-甲基-N-(三甲基硅烷)三氟乙酰胺(MSTFA):美国Regis Technologies公司;天然丰度氨基酸标准品:茶氨酸(纯度98.5%)、丙氨酸(纯度99.0%)、天门冬酰胺(纯度98.5%)、谷氨酸(纯度99.2%)、谷氨酰胺(纯度98.5%)、丝氨酸(纯度99.0%):购于德国Dr.Ehrenstorfer GmbH公司;稳定同位素15N标记高丰度氨基酸对照品:丙氨酸-15N(纯度98.5%,丰度98.5%)、天门冬酰胺-15N2(纯度98.2%,丰度98.1%)、谷氨酸-15N(纯度98.8%,丰度98.2%)、谷氨酰胺-15N2(纯度98.6%,丰度98.8%)、丝氨酸-15N(纯度98.1%,丰度95.5%):上海化工研究院有限公司稳定性同位素工程技术研究中心研制,同位素丰度由气体同位素质谱仪(Finnigan MAT-271)测定;绿茶样品:中科院茶叶研究所(杭州)提供;乙腈(色谱级):西班牙Scharlab公司;甲苯(分析纯)、吡啶(分析纯):上海凌峰化学试剂有限公司。
2 实验方法
2.1 氨基酸对照品的配制
天然丰度氨基酸对照品:称取谷氨酸10.3 mg,谷氨酰胺10.3 mg,天冬酰胺9.7 mg,丙氨酸10.2 mg,丝氨酸9.0 mg,茶氨酸9.1 mg,每种氨基酸均溶于水并定容至10 mL容量瓶中,作为天然丰度氨基酸对照品待用,除15N标记的茶氨酸外,其余5种15N标记的氨基酸称取相同的质量,均溶于水并定容至10 mL容量瓶中,作为15N标记高丰度氨基酸对照品待用。将天然丰度氨基酸对照品与15N标记高丰度氨基酸对照品按照9∶1、8∶2、7∶3、5∶5、2∶8的比例制成不同丰度的氨基酸对照品。取上述对照品及纯15N标记高丰度氨基酸溶液各50 μL于气相瓶中,氮吹干,依次加入200 μL吡啶和200 μL MSTFA,80 ℃下反应60 min,待GC-MS分析。
2.2 茶叶样品的处理
称取粉碎后的茶叶样品0.251 1 g,加入5 mL煮沸的蒸馏水,水浴加热10 min,待冷却后,转入25 mL离心管中,以10 000 r/min的速率离心15 min,上清液氮吹干后,40 ℃真空干燥2 h,依次加入500 μL吡啶和500 μL MSTFA,80 ℃下反应60 min,待GC-MS分析。
2.3 实验条件
2.3.1色谱条件 色谱柱:Agilent HP-5 MS毛细管柱(30 m×0.25 mm×0.25 μm);载气He(纯度99.999%),流速1.0 mL/min;进样口温度290 ℃;升温程序:以5 ℃/min由80 ℃升至110 ℃,然后以10 ℃/min升至150 ℃,以5 ℃/min升至170 ℃,再以10 ℃/min升至250 ℃,最后以20 ℃/min升至300 ℃;进样量1 μL;分流比10∶1。
2.3.2质谱分析条件 电子轰击离子源(EI),电离能量70 eV;全扫描(Scan)模式,扫描范围m/z50~500;离子源温度230 ℃;四极杆温度150 ℃;接口温度300 ℃。
3 结果与讨论
3.1 氨基酸衍生化方法优化
3.1.1衍生化试剂 有报道以MSTBFA[20]或MDBSTFA[21]为衍生化试剂,研究了大肠杆菌、酵母等微生物中或菌体内13C标记氨基酸同位素丰度。对比了BFTFA(N,O-双(三甲基硅烷基)三氟乙酰胺)和MSTFA(N-甲基-N(三甲基硅烷基)三氟乙酰胺)对目标氨基酸的衍生化效果。在硅烷化反应进程中,三甲基硅烷(TMS)将取代氨基酸中含有活性氢的基团(羧基上的H和氨基上的H),如图1所示。与BSFTA相比,MSTFA对目标氨基酸的衍生化效率更高。

图1 丙氨酸与MSTFA的反应Fig.1 Derivatization reaction of alanine with MSTFA
辅助有机溶剂对衍生化效果也有一定影响,辅助溶剂是待测物中某些物质的配体,会影响衍生化反应的速率。比较乙腈、吡啶、甲苯作为辅助溶剂对目标氨基酸衍生化效果的影响,结果示于图2。从单种氨基酸分别以乙腈、吡啶、甲苯作为辅助衍生化试剂的比较可见,甲苯和吡啶作为溶剂的衍生化效果较好,然而吡啶对于天冬酰胺的衍生化效率很低,综合考虑,选用甲苯作为辅助衍生试剂。
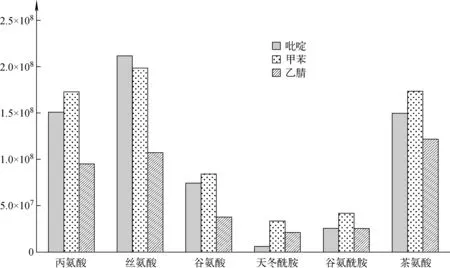
图2 辅助溶剂对目标氨基酸衍生化效率的影响Fig.2 Effect of solvent on derivatization
3.1.2衍生化温度及时间 衍生化的温度及时间也是影响衍生化效率的因素。以甲苯作为辅助溶剂,对比了茶氨酸在60、70、80、90 ℃分别衍生20、40、60 min时的效果,随着温度升高、衍生化时间的增加,茶氨酸的衍生化效率提高,结果示于图3。综合考虑,确定衍生化温度为80 ℃,衍生时间为60 min。
3.2 氨基酸对照品的检测
3.2.1天然丰度氨基酸与15N标记氨基酸的GC-MS图谱分析 将衍生化的氨基酸对照品进行GC-MS分析,改变气相色谱的升温程序,茶氨酸和谷氨酰胺始终没有达到基线分离,本文主要对氨基酸的同位素丰度进行分析,茶氨酸和谷氨酰胺没有基线分离并不会对同位素丰度计算产生影响。将氨基酸衍生物的离子碎片信息在NIST谱库中进行匹配,6种天然丰度氨基酸衍生物的出峰顺序为:丙氨酸、丝氨酸、谷氨酸、天冬酰胺、茶氨酸、谷氨酰胺。天然丰度氨基酸对照品和15N标记氨基酸对照品衍生物的GC-MS总离子流图示于图4。
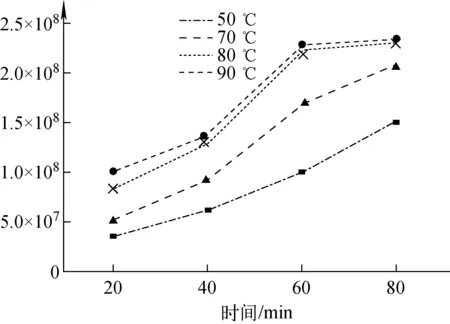
图3 衍生温度及时间对目标氨基酸衍生化效率的影响Fig.3 Effect of temperature on derivatization

1——丙氨酸;2——丝氨酸;3——谷氨酸;4——天冬酰胺;5——茶氨酸;6——谷氨酰胺 图4 天然丰度氨基酸对照品(a)和15N标记氨基酸对照品(b)衍生物的GC-MS总离子流图1——Alanine;2——Serine;3——Glutamic acid;4——Asparagine;5——Theanine;6——GlutamineFig.4 Total ion chromatograms of natural abundance (a) and high abundance 15N labeling (b) reference substance derivatives
根据氨基酸衍生物的出峰时间以及离子碎片信息,对15N标记的氨基酸衍生物进行定性分析。以谷氨酸为例,天然丰度的谷氨酸出峰时间为15.5 min,基峰为m/z246,EI质谱图如图5a所示;15N标记亮氨酸的出峰时间与天然丰度相同,且只有1个N被15N取代,其基峰为m/z247,如图5b所示。
天然丰度氨基酸和15N标记氨基酸具有相同的色谱行为,出峰时间相同。由于氨基酸中的N被15N取代个数的不同,从而具有不同的特征离子碎片,结果列于表1。
3.2.2不同15N丰度氨基酸的检测方法精密度和准确度的验证 茶叶中氨基酸的合成以及代谢是一个较为复杂的过程,受多种环境条件的影响,实际样品中目标氨基酸的同位素丰度分布范围较大。为了验证在不同同位素丰度水平下所建立方法的准确度,利用不同比例的天然丰度氨基酸和高丰度氨基酸配制了15N同位素丰度为10%、20%、30%、50%、80%、98%的样品对方法进行验证(配制方法见2.1),检测结果列于表2。

图5 天然丰度谷氨酸(a)和15N标记谷氨酸(b)EI图谱(※:标记位置)Fig.5 Electron impact (EI) spectra of natural glutamic acid (a) and high abundance 15N labeling glutamic acid (b) (※: labeling site)

氨基酸分子式保留时间/min特征离子碎片m/z15N标记个数包含标记位点特征离子碎片m/z丙氨酸丝氨酸谷氨酸天冬酰胺茶氨酸谷氨酰胺C3H7NO2C3H7NO3C5H9NO4C4H8N2O3C7H14N2O3C5H10N2O36.811.315.816.017.517.9116204246188273245111122117205247189275247

表2 不同丰度的丙氨酸、丝氨酸、谷氨酸、天冬酰胺、谷氨酰胺测定结果的验证Table 2 Isotope abundance of 15N labeling amino acids
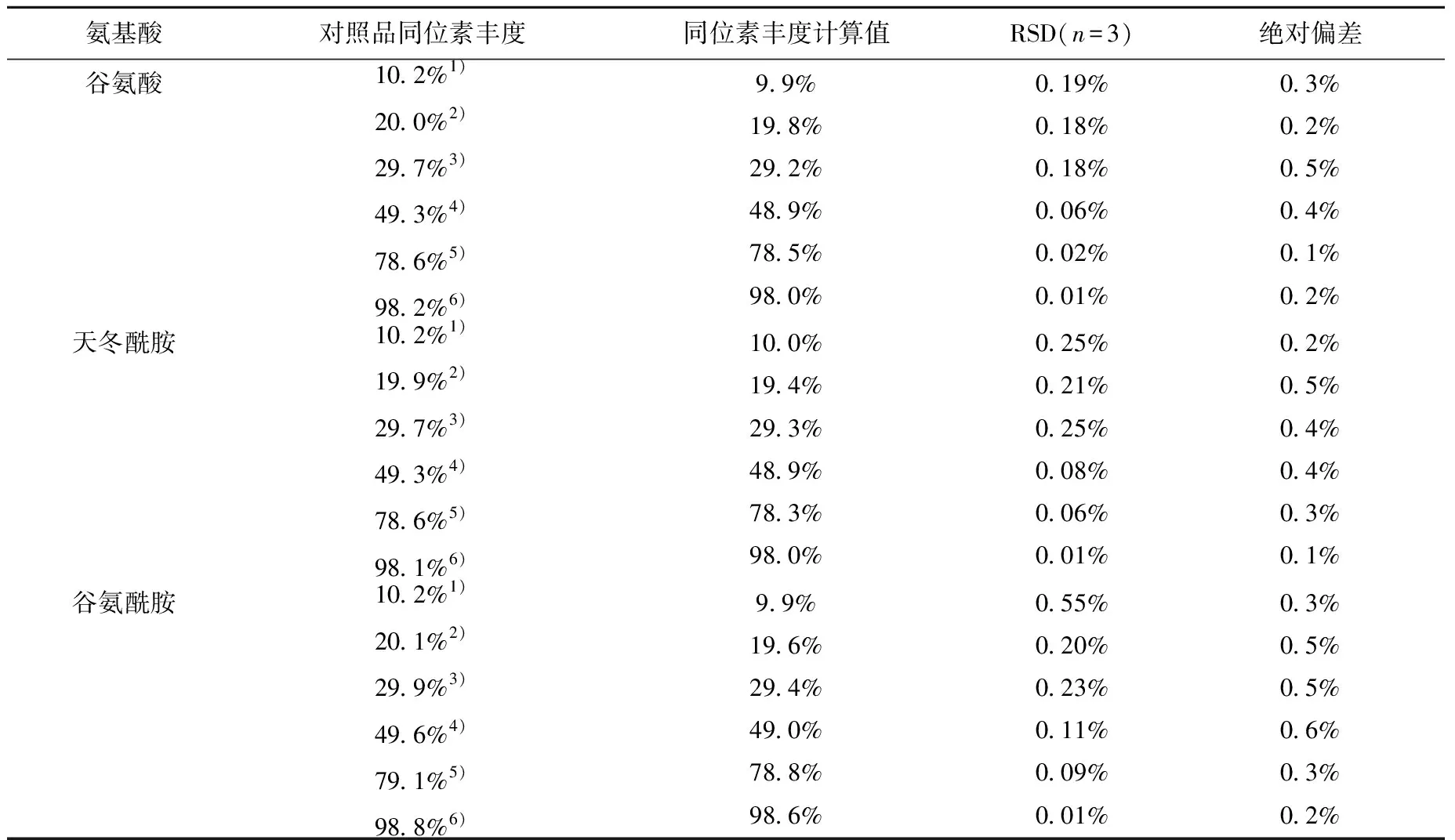
续表2
注:同位素丰度:1) 10%15N;2) 20%15N;3) 30%15N;4) 40%15N;5) 80%15N;6) 98%15N。
由表2可见,连续3次进样并计算同位素丰度,其精密度RSD小于0.6%。同位素丰度计算值与理论值基本相符,绝对偏差小于0.6%,说明方法在不同同位素丰度水平下均具有较好的准确度,同位素丰度计算方法可以满足测定需求。
3.3 茶叶6种15N标记氨基酸的检测
将茶叶样品中的氨基酸进行提取和衍生化处理后,使用建立的方法进行分析,GC-MS离子流图示于图6。
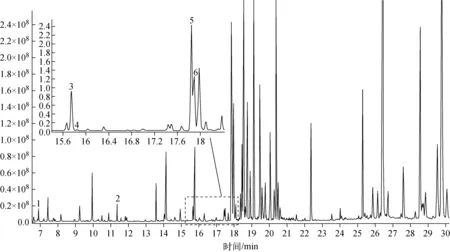
1——丙氨酸;2——丝氨酸;3——谷氨酸;4——天冬酰胺;5——茶氨酸;6——谷氨酰胺 图6 茶叶中氨基酸衍生化离子流图1——Alanine;2——Serine;3——Glutamic acid;4——Asparagine;5——Theanine;6——GlutamineFig.6 Total ion chromatograms of amino acids derivatives in tea
由图6中可以识别60余色谱峰,其中6种目标氨基酸均被检出。目标氨基酸的保留时间与天然丰度对照品(见图4a)相互对应,EI图谱中特征离子与表1一致(如图7所示)。通过特征离子质量簇[22],计算得出6种目标氨基酸的同位素丰度值列于表3。
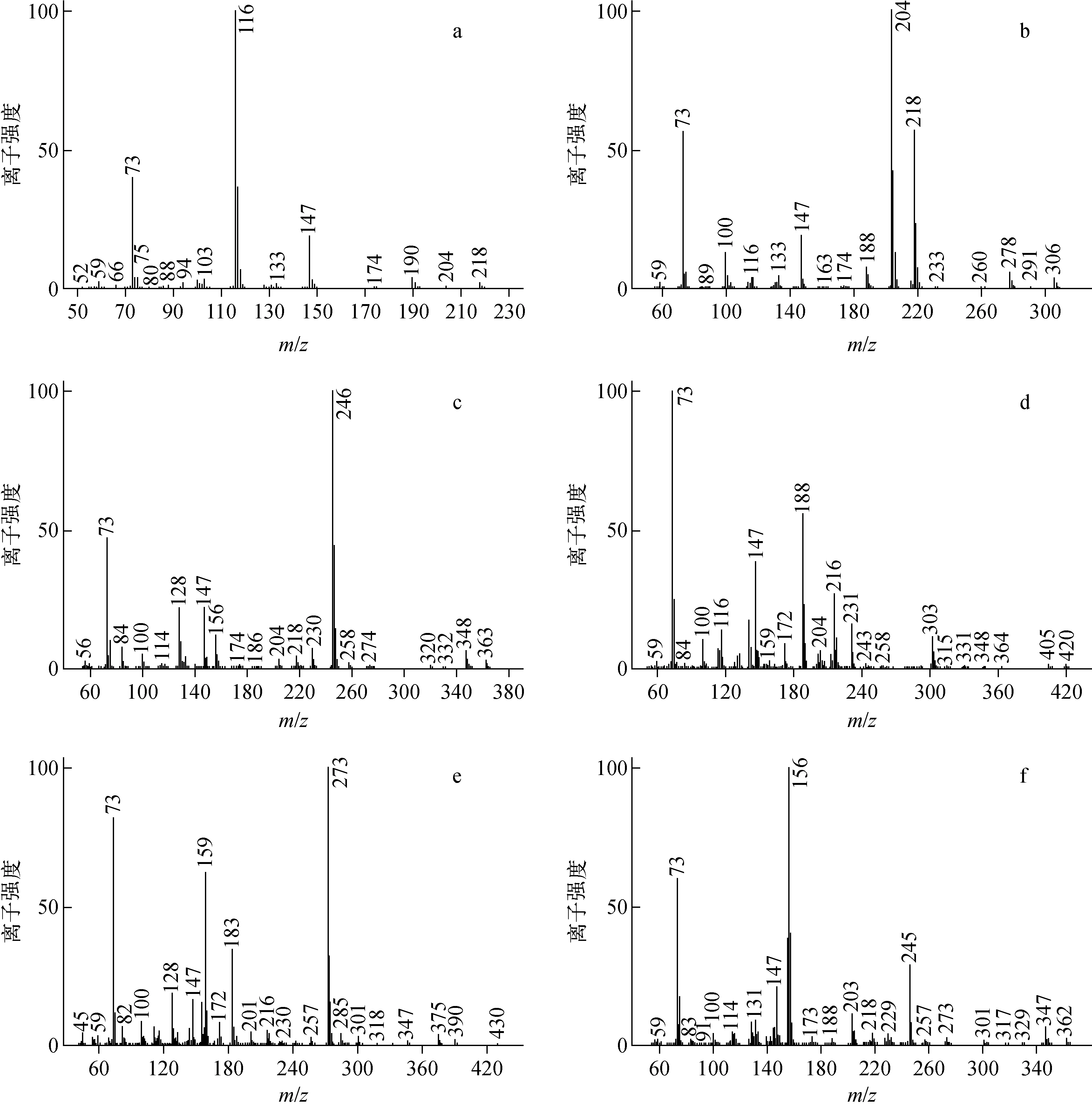
a——丙氨酸;b——丝氨酸;c——谷氨酸;d——天冬酰胺;e——茶氨酸;f——谷氨酰胺 图7 茶叶中目标氨基酸EI图谱a——Alanine;b——Serine;c——Glutamic acid;d——Asparagine;e——Theanine;f——GlutamineFig.7 Electron impact (EI) spectra of targets in tea
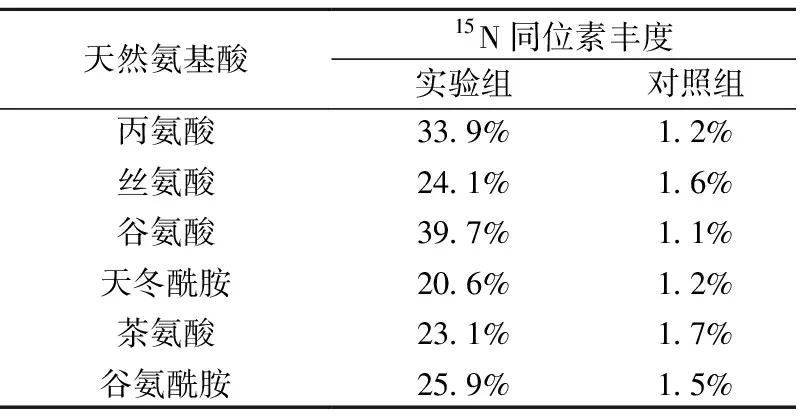
天然氨基酸15N同位素丰度实验组对照组丙氨酸丝氨酸谷氨酸天冬酰胺茶氨酸谷氨酰胺33.9%24.1%39.7%20.6%23.1%25.9%1.2%1.6%1.1%1.2%1.7%1.5%
由表3可以看出,实验组中6种目标氨基酸的同位素丰度均显著高于对照组,说明茶叶通过吸收15N标记的氮肥,经代谢转化形成了15N标记的氨基酸,证实了相关代谢通路的存在。
4 结论
在优化的衍生化条件下,建立了气质联用测定茶叶中丙氨酸、丝氨酸、谷氨酸、天冬酰胺、茶氨酸、谷氨酰胺同位素丰度的检测方法。通过对不同同位素丰度水平的样品测定,验证了方法的同位素检测结果良好,同位素丰度绝对偏差小于0.6%,方法的精密度优于0.6%。通过对茶叶实际样品中六种氨基酸同位素丰度的测定可以看出,利用高丰度15N氮肥作为肥料的茶叶样品其氨基酸的同位素丰度显著高于对照组, 根据对不同采样时间、不同条件下的茶叶中氨基酸同位素丰度的测定,可以系统地研究茶叶中氨基酸的转化路径及代谢循环规律,为茶叶品质的研究提供依据。所建立的方法也可推广至其他不同农作物中氨基酸同位素丰度的检测,为植物中氨基酸相关转化路径及代谢循环研究提供技术支持。
参考文献:
[1] 毛清黎. 茶叶氨基酸的研究进展[J]. 氨基酸和生物资源,1989,(4):16-21.
Mao Qingli. Research progress of amino acids in tea[J]. Amino Acids and Biological Resources, 1989, (4): 16-21(in Chinese).
[2] 赵璇,李新生,韩豪,等. 汉中茶叶氨基酸含量测定及营养价值评价分析[J]. 氨基酸和生物资源,2016,38(1):17-23.
Zhao Lu, Li Xinsheng, Han Hao, et al. Determination of amino acids in tea from Hanzhong and evaluation of nutritional value[J]. Amino Acids and Biologic Resources, 2016, 38(1): 17-23(in Chinese).
[3] 张佳,王川丕,阮建云. GC-MS及GC测定茶叶中主要游离氨基酸的方法研究[J]. 茶叶科学,2010,30(6):43-50.
Zhang Jia, Wang Chuanxi, Qi Jianyun. Determination of free amino acids in tea by GC-MS and GC[J]. Tea Science, 2010, 30(6): 43-50(in Chinese).
[4] 谭和平,陈丽,叶善蓉,等. 茶叶中氨基酸的测试方法概述[J]. 中国测试,2007,33(6):1-4.
Tan Heping, Chen Li, Ye Shanrong, et al. An overview of test methods for amino acids in tea[J]. China Test, 2007, 33(6): 1-4(in Chinese).
[5] 倪君,须海荣. 茶叶氨基酸检测方法的研究进展[J]. 茶叶,2007,33(2):63-66.
Ni Jun, Xu Hairong. Progress in research on detection methods of amino acids in tea leaves[J]. Tea, 2007, 33(2): 63-66(in Chinese).
[6] 康维民,贾文沦. L—茶氨酸的功能及在食品加工中的应用[J]. 中国食品添加剂,2000(1):59-63.
Kang Weimin, Jia Wenyu. The function of L-theanine and its application in food processing[J]. China Food Additives, 2000(1): 59-63(in Chinese).
[7] 赵丹,王朝旭. 茶氨酸的国内外研究现状[J]. 食品科学,2002,23(5):145-147.
Zhao Dan, Wang Chaoxu. Research status of theanine at home and abroad[J]. Food Science, 2002, 23(5): 145-147(in Chinese).
[8] 戴军,王洪新,陈尚卫,等. 茶叶及茶多酚中儿茶素的高效液相色谱分析方法研究[J]. 色谱,2001,19(5):398-402.
Dai Jun, Wang Hongxin, Chen Shangwei, et al. High performance liquid chromatographic analysis of catechins in tea and tea polyphenols[J]. Chinese Journal of Chromatography, 2001, 19(5): 398-402(in Chinese).
[9] 何书美,刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学,2007,35(9):1 365-1 368.
He Shumei, Liu Jinglan. Determination of total flavonoids in tea leaves[J]. Chinese Journal of Analytical Chemistry, 2007, 35(9): 1 365-1 368(in Chinese).
[10] 王新超,杨亚军,陈亮,等. 利用15N标记研究不同品种茶树氮肥利用率差异[J]. 福建茶叶,2005,(1):4-5.
Wang Xinchao, Yang Yajun, Chen Liang, et al. Study on the difference of nitrogen fertilizer utilization in different tea plants with15N marker[J]. Fujian Tea, 2005, (1): 4-5(in Chinese).
[11] Zhang Z, Shi Y, Lifeng M A, et al. Effect of different plucking standards and nitrogen application levels on the spring shoot yield, quality-related chemical compounds and N utilization efficiency of tea plants[J]. Journal of Tea Science, 2014.
[12] 齐建双,铁双贵,韩小花,等. 氨基酸分析仪法快速测定玉米籽粒中赖氨酸含量[J]. 中国农学通报,2014,30(30):1 340-1 342.
Qi Jianshuang, Tie Suigui, Han Xiaohua, et al. Rapid determination of lysine content in maize kernels with amino acid analyzer[J]. Chinese Agricultural Science Bulletin, 2014, 30(30): 1 340-1 342(in Chinese).
[13] 孙言春,许宪祝,徐衍岭,等. 柱前衍生-超高效液相色谱法测定鱼卵中的17种氨基酸[J]. 色谱,2013,31(3):275-280.
Sun Yanchun, Xu Xianzhu, Xu Yanling, et al. Determination of 17 amino acids in fish eggs by pre-column derivatization-ultra-performance liquid chromatography[J]. Chinese Journal of Chromatography, 2013, 31(3): 275-280(in Chinese).
[14] 王玉红,申克宇,李鹏,等. 高效液相色谱-蒸发光散射检测法直接检测20种未衍生基本氨基酸[J]. 色谱,2011,29(9):908-911.
Wang Yuhong, Shen Keyu, Li Peng, et al. Direct detection of 20 underivatised essential amino acids by high performance liquid chromatography with evaporative light scattering detection[J]. Chinese Journal of Chromatography, 2011, 29(9): 908-911(in Chinese).
[15] 陈永波,降巧龙. 魔芋的抗病性与叶片中水溶性氨基酸含量的关系[J]. 色谱,2008,26(3):370-373.
Chen Yongbo, Qi Qiaolong. Relationship between disease resistance of konjac and water soluble amino acids in leaves[J]. Chinese Journal of Chromatography, 2008, 26(3): 370-373(in Chinese).
[16] Bosch L, Alegría A, Farré R. Application of the 6-aminoquinolyl-N-hydroxysccinimidyl carbamate (AQC) reagent to the RP-HPLC determination of amino acids in infant foods[J]. Journal of Chromatography B, 2006, 831(1-2): 176.
[17] Guo M, Shi T, Duan Y, et al. Investigation of amino acids in wolfberry fruit (Lycium barbarum) by solid-phase extraction and liquid chromatography with precolumn derivatization[J]. Journal of Food Composition & Analysis, 2015, 42: 84-90.
[18] Rebane R, Herodes K. Comparison of three buffer solutions for amino acid derivatization and following analysis by liquid chromatography electrospray mass spectrometry[J]. Journal of Chromatography A, 2012, 1245(13): 134.
[19] 侯捷,雷雯,杜晓宁,等. 气相色谱-质谱联用法分析15N标记精氨酸发酵液中的氨基酸组分及其同位素丰度[J]. 分析测试学报, 2016, 35(9):1 132-1 136.
Hou Jie, Lei Wen, Du Xiaoning, et al. Analysis of amino acid composition and isotopic abundance in15N-labeled arginine fermentation broth by gas chromatography-mass spectrometry[J]. Journal of Analytical Testing, 2016, 35( 9): 1 132-1 136(in Chinese).
[20] 李敏超,黄明志,刘玉伟,等. 气相色谱-质谱联用选择离子监测方法定量分析低浓度胞内游离氨基酸的13C同位素丰度[J]. 分析化学,2014,42(10):1 408-1 413.
Li Minchao, Huang Mingzhi, Liu Yuwei, et al. Quantitative analysis of13C isotope abundance of low concentration free amino acids by gas chromatography-mass spectrometry with selective ion monitoring[J]. Chinese Journal of Analytical Chemistry, 2014, 42(10): 1 408-1 413(in Chinese).
[21] 王建,王泽建,黄明志,等.13C MFA过程中GC-MS分析菌体蛋白氨基酸的13C标记丰度[J]. 中国生物工程杂志,2009,29(7):87-93.
Wang Jian, Wang Zejian, Huang Mingzhi, et al.13C labeling abundance of amino acids of bacterial proteins analyzed by GC-MS during13C MFA[J]. China Biotechnology, 2009, 29(7): 87-93(in Chinese).
[22] 雷雯,侯捷,杜晓宁,等. 血液中15N标记氨基酸同位素丰度[J]. 分析化学,2015,43(10):1 465-1 471.
Lei Wen, Hou Jie, Du Xiaoning, et al. Isotope abundance of 15 amino acids in blood[J]. Chinese Journal of Analytical Chemistry, 2015, 43(10): 1 465-1 471(in Chinese).

