H3K27me3聚集MEG3 lncRNA启动子通过MDM2/p53途径诱导多发性骨髓瘤RPMI8226细胞凋亡逃逸
董娟娟,彭万仁,颜兵雪,钱婷婷,蔡谜谜,王 华, 孙国平
多发性骨髓瘤(multiple myeloma, MM)是造血干细胞的恶性克隆性疾病,具有极强的异质性,涉及诸多发病环节。MM发生涉及细胞增殖、凋亡、分化、周期转换等异常过程中,组蛋白甲基化/去甲基化修饰平衡功能紊乱发挥举足轻重的作用[1-5]。组蛋白甲基化修饰状态与细胞凋亡的发生关系密切。研究[6]显示,长链非编码RNA(long noncoding RNA, lncRNA)作为新型表观遗传学调控方式,可与组蛋白甲基化相互调节。通过此方式两者共同参与染色质重构、转录激活、转录干扰等多种重要的调控过程。母系表达基因3 (materially expressed gene 3,MEG3) lncRNA是一个被证实具有肿瘤抑制功能的长链非编码RNA,在57%的MM患者中表达缺失[7],但其作用机制尚不清楚。现将重点探讨MM中MEG3 lncRNA基因启动子区域组蛋白H3赖氨酸残端27位的三甲基化(H3K27me3)表达情况,明确基因启动子区域H3K27me3修饰紊乱是否导致MM中MEG3 lncRNA转录缺失,从而为MM的临床治疗寻找新的方向。
1 材料与方法
1.1药品与试剂MTT、碘化丙啶(PI)、DMSO、RNaseA、Hoechst 33258荧光染液均购自美国Sigma公司产品; RNA抽提试剂TRIzol、RPMI 1640培养基均购自美国Gibco公司; 胎牛血清(FBS)购自杭州四季青生物工程材料有限公司; Annexin-V FITC/PI 试剂盒购自南京凯基生物科技发展有限公司; 引物由上海生物工程技术服务有限公司合成。逆转录-聚合酶链反应(RT-PCR)试剂盒购自日本Toyobo 公司; 抗体Zeste基因增强子同源物2(enhancer of Zeste homolog 2,EZH2)、H3K27me3、鼠双微体基因2(murine double minute 2,MDM2)、p53和ubiquitin-p53购自美国Cell Signaling公司; 氯仿、乙醇、异戊醇为国产分析醇,购自杭州长征化学试剂有限公司。
1.2仪器BD流式细胞仪、Bio-Rad M450 酶联免疫检测仪购自美国CA公司; ChemiDocXRS 蛋白条带密度分析软件购自美国Bio-Rad 公司;Real-time PCR仪器购自罗氏公司。
1.3细胞培养RPMI8226细胞购自武汉大学保藏中心,用含100 U/ml链霉素、100 U/ml青霉素、10%灭活FCS的RPMI1640培养基, 在5% CO2、37℃、饱和湿度条件下培养, 根据细胞数量,每2~3 d 换液传代1次, 倍增时间24~48 h, 取细活性>95%的对数生长期细胞用于后续各项实验。
1.4MTT比色法检测细胞增殖收集处于对数生长期的RPMI8226细胞,调整细胞浓度至2×105/ml,在96孔板中每孔加入体积200 μl该细胞悬液,边缘孔用无菌PBS填充。细胞分为MDM2拮抗剂干预组、p53拮抗剂干预组和DMSO干预组, 按要求时间在5% CO2、37 ℃、饱和湿度条件下孵育,每孔加入 5 mg/ml 的 MTT 20 μl, 继续37 ℃孵育4~6 h。离心弃上清液,小心用PBS冲2~3次后,每孔加入 150 μl DMSO, 置摇床上低速振荡10 min,在蓝色结晶充分溶解后, 在Bio-Rad M450酶联免疫检测仪以OD492 nm波长测量各孔的吸光度(A)值, 重复实验 3次, 按公式:抑制率=1-实验组A值/对照组A值,计算细胞增殖抑制率。
1.5Annexin-VFITC/PI双标法流式细胞术检测细胞凋亡按实验设计收集经siRNA-EZH2处理后RPMI8226细胞,同时设计阴性对照组(DMSO处理), 经4 ℃预冷的PBS离心洗2次, 按1×106/ml密度于100 μl 的 buffer结合缓冲液中重悬细胞, 分别加入 Annexin-V FITC 5 μl和PI 10 μl , 震荡混匀, 室温避光条件下反应15 min, 再加入buffer结合缓冲液至300 μl, 样品制备完毕后上流式细胞仪检测。
1.6RT-PCR法检测EZH2、MEG3lncRNA及MDM2和p53表达按试剂盒说明书合成cDNA。按以下条件进行逆转录反应:30 ℃、10 min, 42 ℃、20 min, 99 ℃、5 min, 4 ℃、5 min, -20 ℃保存。EZH2引物序列:上游引物5′-GGACCACAGTGTTACCAAGCAT-3′,下游引物5′-GTGGGGTCTTTATCCGCTCAG-3′, 扩增产物为79 bp;MDM2 引物序列:上游引物5′-CAGTAGCAGTGAATCTACAGGGA-3′, 下游引物5′-CTGATCCAACCAATCACCTGAAT-3′, 扩增产物为79 bp;MEG3lncRNA引物序列:上游引物5′-ATCATCCGTCCACCTCCTTGTCTTC-3′,下游引物5′-GTATGAGCATAGCAAAGGTCAGGGC-3′, 扩增产物为284 bp; β-actin 引物序列:上游引物5′-TGAGACCTTCAACACCCCAG-3′,下游引物5′-GCCATCTCTTGCTCGAAGTC-3′, 扩增产物为206 bp;以cDNA为模板, 进行MEG3 lncRNA、MDM2的PCR扩增。取扩增产物5 μl, 经琼脂糖凝胶电泳、紫外线照相、Bandscan软件进行扫描分析, 得出目的基因的灰度值进行半定量分析。
1.7Westernblot检测EZH2、H3K27me3、MDM2及p53蛋白表达将各处理组细胞收集至50 μl加入苯甲基磺酰氟和蛋白酶抑制剂的冷细胞裂解液中,以提取细胞总蛋白。按照Bio-Rad 试剂盒使用说明书标定Marker蛋白及各泳道,电泳。在300 mA电流15 min的条件下转膜,取出硝酸纤维素膜置于5%脱脂牛奶中4 ℃过夜封闭。加入稀释的抗靶蛋白抗体与膜共同孵育(37 ℃)1 h。取出纤维素膜洗涤后,再与辣根过氧化物酶标记的二抗共孵育(37 ℃)1 h。洗涤后,曝光,X光片扫描定影,输入计算机。
1.8ChIP-RealtimePCR技术收集各处理组细胞;细胞固定,直接将甲醛加入细胞培养液,摇晃固定10 min后,迅速加入2.5 mol/L甘氨酸解交联5 min,PBS洗涤,刮下细胞。超声打碎:使用超声水浴锅,EP管在冰水混合物中超声,将长链的DNA打碎成200~1 000 bp的DNA片段。4 ℃、5 000 r/min离心5 min后去上清液。免疫沉淀:加入ChIP级H3K27me3抗体和对照IgG,和结合抗体的磁珠(或protein A/G)。经稀释后,超声产物分成两份,分别加入ChIP级H3K27me3抗体和对照IgG,轮转过夜,第2天加入磁珠轮转4 h。洗涤:顺序分别用稀释缓冲液、低盐溶液、高盐溶液、氯化锂溶液以及TE缓冲液洗涤,共两个循环。用洗脱缓冲液在65 ℃洗脱,过夜。DNA纯化:将洗脱的产物用DNA纯化试剂盒纯化,得到50 μl纯化产物DNA。
根据MEG3 lncRNA基因区域上游2 000~3 000 bp范围分段设计引物,每300 bp设计一套,共合成8~10套引物。将ChIP以后的Input、IgG、IP三个样本分别用10个引物进行半定量PCR的筛选,如果IP组的样本某套引物能P出条带,说明H3K27me3和MEG3 lncRNA启动子区域的这段序列存在结合。再运用QPCR定量富集倍数:将半定量电泳PCR筛选出来的有结合的引物,再用Input和IP样本进行QPCR验证,计算得出ChIP富集的倍数。
1.9siRNA干扰技术转染前1 d,常规消化细胞,制成细胞悬液、计数,在6孔板内铺上1.2×105个细胞,加入1 500 μl 无抗生素培养基培养 24 h,到转染时使细胞达到 30%~50%的汇合率。三组分别将EZH2-siRNA(EZH2为H3K27me3特异性的组蛋白甲基转移酶)、siRNA 阴性对照、NC siRNA各5 μl溶于250 μl无血清的 Opti-MEM溶液中,轻柔混合均匀。将5 μl Lipofectamine RNA IMAX溶于250 μl无血清的Opti-MEM中,混合均匀,在室温下孵育5 min后,将上述两种混合物轻轻混合均匀,并在室温下孵育20 min。注意混合试剂时,请勿剧烈吹打或振荡,手指轻弹管壁即可,用力过度可能会破坏siRNA的结构。在6孔板中弃去旧培养基,每孔加入1 500 μl 的无血清培养基,并将上述两种混合物加入6孔板,上下左右轻轻晃动板子使得复合物混合均匀。细胞在37 ℃、5% CO2培养箱中培养,在加完复合物4~6 h后,可更换完全培养基。48 h后,收集细胞,提取蛋白,测量靶蛋白EZH2及H3K27me3的表达水平或进行其他实验。
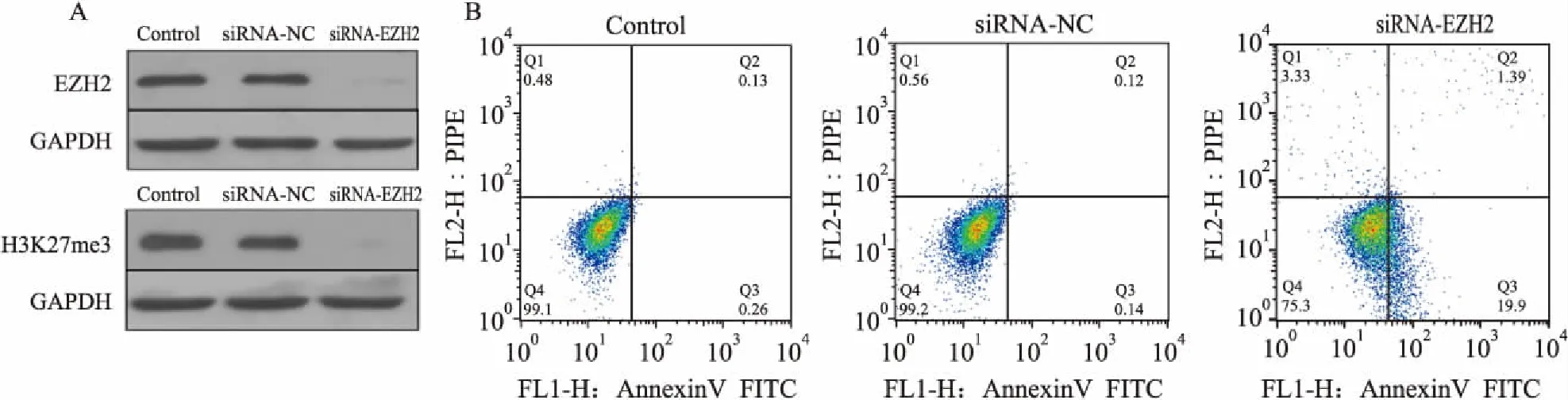
图1 RPMI8226细胞中下调H3K27me3的表达可以诱导RPMI8226细胞凋亡

2 结果
2.1H3K27me3导致MM细胞凋亡逃逸EZH2是特异性的H3K27me3组蛋白甲基化转移酶,合成特异性的EZH2-siRNA, 运用电转染技术使EZH2-siRNA进入RPMI8226细胞内(同时设有阴性对照)特异性抑制EZH2的表达,运用Western blot技术检测干扰后EZH2、H3K27me3的表达,结果显示,通过干扰EZH2的表达可以明显抑制H3K27me3的表达,见图1A。 Annexin-V FITC/PI双标法检测H3K27me3对RPMI8226细胞凋亡的影响:早期凋亡细胞显示为Annexin-V FITC标记为阳性,同时PI标记为阴性的细胞;然而,晚期凋亡细胞则为Annexin-V FITC与PI标记均为阳性的细胞群。与正常RPMI8226细胞组对比,EZH2-siRNA干预组H3K27me3蛋白表达明显降低,见图1A,凋亡的RPMI8226细胞数目明显增多。正常RPMI8226细胞组的早期凋亡率、晚期凋亡率分别为(0.13±0.02)%和(0.26±0.02)%;EZH2-siRNA干预组的早期凋亡率、晚期凋亡率分别为(1.39±0.27)%和(19.9±0.71)%;正常组和干预组间细胞凋亡率有明显差异(t=4.870,P<0.05),见图1B。
2.2ChIPReal-timePCR证实H3K27me3直接结合于MEG3lncRNA基因启动子区本研究以RPMI8226细胞为样本进行ChIP实验。结果显示,在上千个基因启动子区域有高密度聚集的H3K27me3,其中包含很多癌相关基因。同时发现MEG3lncRNA启动子区存在H3K27me3聚集。进一步运用ChIP Real-time PCR证实MEG3lncRNA启动子区存在H3K27me3聚集,使用Graphpad Prism 5.0 软件进行统计分析,H3K27me3组较Control IgG组明显差异,提示H3K27me3可直接结合于MEG3lncRNA基因启动子区,见图2。
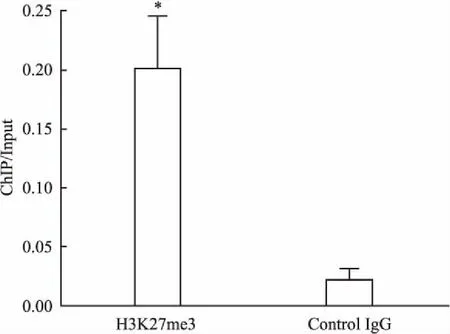
图2 H3K27me3可直接结合于MEG3lncRNA基因启动子区
2.3通过调控H3K27me3表达可上调RPMI8226细胞MEG3lncRNA表达水平RPMI8226细胞经EZH2-siRNA干预组作用后,细胞内MEG3lncRNA表达水平呈明显升高,Control组 与siRNA-NC组干预后相比,两组间MEG3lncRNA表达水平无明显变化。但EZH2-siRNA干预后MEG3lncRNA表达水平是前者2倍,与Control组比较差异有统计学意义(P<0.05),见图3。
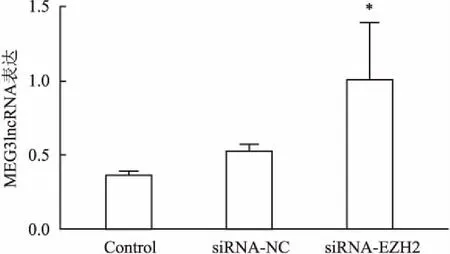
图3 抑制H3K27me3可上调RPMI8226细胞MEG3lncRNA表达水平
2.4通过调控RPMI8226细胞MEG3lncRNA表达可影响MDM2蛋白、mRNA水平RPMI8226细胞经MEG3lncRNA-siRNA干预组作用后,细胞内MDM2 mRNA表达水平呈明显升高,Control组 与siRNA-NC组干预后相比,两组间MDM2 mRNA表达水平无明显变化。但MEG3lncRNA-siRNA干预后MDM2 mRNA表达水平是前两者2倍,差异有统计学意义(P<0.05)。MEG3lncRNA-siRNA明显上调mRNA表达水平的同时,同时有效诱导了MDM2蛋白表达。MEG3lncRNA-siRNA干预组作用后,细胞内MDM2蛋白水平呈明显升高趋势,差异有统计学意义(t=3.269,P<0.05)。siRNA-NC组干预后MDM2蛋白水平无明显变化,见图4。
2.5RPMI8226细胞中可通过拮抗MDM2相关的p53泛素化导致p53降解以MDM2拮抗剂(Nutlin-3)干预RPMI8226细胞后,应用Western blot检测MDM2拮抗剂(Nutlin-3)对RPMI8226细胞的Ub-p53及p53蛋白水平调节变化;结果显示,Nutlin-3可在蛋白水平上抑制p53的泛素化,故Ub-p53表达水平降低,使得p53降解被抑制,p53蛋白表达水平明显升高,见图5。Nutlin-3处理组与RPMI8226细胞未处理组(Control组)相比,差异有统计学意义(t=93.59,P<0.05)。
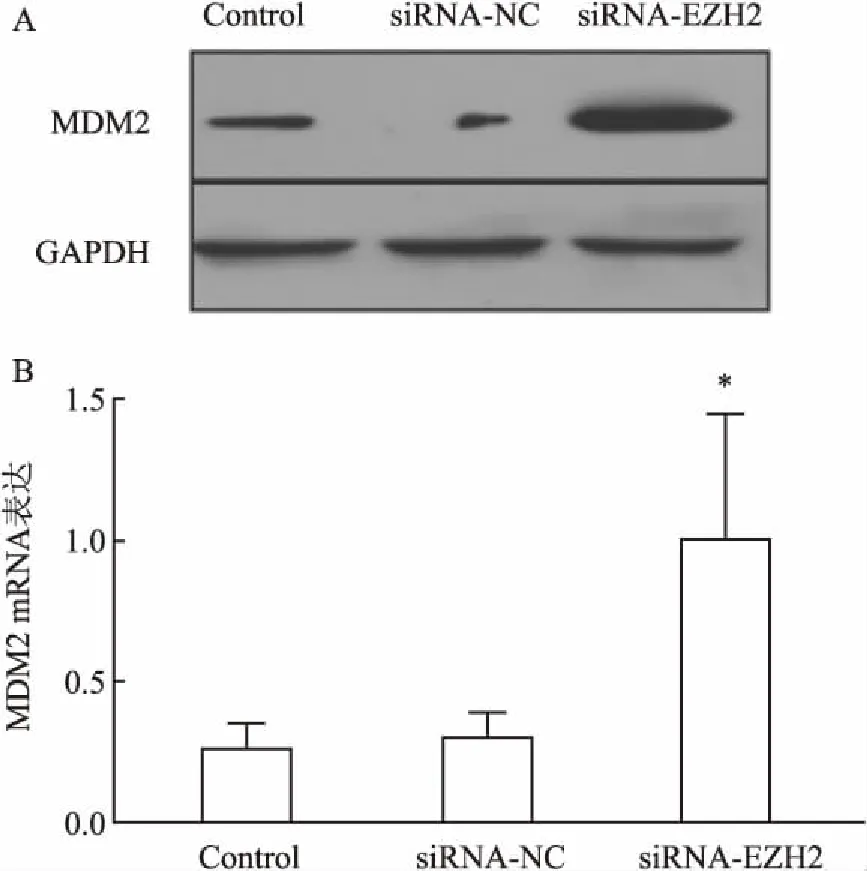
图4 RPMI8226细胞经MEG3lncRNA-siRNA干预后MDM2 mRNA和蛋白表达水平均明显升高
A:各组Western blot中MDM2蛋白水平;B:各组PCR中MDM2基因水平;与Control组比较:*P<0.05
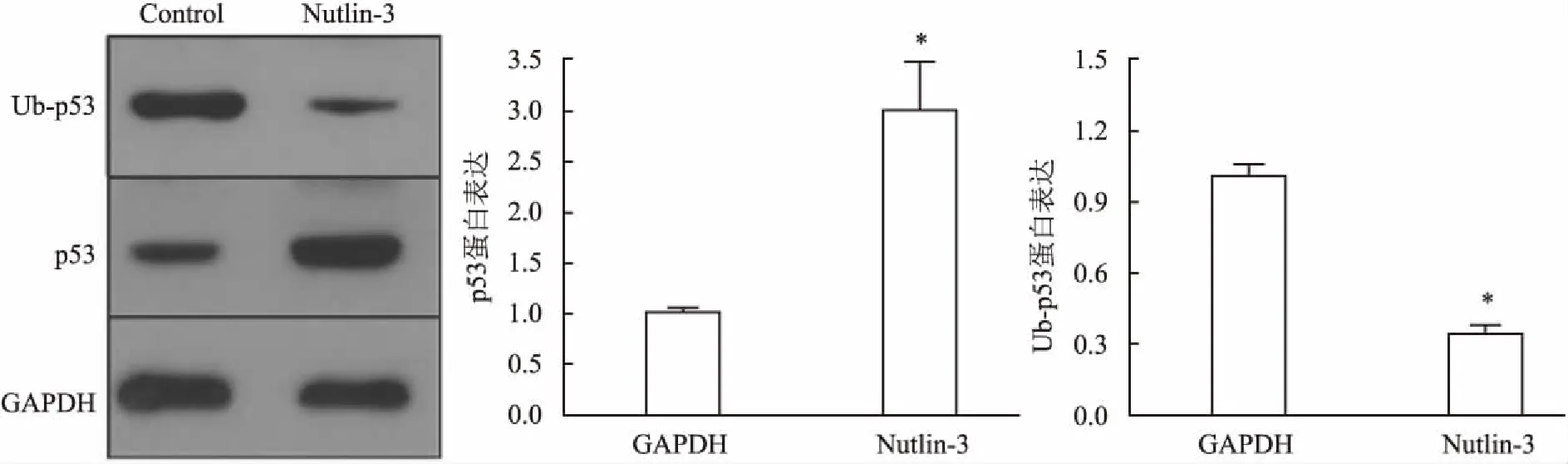
图5 MDM2拮抗剂(Nutlin-3)干预后RPMI8226细胞的p53与Up-p53表达
3 讨论
表观遗传学在肿瘤发生、发展中作用堪比传统遗传学,表观遗传修饰的异常是所有人类肿瘤的共同特点。组蛋白甲基化酶和组蛋白去甲基化酶是表观遗传学的重要内容,机体通过两者共同作用动态调节组蛋白甲基化模式,组蛋白甲基化模式是发挥表观遗传作用的重要方式之一,严格调控细胞的分化、增殖,维持机体细胞生命状态的稳定, 在细胞凋亡、周期等生命过程中发挥重要作用[8], 其失平衡则导致肿瘤的发生。H3K27me3 生物体细胞中广泛富集于基因启动子区域, 介导染色质重构,染色质闭锁,基因转录停止。也有报道称除基因启动子区域外, H3K27me3尚可存在于结构基因多个位点,维持染色质的浓缩状态。
组蛋白甲基化酶复合物PRC2 的亚基 EZH2 在骨髓瘤中高表达, 其调控的H3K27me3水平在肿瘤的发生发展中起重要作用,靶向抑制EZH2可增加瘤细胞的凋亡率。图1A实验证实,通过siRNA技术抑制MM RPMI8226细胞中EZH2表达后, H3K27me3表达量显著下降,同时RPMI8226细胞凋亡率明显增加。徐莉 等[9]也证实RPMI8226及H929细胞系中的H3K27me3高表达会导致本细胞凋亡相关分子caspase3、PARP均呈低表达, 瘤细胞死亡率降低, 且同时对35例骨髓瘤患者标本进行Western blot分析, 证实EZH2、H3K27ME3的表达水平和骨髓瘤患者的疾病的恶性程度呈正相关。因此,推论H3K27me3的高表达保护了RPMI8226细胞的凋亡逃逸。
MEG3lncRNA作为第一个被发现有肿瘤抑制功能的lncRNA,证实在57% MM患者中表达缺失[7],但其作用机制尚不清楚。LncRNA是新近发现的具有强大调控功能的基因组“暗物质”, 是一类转录长度超过200 nt的RNA分子, 起初因无蛋白质编码功能,被认为是基因组转录的“噪音”[10]。由于近年研究的不断深入,lncRNA功能学发现突飞猛进, 已证实lncRNA参与了染色质修饰、X染色体沉默、转录干扰、转录激活等多种重要的基因表达调控过程, 是重要的表观遗传学调控方式[11]。研究显示lncRNA可与其他表观遗传形式相互作用,组蛋白甲基化可直接作用于lncRNA基因启动子区来调控lncRNA的表达,反之,上游非编码区转录出的lncRNA也可通过影响组蛋白甲基化/乙酰化等修饰状态影响下游基因的表达。其表达缺失已被证实存在于多种肿瘤细胞系及实体肿瘤中。Benetatos et al[12]报道, 57%的MM病例MEG3 lncRNA基因启动子存在异常的甲基化谱,且伴随MEG3 lncRNA表达缺失,并且缺失程度与MM的亚型和疾病的阶段具有显著相关性。然而, MEG3 lncRNA表达缺失的原因及其在MM的发生、发展中作用机制目前仍未有研究。本实验证实MM中H3K27me3可结合于MEG3 lncRNA基因启动子区域,且通过siRNA技术抑制H3K27me3甲基化酶EZH2降低H3K27me3表达的同时,MEG3 lncRNA表达可明显升高。因此推论,MM RPMI8226细胞中MEG3 lncRNA基因启动子区H3K27me3的异常高表达,是MEG3 lncRNA表达缺失的重要原因。H3K27me3如何保护RPMI8226细胞的凋亡逃逸,是否与调控MEG3 lncRNA表达相关仍有待探索。
在神经胶质瘤中证实,人为使MEG3 lncRNA过表达可抑制肿瘤细胞的DNA合成及细胞集落的形成,抑制MDM2表达,诱导p53聚集,刺激p53介导的转录活化, 选择性的调节p53下游靶基因 GDR-15(growth differentiation factor 15, GDF-15, 此基因具有抗增殖及肿瘤抑制功能)等的表达, 从而抑制细胞增殖,诱导凋亡[13-17]。多发性骨髓瘤中,MEG3 lncRNA异常低表达是否同样引起MDM2的异常活化及p53降解导致功能缺失,最终诱导MM逃避凋亡。本实验中证实,RPMI8226细胞中H3K27me3表达被抑制时,MEG3 lncRNA表达升高,同时MDM2在mRNA及蛋白水平上均明显降低。同样运用siRNA技术证实,MEG3 lncRNA表达被抑制时,MDM2在mRNA及蛋白水平上均有所升高。本实验还证实运用MDM2拮抗剂Nutlin-3可显著降低蛋白水平泛素化p53的表达,非泛素化p53的蛋白表达有升高趋势。由此推论,MM中MEG3 lncRNA表达缺失解除了对MDM2表达的抑制,MDM2再通过与p53直接结合介导p53泛素化,间接促使p53的降解, 或直接抑制 p53 基因活化,导致 MM 细胞凋亡逃逸。
[1] Liu Y, Zeng L L, Chen Y,et al.Triptolide inhibits cell growth and induces G0-G1 arrest by regulating P21wap1/cip1 and P27kip1 in human multiple myeloma RPMI-8226 cells[J]. Chin J Cancer Res,2010,22(2):141-7.
[2] Zeng R,Zeng L,Chen Y,et al.Triptolide-induced apoptosis by inactivating nuclear Factor-kappa B apoptotic pathway in multiple myelomainvitro[J].J Huazhong Univ Sci Technolog Med Sci, 2011,31(4):446-51.
[3] Zhao F, Chen Y, Zeng L L,et al.Effects of triptolide on RIZ1 expression, proliferation, and apoptosis in multiple myeloma U266cells[J].Acta Pharmacol Sin,2010,31(6):733-40.
[4] Zhao F, Chen Y, Zeng L,et al.Role of triptolide in cell proliferation, cell cycle arrest, apoptosis and histone methylation in multiple myeloma U266 cells[J].Eur J Pharmacol,2010,646(1-3):1-11.
[5] Zhao F, Chen Y, Li R,et al.Triptolide alters histone H3K9 and H3K27 methylation state and induces G0/G1 arrest and caspase-dependent apoptosis in multiple myelomainvitro[J]. Toxicology,2010,267(1-3):70-9.
[6] Peffers M J, Balaskas P, Smagul A.Osteoarthritis year in review 2017:genetics and epigenetics[J].Osteoarthritis Cartilage,2017,26(3):304-11.
[7] Benetatos L, Dasoula A, Hatzimichael E,et al.Promoter hypermethylation of the MEG3 (DLK1/MEG3) imprinted gene in multiple myeloma[J].Clin Lymphoma Myeloma,2008,8(3): 171-5.
[8] Chen H,Landen C N, Li Y,et al.Epigallocatechin gallate and sulforaphane combination treatment induce apoptosis in paclitaxel-resistant ovarian cancer cells through hTERT and Bcl-2 down-regulation.[J].Exp Cell Res,2013,319(5):697-706.
[9] 徐 莉,陈协群.多发性骨髓瘤中组蛋白甲基化的分析研究[G].武汉:全国淋巴肿瘤诊治进展研讨会,2014.
[10] Bedoyareina O C, Ponting C P. Functional RNA classes: a matter of time[J].Nat Struct Mol Biol,2017,24(1):7-8.
[11] Bassett A R, Azzam G, Wheatley L,et al.Understanding functional miRNA-target interactionsinvivoby site-specific genome engineering[J].Nat Commun,2014,5:4640.
[12] Benetatos L,Dasoula A,Hatzimichael E,et al.Promoter hypermethylation of the MEG3 (DLK1/MEG3) imprinted gene in multiple myeloma[J].Clin Lymphoma Myeloma,2008,8(3):171-5.
[13] Wang P,Ren Z,Sun P.Overexpression of the long non-coding RNA MEG3 impairsinvitroglioma cell proliferation[J].J Cell Biochem,2012,113(6):1868-74.
[14] Zhou Y,Zhong Y,Wang Y,et al.Activation of p53 by MEG3 Non-coding RNA[J].J Biol Chem,2007,282(34):24731-42.
[15] Yan H,Yuan J,Gao L,et al.Long noncoding RNA MEG3 activation of p53 mediates ischemic neuronal death in stroke[J].Neuroscience,2016,337:191-9.
[16] Zhu J,Liu S,Ye F,et al.Long Noncoding RNA MEG3 interacts with p53 protein and regulates partial p53 target genes in hepatoma cells[J].Plos One,2015,10(10):e139790.
[17] Zhan R,Xu K,Pan J,et al.Long noncoding RNA MEG3 mediated angiogenesis after cerebral infarction through regulating p53/NOX4 axis[J].Biochem Biophys Res Commun,2017,490(3):700-6.

