新型靶向药物对A549细胞体外抑制作用及其能谱CT成像初步研究
詹 爽,赵小英,汪琛玮,吴兴旺
随着分子生物学技术和临床治疗水平的快速发展,非小细胞肺癌的临床治疗手段特别是新型的分子靶向药物治疗有了明显的进步。吉非替尼是目前临床广泛应用的一种分子靶向药物,与传统抗肿瘤药物相比有选择性好、不良反应小、疗效高等特点[1]。但临床在治疗前需穿刺活检行基因检测,以判断是否适合使用该药。但由于操作等技术限制,使得穿刺活检有一定的假阴性结果。治疗前无创的评估药物的疗效,一直是临床追求的目标。该研究合成了一种以吉非替尼主要功能基团为母核的新型含碘靶向抗肿瘤药物,并进行细胞实验及能谱CT扫描观察其抗肿瘤活性及CT能谱显像能力。
1 材料与方法
1.1主要试剂与仪器化合物7-甲氧基-(3-吗啉-4-丙氧基)喹唑啉-4(3H)-酮、化合物3-氯-4-碘苯胺(上海萨恩化学技术有限公司);人非小细胞肺癌细胞A549(安徽医科大学药学院);吉非替尼(gefitinib,英国Astra Zeneca 公司);胰蛋白酶、DMEM高糖培养液和胎牛血清(美国 Gibco公司);二甲基亚砜(DMSO)和β-actin抗体(美国Sigma公司); GE Discovery CT750 HD扫描仪及AW4.5后处理工作站(美国GE公司)。
1.2实验方法
1.2.1靶向药物制备 化合物N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺)与化合物7-甲氧基-(3-吗啉-4-丙氧基)喹唑啉-4(3H)-酮与化合物3-氯-4-碘苯胺进行化学反应,获得与吉非替尼相似靶向药物(N-(3-氯-4-氟碘苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺)(图1),用于细胞实验及能谱CT扫描。
图1 靶向药物制备化学方程式

项目药物浓度(mmol/L)01.8753.757.51530靶向药物CT值(HU)-32±1.5-19±0.6-15±1.0-11±1.03±0.766±3.1吉非替尼CT(HU)-32±2.5-35±1.6-36±1.3-35±0.6-32±3.6-28±1.5靶向药物碘浓度值(mg/ml)0.07±0.11.03±0.11.37±0.21.97±0.36.67±0.341.1±0.8吉非替尼碘浓度值(mg/ml)0.03±0.10.26±0.10.77±0.10.67±0.10.96±0.11.07±0.1
1.2.2MTT法测靶向药物和吉非替尼对细胞增殖的影响 A549细胞单层接种在含体积分数为10%的胎牛血清和DMEM培养液中,在37 ℃、5% CO2培养箱中培养,每2 d传代一次。
取对数生长期的A549细胞,以5×103个每孔接种于96孔板中,培养24 h,待细胞完全贴壁后,分别加入不同浓度的靶向药物(2.5、5、10、20、40 μmol/L),阴性对照组加入体积分数为0.1%的DMSO。48 h后,每孔加入5 g/L MTT溶液10 μl,继续培养4 h后弃上清液,每孔加入150 μl DMSO,37 ℃震荡15 min后用酶标仪在570 nm波长处检测其吸光度(OD)值。按公式计算细胞增殖抑制率:抑制率(inhibition rate,IR)(%)=(1-实验组吸光值/对照组吸光值)×100%,实验重复3次。测量吉非替尼对A549细胞增殖抑制率同靶向药物实验方法及条件。

1.3统计学处理应用SPSS 15.0软件进行分析,两两比较采用配对t检验,分别统计两种药物对A549细胞增殖抑制及靶向药物与吉非替尼CT值及碘浓度值,靶向药物碘浓度值与真实值之间的相关性采用线性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1靶向药物和吉非替尼对A549细胞增殖的影响MTT法结果显示,靶向药物及吉非替尼均能明显抑制A549细胞的增殖,且呈时间剂量依赖性,以40 μmol/L靶向药物浓度对A549细胞作用48 h的抑制率最高,浓度超过10 μmol/L时,靶向药物抑制率高于吉非替尼,二者之间差异具有统计学意义(P<0.05)(图2)。
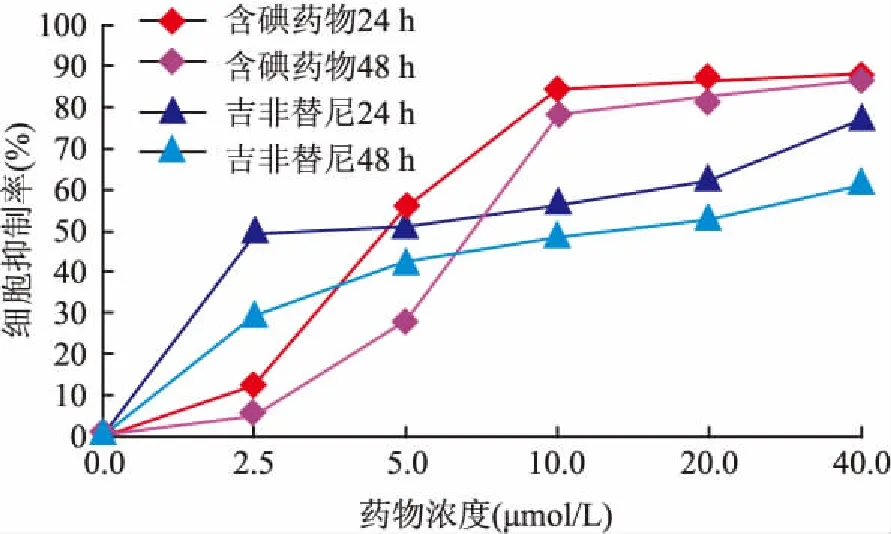
图2 靶向药物与吉非替尼对A549的增殖抑制
2.2靶向药物与吉非替尼CT值、碘浓度值测量及靶向药物碘浓度与真实值相关性能谱CT AW4.5后处理工作站测量结果如图所示,随药物浓度增加,靶向药物溶液CT值及碘浓度值明显高于吉非替尼溶液(表1),差异具有统计学意义(P<0.05)。二者碘基物质图像(图3)可以看出,靶向药物具有更高密度显示,随浓度下降,二者对比减弱。

图3 靶向药物(上排)与吉非替尼(下排)溶液碘基物质图
靶向药物分子量为574.8,碘的原子量为127,据此换算出1 mmol/L药物含碘浓度为1.733 mg/ml。不同浓度靶向药物所测得碘浓度值与真实值的测定结果见表2。碘浓度的测量值与真实值之间成线性正相关性(r=0.998),且碘二者数值之间比较差异无统计学意义(t=6.18,P>0.05)。

表2 碘基物质图测量靶向药物碘测量值与真实值(mg/ml)
3 讨论
肺癌作为发病率和死亡率增长最快的恶性肿瘤之一,目前病死率在我国城市已居肿瘤死亡首位,非小细胞肺占肺癌总发生率的85%左右,其预后差、致死率高,且大多数患者就诊时已属晚期,失去手术切除机会,因此,化疗方式必不可少[2]。目前,临床上靶向治疗相关的基因成为研究重点,特异性较高的分子靶点有效延长肺癌患者生存时间,提高患者生活质量,降低对正常组织细胞的毒副作用。研究[3-4]显示,吉非替尼是一种选择性表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor- tyrosine kinase inhibitors, EGFR-TKIs),属于苯胺喹唑啉类,可与ATP竞争性地和EGFR的酪氨酸激酶胞内区位点结合,从而明显抑制EGFR跨膜细胞表面受体上酪氨酸激酶的自身磷酸化,阻止细胞增殖,促进凋亡 ,目前广泛应用于临床治疗非小细胞肺癌的患者。本研究制备了新型靶向药物(N-(3-氯-4-氟碘苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺),该化合物不仅具有与吉非替尼相似的化学结构,同时化合物内含有碘元素,使其既具有靶向功能,又具有CT对比剂的作用,从而达到靶向诊断及治疗的目的。
3.1靶向药物对A549的增殖抑制作用为了明确靶向药物的抗肿瘤活性,本研究以吉非替尼为对照组,使用相同浓度对A549行细胞培养,并进行细胞实验研究。MTT实验结果表明,随着靶向药物浓度增加,IR呈增高趋势,提示靶向药物可明显抑制A549细胞生长,当作用时间达到48 h时,靶向药物具有最高的抑制率。当药物浓度超过10 μmol/L时,靶向药物抑制率超过吉非替尼,且二者之间差异具有统计学意义,这一结果提示本研究药物抗肿瘤药物效果可能高于吉非替尼,有待今后进一步深入实验研究确认。
3.2能谱CT测量CT值及碘浓度值常规CT靠单一参数CT值成像,即密度成像。CT值代表X线穿过组织被吸收后的衰减值,CT值高低反映物质的密度大小,根据物质密度不同即CT值大小判断组织性质。随着影像技术的发展和设备的不断更新,宝石CT能谱成像改变了这一传统诊断模式,不再单纯利用CT值进行诊断。能谱CT是通过高低两种能量快速切换,即80 kVp和140 kVp两组电压瞬时切换,得到两组含有原始能量信息(即40~80 keV和40~140 keV)的原始数据。由于数据是在0.5 ms内获得,具有高度一致性,因此能够在原始数据上进行重建。通过后处理技术,可以获得更多的图像信息及物质信息,包括去除硬化伪影、优化图像质量和对比噪声比、物质定量分析等[5-7]。本研究主要研究能谱CT的物质定量分析功能,方法是通过后处理物质分离技术获得基物质图像,对基物质进行测量得到物质定量,可为临床诊断提供准确客观的依据[8]。一般基物质对常由X线衰减值不同的2种物质组成,医学常用的基物质对是碘和水。Wang et al[9]研究发现,GSI扫描含不同浓度碘溶液,后处理使用物质分离技术测量试管内碘浓度,发现能谱CT可对碘浓度进行定量测定。因此本研究也以碘水作为基物质对,对靶向药物溶液的碘含量进行定量分析。
CT值测量结果表明,随着药物浓度增加,CT值升高,这是因为药物中含有可吸收较多X线的碘离子,因此当药物浓度增加时,相应碘浓度上升,CT值即增加,具有较好的CT显影能力,增加图像对比。吉非替尼溶液里不含有吸收较多X线的物质,因此药物浓度的改变不影响药物的CT值。
碘基物质图像测量结果表明,随药物浓度增加,所测得的碘浓度值同样明显升高,靶向药物碘浓度测量值与真实值之间也存在明显的线性正相关(r值为0.998),说明测量碘浓度值可准确反映真实溶液的变化趋势;而碘浓度的测量值与真实值相比,配对t检验结果发现,二者之间无统计学差异,说明能谱CT可准确测定物质碘含量,这与王乐 等[10]、林婷婷 等[11]人的研究结果一致。
本研究对于靶向药物对A549细胞增殖抑制进行了体外实验研究,并对药物行CT GSI能谱扫描,结果表明靶向药物具有较好的抗肿瘤活性,且药物内含有可提高药物CT值的碘离子,利于增加图像对比,而后处理基物质图像准确测量碘浓度,从而明确了其判断药物浓度的能力,为日后进行活体动物实验提供了理论支持。
本研究不足之处在于,未对靶向药物行细胞周期及凋亡、蛋白定量测定等实验,未深入探讨其抗肿瘤细胞机制,仍有待进一步的实验研究。
[1] Minguet J, Smith K H, Bramlage P. Targeted therapies for treatment of non-small cell lung cancer-recent advances and future perspectives[J]. Int J Cancer,2016,138(11):2549-61.
[2] Blais N, Kassouf E. Maintenance therapies for non-small cell lung cancer[J].Front Oncol,2014,4:213.
[3] Nurwidya F, Takahashi F, Takahashi K. Gefitinib in the treatment of nonsmallcell lung cancer with activating epidermal growth factor receptor mutation[J]. J Nat Sci Biol Med,2016,7(2):119-23.
[4] Zhao Z Q, Yu Z Y, Li J, Ouyang XN. Gefitinib induces lung cancer cell autophagy and apoptosisviablockade of the PI3K/AKT/mTOR pathway[J]. Oncol Lett,2016,12(1):63-8.
[5] 王万勤,刘 斌,周 勇,等.能谱CT最佳单能量成像去除对比剂硬化伪影[J].安徽医科大学学报,2013,48(2):185-8.
[6] Ma G, He T, Yu Y, et al. Improving image quality of bronchial arteries with virtual monochromatic spectral CT images[J]. PLoS One,2016,11(3):e0150985.
[7] Zhang Y, Cheng J, Hua X, et al. Can spectral CT imaging improve the differentiation between malignant and benign solitary pulmonary nodules? [J].PLoS One,2016,11(2):e0147537.
[8] Shao W, Liu J, Liu D. Evaluation of energy spectrum CT for the measurement of thyroid iodine content[J]. BMC Med Imaging,2016,16(1):47.
[9] Wang L, Liu B, Wu X W, et al. Correlation between CT attenuation value and iodine concentrationinvitro: discrepancy between gemstone spectral imaging on single-source dual-energy CT and traditional polychromatic X-ray imaging[J]. Med Imaging Radiat Oncol,2012,56(4):379-83.
[10] 王 乐,刘 斌,余永强,等.能谱成像测量单能量下CT值与碘含量的相关性分析[J].实用放射学杂志,2012,28(5):784-7.
[11] 林婷婷,邓克学,韦 炜,等.能谱CT定量碘基物质图在肺栓塞诊断中的应用[J].安徽医科大学学报,2013,48(9):1095-8.

