普伐他汀钠对LPS诱导的中性粒细胞NE释放及活性的影响
陈雨虹,戴 敏,梅晓冬
中性粒细胞弹性蛋白酶(neutrophil elastase,NE)是一种存在于中性粒细胞嗜天青颗粒中的丝氨酸蛋白酶,基因结构为ELA2,是在19号染色体短臂末端区域内含50个碱基的片段,含有218种氨基酸和4个二硫键,是丝氨酸蛋白酶家族的一份子。当中性粒细胞暴露于各种细胞因子和趋化因子刺激下时可释放NE,如肿瘤坏死因子(TNF-α)、白细胞介素IL-8、C5a、细菌脂多糖(lipopolysaccharide,LPS)和来自细菌壁FMLP的三肽[1]。
他汀类药物是羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是有效的降脂药物,目前广泛应用于心血管疾病的治疗。但近年来许多研究[2]显示,他汀类药物还具有显著的免疫调节和抗炎效用。他汀类药物的多效性引起广泛的关注。他汀药物抗炎效用的机制具体包括有抗金属蛋白酶作用、抗氧化作用、抗炎症作用、抑制黏附分子表达、降低C反应蛋白水平等。其中蛋白水解酶的过度活化,是组织器官损伤的一条重要因素,包括组织蛋白酶,NE和金属基质蛋白酶(matrix metalloproteinases,MMP), Kamio et al[3]研究发现他汀类药物可以通过HMG-CoA还原酶途径抑制成纤维细胞释放MMP,参与细胞炎症过程。但目前尚无他汀类药物是否能抑制人NE活化和过量释放的相关作用研究。该研究在体外以LPS刺激中性粒细胞释放NE,加入普伐他汀钠进行干预,了解普伐他汀钠是否可以抑制NE的释放,为他汀类药物多方面应用于临床治疗提供实验室依据。
1 材料与方法
1.1实验材料与试剂TBD淋巴细胞分离液(天津灏洋公司);RPMI-1640培养基和双抗(美国Hyclone公司 );D-Hanks液、红细胞裂解液、DMSO、HEPES(北京索莱宝公司);胎牛血清(天津康源公司);Trueline 24孔和96孔细胞培养板;LPS、普伐他汀钠、Brij、纯化NE(美国sigma公司);POX染液、瑞氏-姬萨姆复合染液(台湾BASO公司);髓过氧化物酶(myeloperoxidase,MPO)测试盒(南京建成生物公司);Methoxysuccinyl-alanyl-alanyl-prolyl-valyl paranitroanilide (MEOSAAPVNA)(美国SANTA公司);人PMN Elastase ELISA试剂盒(美国Abcam公司);紫外分光光度计(美国Beckman公司);酶标仪(美国Thermo公司)。
1.2实验方法
1.2.1人外周血中性粒细胞提取、培养及分组处理 采用Ficoll密度梯度离心法[4]分离培养人外周血中性粒细胞:取健康人群体检静脉全血4 ml(体检人群年龄段为18~60周岁,血标本常温放置不超过4 h,EDTA抗凝,血液标本由安徽省立医院检验科提供)。取灭菌15 ml离心管,加入4 ml淋巴细胞分离液,在分离液上层缓慢加入全血标本,放入离心机,24 ℃、1 650 r/min ,离心25 min。离心后取出,此时离心管内液体分4层,从上往下分别是血浆层、淋巴细胞层、分离液层、红细胞层,其中中性粒细胞在管底。小心吸去上面三层,加入红细胞裂解液。混匀,然后离心管置于冰盒中裂解15 min,期间需摇动混匀2次。然后1 500 r/min 离心10 min,取出后吸去上清液,不破坏管底沉淀。再加入红细胞裂解液重复裂红4次,1 000 r/min离心5 min,直至沉淀无可见红色。加入D-Hanks液重悬洗涤,放入离心机1 000 r/min离心5 min,弃上清液,重复洗涤1次离心。弃上清液,加入细胞培养液(含10%胎牛血清的RPMI-1640培养基),吹打混匀,取10 μl细胞混匀液加入细胞计数板进行计数,记录细胞总数。稀释细胞浓度至5×105个/ml接种于24孔板中,放入CO2培养箱,恒温37 ℃,孵育48 h。实验分组:普伐他汀钠组(0.5 mmol/L普伐他汀钠);普伐他汀钠+LPS组(0.5 mmol/L普伐他汀钠+1 mg/L LPS);LPS组(1 mg/L LPS);正常对照组(未加药)。普伐他汀钠和LPS均为每孔各0.2 ml,细胞铺板时加入。
1.2.2瑞氏染色法鉴定中性粒细胞 参考血涂片瑞氏染色法进行改良,按上述方法提取中性粒细胞,D-Hanks液重悬后,吸取一滴细胞悬液滴片,自然晾干后甲醇固定液一滴覆盖,晾干后染色:晾干玻片上加瑞氏姬萨姆复合染液15~20滴覆盖玻片,10 s后加水稀释染液,染液和水比例为1 ∶3,混匀,定时3 min,细流水冲洗,晾干,油镜下观察。
1.2.3MPO活性检测 采用比色法测定MPO活性(南京建成生物公司),按试剂盒说明书提取细胞上清液样本,按比例稀释检测。测定原理:中性粒细胞为终末细胞,体外培养时细胞不断死亡裂解,过氧化物酶颗粒释放入细胞上清液,取细胞培养液离心后取上清液稀释,加入H2O2,充分混匀后37 ℃水浴30 min,再加入AH2,通过供氢体邻连茴香胺供氢后生成黄色化合物,在460 nm处通过比色测定产物吸光度,从而推算出MPO的活力及H2O2减少的量和白细胞的数目。
1.2.4NE活性检测 参照Betsuyaku et al[5]的实验方法,采用比色法测定各组上清液中NE的活性。MEOSAAPVNA是NE的一种敏感性的合成底物。准备一个96孔板,加入0.1 ml底物溶液和0.08 ml的样本,底物溶液配比:0.2 mmol/L的MEOSAAPVNA,0.1 mol/L的HEPES,0.5 mol/L的NaCl,0.1%的Brij和2%的DMSO,溶液pH值调至7.5。以纯化的弹性蛋白酶标准品做标准曲线,样本稀释后加入已铺好底物溶液的96孔板中,室温(25 ℃)孵育2 h,酶标仪设定405 nm处检测各孔吸光度,根据NE不同浓度梯度绘制的标准曲线推算出样本中NE活性水平。
1.2.5ELISA法检测细胞上清液中NE含量 按人PMN Elastase ELISA试剂盒说明书操作,细胞培养液从24孔板中提取后离心去除细胞沉淀,取上清液,按说明稀释,试剂盒所有溶液平衡至室温,洗板2次,加入0.1 ml标准品和样本,胶粘剂薄膜覆盖,室温25 ℃孵化1 h(振荡器混匀),再洗板4次,加入HRP Conjugated Antibody 继续孵育1 h,去盖洗4次,加入TMB Substrate Solution,避光孵育20 min,酶标仪620 nm处检测最高标准品OD值为0.9~0.95时,立刻加入终止液停止反应。450 nm处检测吸光度值。使用四参数拟合法结合标准曲线值推算样本浓度值。

2 结果
2.1瑞氏染色结果成功提取纯化人外周血中性粒细胞,改良瑞氏染色后,镜下观察均为多形核白细胞,核深染深紫色,胞质淡粉红色,均可见颗粒状物质。见图1。

图1 中性粒细胞提取后瑞氏染色 ×400
2.2LPS刺激中性粒细胞释放MPO外周血中性粒细胞为终末细胞,从骨髓释放入血后停留6~8 h,随后进入组织可存活3~5 d,为研究证实LPS刺激中性粒细胞释放MPO颗粒的作用,实验以1 mg/L的LPS刺激体外培养的中性粒细胞[6],在不同的时间点检测MPO水平变化,结果显示:LPS在体外可以刺激中性粒细胞释放MPO。与正常对照组相比,LPS组在作用48 h后对细胞中MPO水平刺激达到最大,差异有统计学意义(F=23.55,P<0.01)。未加药的正常对照组MPO水平随时间增加逐渐上升,符合细胞自然死亡裂解趋势。LPS组在48 h前MPO逐渐上升,之后下降,可能由药物起效时间导致,因此后续实验中的LPS组选用1 mg/L的LPS作用48 h。见图2。
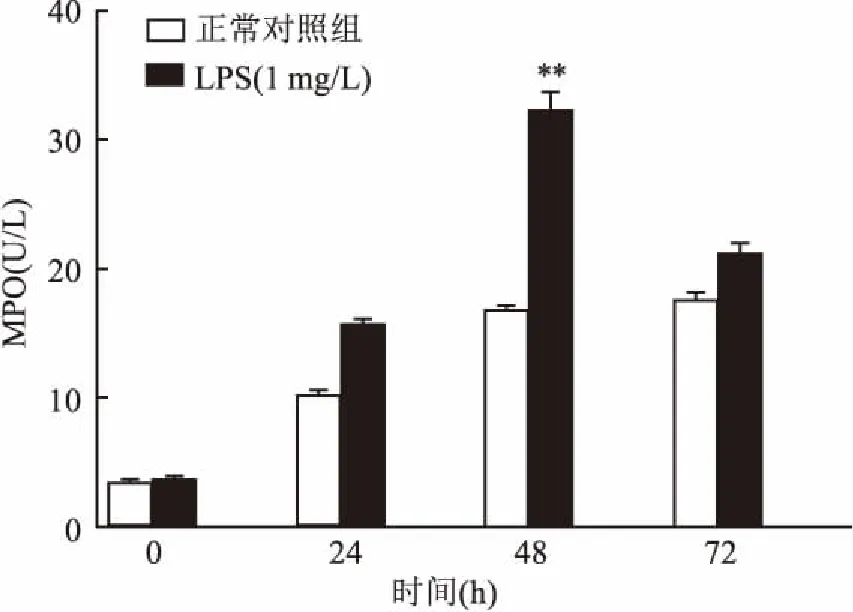
图2 LPS刺激后细胞上清中MPO活力比较
2.3普伐他汀钠对MPO活性的影响根据以上2.1中的实验结果,以1 mg/L的LPS刺激细胞48 h作为对照组,同时加入不同浓度的普伐他汀钠(0.1、0.5、1、2 mmol/L)进行干预,以同样方法测定上清液中MPO活性。检测结果显示:与对照组相比,普伐他汀钠在浓度为0.5 mmol/L时对MPO活性抑制作用最大,且差异有统计学意义(F=14.34,P<0.01)。见图3。
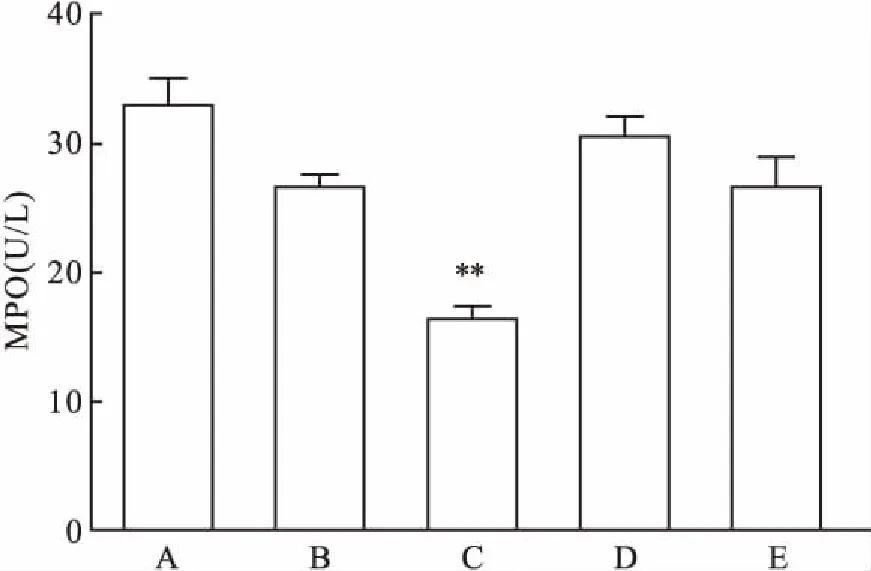
图3 不同浓度普伐他汀钠对MPO活性的影响
A:对照组;B:普伐他汀钠0.1 mmol/L组;C:普伐他汀钠0.5 mmol/L组;D:普伐他汀钠1 mmol/L;E:普伐他汀钠2 mmol/L组;与对照组比较:**P<0.01
2.4普伐他汀钠对NE活性和含量的影响根据2.1和2.2测得的实验结果,将细胞分4组处理:普伐他汀钠组;普伐他汀钠+LPS组;LPS组;正常对照组。普伐他汀钠和LPS均为每孔各0.2 ml,细胞铺板时加入。比色法和ELISA法检测细胞上清液中NE活性及含量,跟正常对照组相比,LPS组NE活性和含量都明显升高,加入普伐他汀钠后明显降低,单独加入普伐他汀钠组也可显著降低,且差异均有统计学意义(NE活性:F=60.910,P<0.01;NE含量:F=118.354,P<0.01)。NE活性及含量在4个处理组中降低和升高的趋势大致相同。见图4。

图4 NE含量及活性表达
A:普伐他汀钠组;B:普伐他汀钠+LPS 组;C:LPS 组;D:正常对照组;与正常对照组比较:**P<0.01;与LPS组比较:△△P<0.01
3 讨论
中性粒细胞是参与慢性气道炎症反应的最主要的细胞之一,可通过释放蛋白酶等多种活性物质直接或间接损伤气道组织[7]。MPO主要存在于中性粒细胞中,是嗜中性粒细胞中嗜天青颗粒释放的标志酶,其含量多少与中性粒细胞的数目成正比[8]。中性粒细胞活化后释放MPO,在肺组织及外周血中均可检测到MPO活性显著增高。因此MPO的相关检测可以反应出中性粒细胞嗜天青颗粒的释放水平。NE主要由中性粒细胞中嗜天青颗粒释放,此外还有巨噬细胞、少量的单核细胞和T细胞也可释放NE。中性粒细胞中NE浓度可超过5 mmol/L,每个成熟粒细胞中大约含有400个阳性颗粒[9]。NE具有强效的杀菌活性,并且可以协助活化的中性粒细胞吞噬病原体。此外,NE可以间接促进上皮细胞释放有效的抗蛋白酶抗菌剂如弹力素(Elafin),SLPI和人β-防御素-2的表达帮助宿主消灭病原体[10]。然而,中性粒细胞又是一把双刃剑,中性粒细胞释放NE与多种炎症性疾病有关,中性粒细胞在脱离循环后不会存活很久,然而在慢性阻塞性肺疾病(chronic obstructive pulmonary,COPD)等患者长期慢性的肺部炎症刺激下可以延长其在肺组织中的存活时间。过高浓度的粒细胞-巨噬细胞集落刺激因子(GM-CSF)的释放和IL-10的相对缺乏,可以促进中性粒细胞凋亡,而NE能特异性地破坏巨噬细胞吞噬凋亡中性粒细胞的功能,导致大量凋亡中性粒细胞坏死释放更多NE及有害物质进入肺组织[11]。此外,NE还可以诱导气道上皮细胞黏蛋白的生产及杯状细胞化生,造成气道黏液高分泌状态,为细菌生长提供有利条件。
通过对COPD患者各种炎症标志物的监测发现,由中性粒细胞和巨噬细胞产生的MMP和NE与COPD炎症作用机制密切相关,这两种酶不仅影响蛋白酶水解,而且能持续调节炎症反应[12]。在COPD患者气道、肺泡灌洗液、诱导痰及外周血中均可以检测到MMP和NE水平有不同程度的升高。研究[13]证实COPD患者急性期血清NE水平显著升高,NE的表达与COPD的临床分期有关,急性加重期NE水平高于稳定期,且与COPD的临床分级有关。COPD患者每一次急性加重,都离不开肺部感染这个重要因素,炎症细胞大量募集,细胞炎症因子及组织蛋白酶的大量释放均导致肺气肿呈进行性加重,且肺泡组织结构破坏后是不可逆的,在此过程中,NE扮演了一个重要的角色。因此降低COPD患者NE水平对于改善气道重塑,延缓肺气肿进展有非常重要的意义。
目前他汀类药物对COPD患者的疗效意见尚不统一,Criner et al[14]通过一项大型前瞻性、多中心、随机对照试验研究证明辛伐他汀对中度及重度COPD急性加重频率没有影响,而Raymakers et al[15]的一项基于人群的队列研究调查了他汀类药物的使用或可降低COPD患者全因死亡率和肺相关死亡率,同时有相关回顾性研究[16]表明他汀类药物可降低COPD恶化率和严重程度,减少患者住院率和死亡率。目前各类研究对COPD疗效评价的指标不同,COPD是一种慢性疾病,多数还伴有全身炎症反应及其他系统疾病,临床研究中有无法避免的干扰因素存在,且在不同研究中患者入选标准及他汀类药物作为COPD辅助用药的疗程及剂量不同,这些都有可能是研究结果出现分歧的原因。而许多动物模型及体外实验受到的干扰较小,因此可以从多方面证实他汀药物的多效性。
本研究结果显示,LPS可以刺激体外培养的中性粒细胞释放胞内嗜天青颗粒,检测上清液中MPO及NE水平随之升高,而加入普伐他汀钠可以显著降低MPO及NE水平,从抗蛋白酶作用的方面提示了他汀药物的又一条效用,为他汀类药物或可应用于COPD辅助治疗,改善患者预后提供了新的依据。但体外细胞水平研究有局限性,未能结合组织病理及临床病例证实研究结论,有待在今后的研究中进一步完善实验对象及方法进行深入探索。
[1] Lee W L.Leukocyte elastase: physiological functions and role in acute lung injury[J].Am J Respir Crit Care Med,2001,164(5):896-904.
[2] 周 健,凌美蓉,邓星奇. 他汀类药物在慢性阻塞性肺疾病治疗中的研究进展[J]. 上海交通大学学报(医学版),2010,30(12):1569-72.
[3] Kamio K,Liu X D,Sugiura H,et al.Statins inhibit matrix metalloproteinase release from human lung fibroblasts[J].Eur Respir J,2010 35(3):637-46.
[4] 李金风,刘文礼,史小娟,等.四种常用的人中性粒细胞分离方法的比较[J].国际病理科学与临床杂志,2008,28(4):277-81.
[5] Betsuyaku T,Yoshioka A,Nishimura M,et al.Neutrophil elastase associated with alveolar macrophages from older volunteers[J].Am J Respir Crit Care Med, 1995,151(2 Pt 1):436-42.
[6] 皋 源. 脂多糖诱导肺成纤维细胞表型转变及异常增殖的机制研究[D]. 苏州: 苏州大学,2013.
[7] 赵 华,赵 瑾. 蛋白酶/抗蛋白酶系统与慢性阻塞性肺疾病[J]. 临床肺科杂志,2010,15(8):1149-51.
[8] 童夏生,李昌崇,阮正英,等. 中性粒细胞弹性蛋白酶、髓过氧化物酶在大鼠哮喘中的变化及意义[J]. 中国病理生理杂志,2006,22(7):1397-401.
[9] Belaaouaj A, McCarthy R, Baumann M, et al. Mice lacking neutrophil elastase reveal impaired host defense against gram negative bacterial sepsis[J].Nat Med, 1998, 4(5): 615-8.
[10] Griffin S, Taggart C C, Greene C M, et al. Neutrophil elastase up-regulates human β-defensin-2 expression in human bronchial epithelial cells[J]. FEBS letters, 2003, 546(2-3): 233-6.
[11] Barnes P J, Shapiro S D, Pauwels R A. Chronic obstructive pulmonary disease: molecular and cellular mechanisms[J]. Eur Respir J, 2003, 22(4): 672-88.
[12] Sng J H J, Thomas P S. COPD: immunopathogenesis and immunological markers[J]. Adv Res, 2014, 3(2): 221-35.
[13] Sinden N J,Baker M J,Smith D J,et al.α-1-antitrypsin variants and the proteinase/antiproteinase imbalance in chronic obstructive pulmonary disease[J]. Am J Physiol Lung Cell Mol Physiol,2015,308(2):L179-90.
[14] Criner G J,Connett J E,Aaron S D,et al.Simvastatin for the prevention of exacerbations in moderate-to-severe COPD[J].N Engl J Med,2014,370(23):2201-10.
[15] Raymakers A J N,Sadatsafavi M,Sin D D,et al.The impact of statin drug use on all-cause mortality in patients with COPD: a population-based cohort study[J].Chest,2017,152(3):486-93.
[16] Janda S,Park K,FitzGerald J M,et al.Statins in COPD: a systematic review[J].Chest,2009,136(3):734-43.

