BMSC-CM通过抑制Notch1信号通路减轻H2O2诱导的神经干细胞凋亡
牛 杨,申才良,宋旆文,刘晓颖
脊髓损伤(spinal cord injury,SCI)可导致严重的神经系统疾病,给个人家庭和社会造成巨大负担。神经干细胞(neural stem cells,NSCs)是一类细胞,不仅可以自我复制,而且具有分化成多种神经细胞的潜力[1]。研究[2]表明,NSCs可以分化为有助于损伤后脊髓组织修复的神经元。这一发现表明脊髓损伤后的功能恢复是可能的。然而,由于脊髓损伤后的氧化应激环境,移植入体内的NSCs很难存活[3]。因此,减少氧化应激损伤成为NSCs治疗SCI的关键一环。
目前许多研究已经证明骨髓间充质干细胞(bone mesenchymal stem cells ,BMSCs)对SCI的治疗作用。有学者发现BMSCs旁分泌液具有有效的免疫调节和抗氧化应激特性[4-5]。然而,其主要机制尚不清楚。有研究[6]指出Notch信号通路在控制细胞增殖和凋亡中发挥关键作用。因此在该研究中,将着重研究骨髓间充质干细胞条件培养基(bone mesenchymal stem cell conditional medium,BMSC-CM)对体外H2O2诱导的NSCs的保护作用,以及Notch1信号通路(Notch1 signaling pathway, Notch1)在NSCs的氧化应激反应中的作用以及BMSC-CM的保护机制是否与Notch1相关联。
1 材料与方法
1.1动物和试剂SD大鼠获自安徽医科大学实验动物科学研究所;表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibrob last growth factor,bFGF)购自美国PeproTech公司;DMEM和DMEM / F12购自美国 Gibco BRL公司;B27购自美国Invitrogen公司;胎牛血清(FBS)购自美国HyClone公司;GFAP和MAP-2抗体、左旋多聚赖氨酸购自美国Sigma公司;细胞巢蛋白抗体 (Nestin) 、DAPT购自美国Santa Cruz公司;膜联蛋白V-FITC / PI凋亡检测试剂盒购自美国Becton Dickinson公司。
1.2神经干细胞的培养取24~48 h的SD小鼠,酒精消毒后脱臼处死,取出完整脑组织。使用解剖显微镜小心地剔除脑膜。将组织切成小块,加入胰酶消化液,而后放入恒温箱中7 min,随后取出切碎的组织在巴斯德吸管中研磨。研磨后的组织通过滤网过滤,然后以1 000 r/min离心5 min,去除上清液,重悬沉淀,再次以1 000 r/min离心5 min,而后将沉淀的组织重新悬浮于增殖培养基(含有2%B27补充剂,20 ng/ml EGF和10 ng/ml bFGF的DMEM/F12培养基)中。然后,将细胞以105个细胞/ml的方式接种在烧瓶中,然后将细胞放在恒温箱中进行孵育。每4 d更换一次培养基。细胞培养7 d后,其增殖并形成悬浮的神经球,其直径约为100 μm。然后,吹散神经球,对神经干细胞进行传代培养。按照相同的程序培养第2代神经球。当细胞增殖并形成达到直径约为100 μm的悬浮神经球时,将细胞用于实验。将第2代神经球移植到用聚-L-赖氨酸上油的盖玻片上。然后通过免疫细胞化学鉴定NSCs。在神经球中发现巢蛋白阳性的许多细胞(图1A)。
1.3培养细胞的分化免疫荧光染色实验应用免疫细胞化学技术检测细胞的MAP-2表达。将传代培养7 d后的神经干细胞吹散,而后接种在被多聚甲醛浸润过得拨片上,而后加入培养液,每3 d更换一次培养液,7 d后向培养物中加入4%多聚甲醛,使培养物在室温下静置15~20 min。 然后,将培养物用PBS洗涤3次,每次5 min。 细胞用含有10%正常山羊血清的0.3%Triton-X100处理以在室温下封闭非特异性抗原30 min。 然后,将培养物与抗MAP-2在4 ℃环境下过夜。 第2天,将培养物用PBS洗涤3次,每次5 min。 将特异性二抗加入到培养物中,并将培养物在37 ℃下孵育40~60 min。 然后将细胞用PBS洗涤3次,每次5 min,并使用DAPI在室温下染色细胞核5~10 min。 最后,将载玻片用PBS漂洗3次,并用荧光显微镜成像。 使用相同的方法染色GFAP(图1)。
1.4制备BMSCs及其条件培养基使用戊巴比妥钠用于处死大鼠。然后,从胫骨和股骨收集骨髓基质干细胞。将收集的组织悬浮液以1 000 r/min离心5 min以溶解红细胞。然后,使用Krebs缓冲液和0.83%NHCL4的混合物在4 ℃下将沉积的细胞重新悬浮10 min。然后将组织洗涤2次,并以1 000 r/min将培养物离心5 min。接下来,将沉淀的细胞重新悬浮在含有20%FBS的DMEM中。将细胞以106个细胞/ ml接种在玻璃烧瓶中。使用细胞培养箱孵育BMSCs(37 ℃、5% CO2)。 48 h后更换培养基,每4 d更换一次。当细胞贴壁达到至少80%以上时,使用胰酶对间充质干细胞进行消化重悬,重复上述离心步骤,最后再以105个细胞/ ml将它们重新接种在玻璃烧瓶中。当细胞传至第3代时,贴壁率达90%时,使用倒置显微镜观察其形态。流式细胞仪鉴定BMSCs[7]。而后将培养基从玻璃烧瓶中取出,玻璃烧瓶用Krebs缓冲液洗涤3次。最后,用不含FBS的DMEM培养液培养BMSCs 24 h,而后倒出培养液,并使用直径0.22 μm的孔滤器获得所得条件培养基。
1.5细胞分组和处理将NSCs分为4组后进行编号,分别接种于24孔板中,每孔约1 ml,第一组为对照组,加入等量PBS,第二组为H2O2处理组(50、100、200 μmol/L),测定不同浓度H2O2对NSCs的影响,第三组为H2O2(100 μmol/L)处理组+DAPT组(5、10、20 μmol/L),测定不同浓度DAPT对损伤后NSCs的影响,第四组为H2O2(100 μmol/L)处理组+BMSC-CM组(50、100、200 μmol/L),测定不同浓度BMSC-CM对损伤后NSCs的影响。各组均在37 ℃、5%温箱中培养2 h,而后通过流式细胞仪检测细胞凋亡率。
1.6细胞凋亡分析通过FITC-Annexin V / PI染色试剂盒检测神经干细胞的凋亡。在H2O2处理2 h后,通过离心(1 000 r/min、5 min)收获细胞。然后,用冰冷的PBS洗涤细胞2次。然后将细胞与FITC(5 μl)和PI(5 μl)染色试剂盒在室温下避光环境中孵育15 min。然后使用流式细胞仪分析细胞。数据由FACStation数据管理系统和Cell Quest软件(美国,Becton Dickinson,San Jose公司)分析。
1.7Westernblot分析通过在2 000 r/min离心5 min(室温)收集细胞。然后将样品裂解。将样品缓冲液加入样品中(样品 ∶样品缓冲液=体积比为4 ∶1)。然后,将样品重新悬浮并煮沸(5 min,95~100 ℃)。接下来,在室温下以1 200 r/min离心样品2 min。收集所得上清液进行Western blot分析。然后将上清液转移到聚偏二氟乙烯(PVDF)上。随后用5%的无脂牛奶在室温下封闭膜2 h。然后将膜与结合的抗Notch1(1 ∶200),抗Hes1 (Hairy and enhancer of split 1,Hes1)(1 ∶200),抗B细胞淋巴瘤蛋白2(B cell lymphoma 2,Bcl-2)(1 ∶200),抗Bcl-2相关蛋白(Bcl-2 assaciated X protein,Bax)(1 ∶200),抗含半胱氨酸的天冬氨酸水解酶3蛋白(Cysteinyl aspartate specific proteinase 3,Caspase-3)(1 ∶200),抗含半胱氨酸的天冬氨酸水解酶9蛋白(Cysteinyl aspartate specific proteinase 9,Caspase-9)(1 ∶200)和抗β-肌动蛋白(1 ∶1 000)过夜。第2天,用TBST洗涤膜4次。然后将膜在二次抗体(1 ∶4 000稀释)中在室温下温育2 h。之后,用TBST洗涤膜4次,共10 min。最后,使用SuperSignal West Femto最大灵敏度底物检测系统(美国Pierce公司)来观察免疫反应带。使用Epson V200和Quantity One分析结果。

2 结果
2.1大鼠NSCs鉴定体外分离的神经干细胞培养7 d后,可见细胞聚集成球生长,选取贴壁后的神经球细胞行神经干细胞特异性蛋白Nestin荧光染色检测,结果见图1A,见Nestin阳性表达。MAP-2为神经元细胞特异性蛋白,GFAP为神经胶质细胞特异性蛋白,对贴壁分化培养7 d后的神经干细胞进行免疫荧光染色,鉴定神经元及神经胶质细胞,结果见图1B、1C,MAP-2及GFAP 均阳性表达,进一步证明体外分离细胞为神经干细胞。
2.2H2O2对NSCs细胞凋亡的影响用不同浓度的H2O2(50、100、200 μmol/L)分别处理NSCs 2 h。通过流式细胞仪测定凋亡率。结果显示凋亡率随着H2O2浓度的增加而增加(图2)。选用100 mol/L H2O2处理组,检测蛋白质的表达。Western blot结果显示,与对照组相比,Notch1(t=13.508,P<0.01),Hes1(t=15.150,P<0.01),Caspase-3(t=23.800,P<0.01),Caspase-9(t=19.682,P<0.01)和Bax(t=14.002,P<0.01)蛋白的表达明显升高,而Bcl-2(t=33.389,P<0.01)的表达则明显低于对照组(图3)。
2.3DAPT可保护神经干细胞免受H2O2诱导的细胞凋亡为了研究Notch1信号通路在H2O2诱导的氧化应激中的作用,将不同浓度的DAPT(5、10、20 μmol/L)加入到用H2O2处理的NSCs(2 h、100 μmol/L)中。通过流式细胞术测量细胞活力。随着DAPT浓度的增加,细胞存活率显着增加。实验数据分析结果见图4。通过Western blot检测H2O2+ DAPT(10 μmol/L)组蛋白的表达。结果表明与100 μmol/L H2O2组比较,Notch1(t=9.470,P<0.01),Hes1(t=8.728,P<0.01), Caspase-3(t=10.035,P<0.01), Bax(t=8.386,P<0.01)和Caspase-9(t=15.062,P<0.01)蛋白明显降低;而Bcl-2(t=3.375,P<0.05)的表达显著增加(图5)。
2.4BMSC-CM保护神经干细胞免受H2O2诱导的细胞凋亡为了研究BMSC-CM在H2O2诱导的NSCs氧化应激中的保护作用,将不同浓度的BMSC-CM加入到H2O2处理过得的神经干细胞中(100 μmol/L,2 h)。通过流式细胞术测量细胞凋亡率。当BMSC-CM的浓度增加时,细胞存活率显着增加。实验数据分析结果见图6。另外,Western blot检测100 μmol/L H2O2+100 μmol/L BMSC-CM组蛋白的表达。与100 μmol/L H2O2处理组比较,Notch1(t=9.920,P<0.01),Hes1(t=10.250,P<0.01),Caspase-3(t=10.996,P<0.01),Bax(t=10.136,P<0.01)和Caspase-9(t=10.824,P<0.01)明显降低,而Bcl-2(t=4.353,P<0.05)的表达则显着增加(图7)。

图1 神经干细胞免疫荧光染色结果 ×400
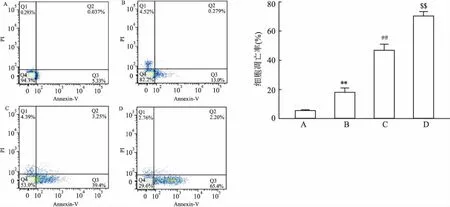
图2不同浓度的过氧化氢对神经干细胞存活率的影响
A:对照组;B:50 μmol/L H2O2处理组;C:100 μmol/L H2O2处理组; D:200 μmol/L H2O2处理组;与对照组比较:**P<0.01;与50 μmol/L H2O2组比较:##P<0.01;与100 μmol/L H2O2组比较:$$P<0.01
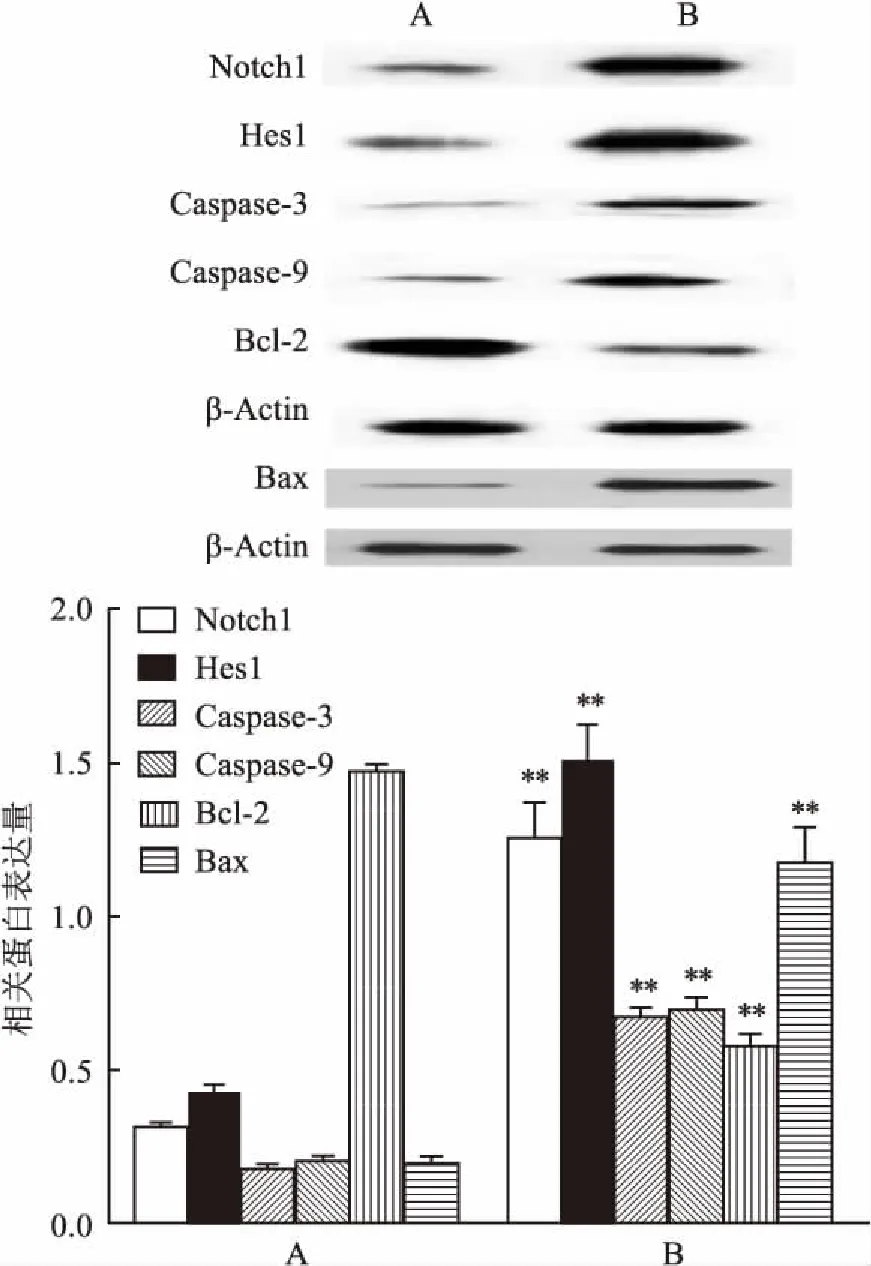
图3 加入H2O2后NSCs相关蛋白表达量比较
A:对照组;B:100 μmol/L H2O2处理组;与对照组比较:**P<0.01
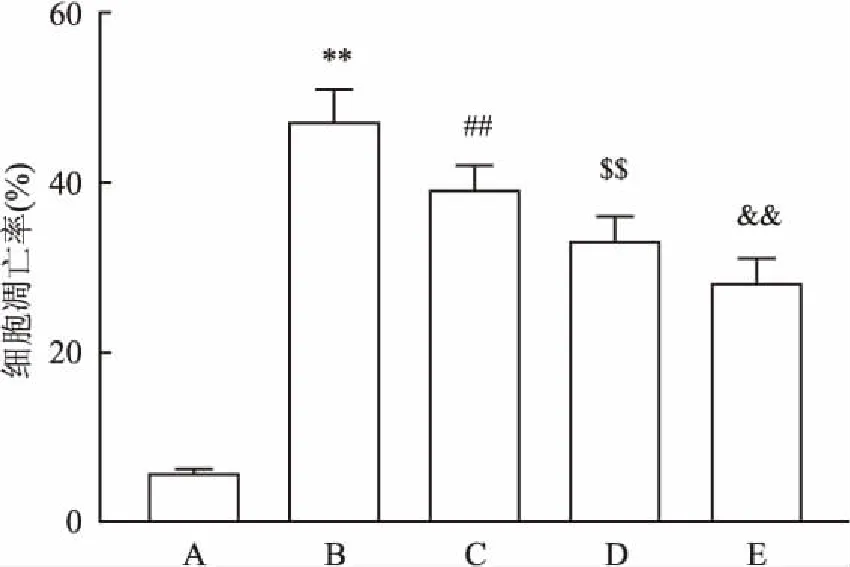
图4 向100 μmol/L H2O2中加入不同浓度的Notch通道阻滞剂(DAPT)后对神经干细胞存活率的影响
A:对照组; B: 100 μmol/L H2O2处理组; C: 100 μmol/L H2O2+5 μmol/L DAPT处理组; D: 100 μmol/L H2O2+10 μmol/L DAPT处理组;E: 100 μmol/L H2O2+20 μmol/L DAPT处理组;与对照组比较:**P<0.01;与100 μmol/L H2O2组比较:##P<0.01;与100 μmol/L H2O2+5 μmol/L DAPT组比较:$$P<0.01;与100 μmol/L H2O2+10 μmol/L DAPT组比较:&&P<0.01
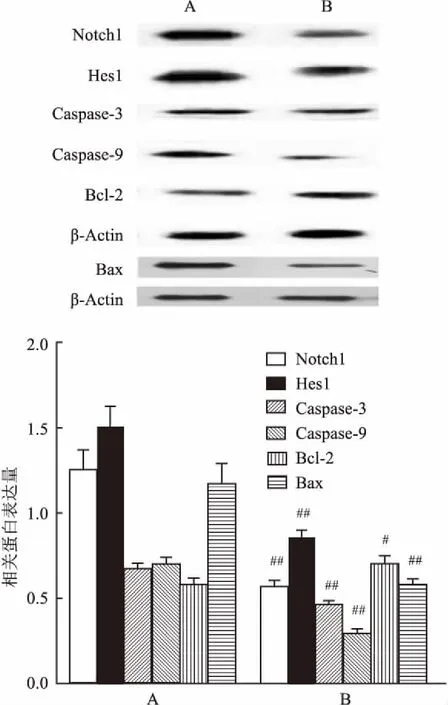
图5 加入DAPT后受损NSCs相关蛋白表达量比较
A:100 μmol/L H2O2处理组;B: 100 μmol/L H2O2+10 μmol/L DAPT处理组;与100 μmol/L H2O2处理组比较:#P<0.05,##P<0.01
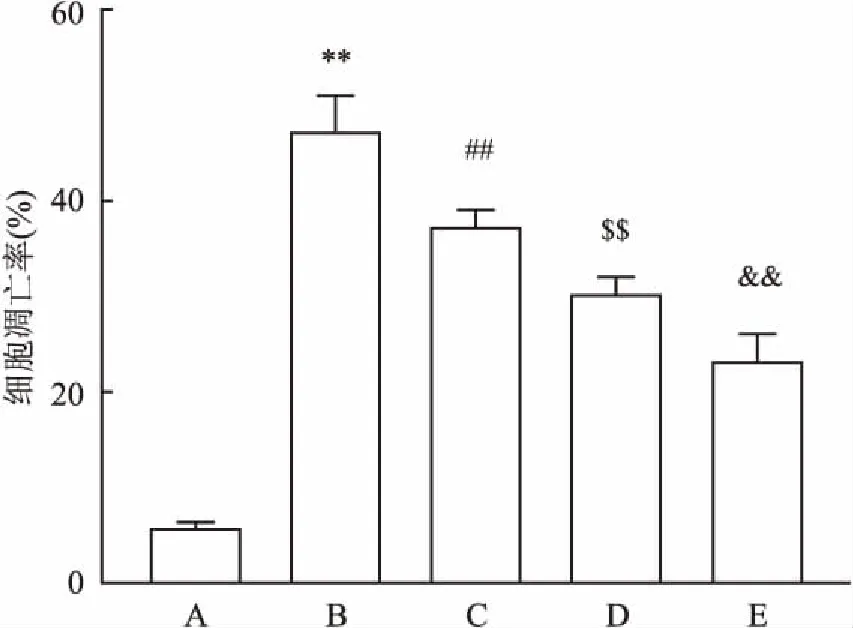
图6 向100 μmol/L H2O2中加入不同浓度的BMSC-CM后对神经干细胞存活率的影响
A:对照组; B: 100 μmol/L H2O2处理组; C: 100 μmol/L H2O2+50 μmol/L BMSC-CM处理组; D: 100 μmol/L H2O2+100 μmol/L BMSC-CM处理组; E: 100 μmol/L H2O2+200 μmol/L BMSC-CM处理组;与对照组比较:**P<0.01;与100 μmol/L H2O2组比较:##P<0.01;与100 μmol/L H2O2+50 μmol/L BMSC-CM组比较:$$P<0.01;与100 μmol/L H2O2+100 μmol/L BMSC-CM组比较:&&P<0.01
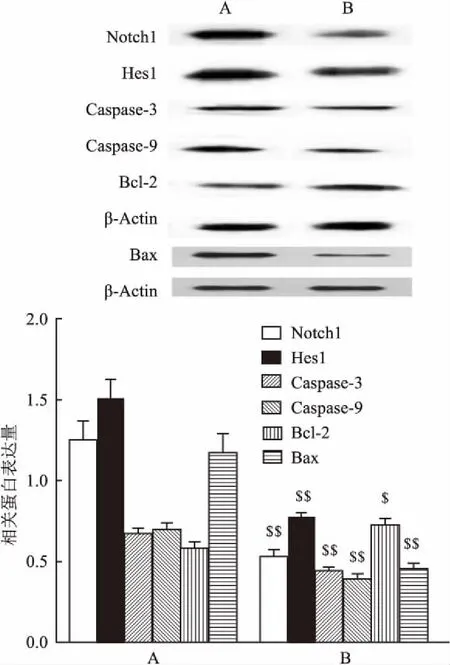
图7 加入BMSC-CM后受损NSCs相关蛋白表达量比较
A:100 μmol/L H2O2处理组;B: 100 μmol/L H2O2+100 μmol/L BMSC-CM处理组;与100 μmol/L H2O2处理组比较:$P<0.05,$$P<0.01
3 讨论
本研究结果表明BMSC-CM可以减少用H2O2处理的NSCs的凋亡。此外,当把BMSC-CM加入到H2O2诱导的神经干细胞时,Notch1和Hes1的表达降低。这些结果表明,BMSC-CM可能是通过抑制Notch1信号通路减弱氧化应激损伤从而产生对NSCs的保护作用。
脊髓损伤后的氧化应激环境是影响干细胞移植治疗的关键因素。最近的一项研究[8]表明,H2O2可模拟氧化应激环境,诱导细胞功能障碍和细胞凋亡。在本研究中,在H2O2的帮助下,模拟了NSCs培养过程中的氧化应激环境。结果表明,当向神经干细胞中加入H2O2后,细胞凋亡率随之增加。这与Wang et al[8]的研究是相一致的。
Boopathy et al[9]之前已经研究发现,当细胞暴露于H2O2时,Notch1信号通路可以被激活。当Notch1信号通路被激活时,细胞膜上的Notch1受体与其相邻的配体(Delta和Jagged)组合。随后,肿瘤坏死因子α转换酶(TACE-α)和早老素1(2)(PS1 / 2)参与酶过程,切除大部分Notch1受体的细胞外结构域,然后释放Notch1细胞内结构域(NICD)进入细胞质。在NICD进入细胞质后,其进一步转移到细胞核中,其结合DNA结合蛋白CBF / RBP-JK以形成转录激活物并激活其相关的下游基因。在哺乳动物中,Notch的主要下游靶基因是HES(分裂的毛发/增强子)和ESR基因家族中的基因,如Hes-1和Hes-5[10]。在本文中,通过Western blot蛋白检测结果显示,当加入H2O2后Notch1和Hes1的表达会增加,这与之前研究[11-12]结果相一致。为了进一步研究Notch1信号通路对H2O2诱导的NSCs细胞凋亡的影响,使用DAPT用于特异性阻断Notch1信号通路。结果显示当DAPT加入后细胞存活率显著提高,而且细胞的凋亡率与DAPT的浓度呈负相关性。
近几年研究[13]显示BMSC-CM具有神经保护作用,因此BMSC-CM被认为是神经损伤疾病中的潜在治疗剂。然而,神经干细胞中BMSC-CM的具体机制尚未公开。本研究设计了一个实验组,通过向H2O2诱导后的神经干细胞加入BMSC-CM来验证条件培养基的保护作用。结果显示加入BMSC-CM处理后的实验组,细胞存活率明显增强。为了进一步研究BMSC-CM与Notch1信号通路的关系,采用Western blot法检测Notch1和Hes1的表达。结果表明加入BMSC-CM实验组,Notch1和Hes1表达量显著降低。结合以上的实验结果表明,Notch1信号通路是调节神经干细胞凋亡的重要通路,且条件培养基可以通过抑制Notch1信号通路提高神经干细胞的存活率。
研究[14]证明,Bax、Bcl-2和Caspase-3家族在调节细胞凋亡中起关键作用,是细胞存活途径的重要成员,当Caspase-3被激活后,可以激活更多的下游凋亡因子,如Caspase-6和Caspase-9,这将进一步增强对细胞的凋亡作用。 Bcl-2可以抑制多种细胞毒性因子提高细胞存活率。 Bcl-2的过度表达可以减少氧自由基的产生和脂质过氧化物的形成。 因此目前有学者认为Bcl-2的表达强弱可以作为细胞对细胞毒素的抵抗力的观察指标[15],表明Bcl-2是凋亡过程执行步骤的重要组成部分。在本研究中,BMSC-CM和DAPT可以抑制Caspase-3、Caspase-9、Bax的表达,并增强Bcl-2的表达。这些结果表明Notch1途径可能与Bax、Bcl-2和Caspase家族相关,BMSC-CM通过参与调节神经干细胞中Bcl-2表达和Caspase家族来减弱细胞凋亡。
[1] Bergstr M T. Neural stem cells: brain building blocks and beyond[J]. Ups J Med Sci,2012,117(2):132-42.
[2] Badner A, Siddiqui A M,Fehlings M G. Spinal cord injuries: how could cell therapy help[J]. Expert Opin Biol Ther,2017,17(5):529-41.
[3] Sohn H M, Hwang J Y, Ryu J H, et al. Simvastatin protects ischemic spinal cord injury from cell death and cytotoxicity through decreasing oxidative stress:invitroprimary cultured rat spinal cord model under oxygen and glucose deprivation-reoxygenation conditions[J]. J Orthop Surg Res, 2017, 12(1):36.
[4] Roshanzamir F. Quercetin attenuates cell apoptosis of oxidant-stressed SK-N-MC cells while suppressing up-regulation of the defensive element, HIF-1α[J]. Neuroscience, 2014, 277:780-93.
[5] Chen S D, Yin J H, Hwang C S, et al. Anti-apoptotic and anti-oxidative mechanisms of minocycline against sphingomyelinase/ceramide neurotoxicity: implication in Alzheimer's disease and cerebral ischemia[J]. Free Radic Res,2012,46(8):940-50.
[6] Shi Y, Hu Y, Lv C. Effects of reactive oxygen species on differentiation of bone marrow mesenchymal stem cells[J]. Ann Transplant, 2016, 21:695-700.
[7] 李海太, 申才良, 宋旆文,等. BMP-4对大鼠骨髓间充质干细胞与神经干细胞共培养转归影响的实验研究[J]. 安徽医科大学学报, 2016, 51(2):205-9.
[8] Wang S, Zhang T, Yang Z, et al. Heme oxygenase-1 protects spinal cord neurons from hydrogen peroxide-induced apoptosisviasuppression of Cdc42/MLK3/MKK7/JNK3 signaling[J]. Apoptosis, 2017, 22(3):449-62.
[9] Boopathy A V, Pendergrass K D, Che P L, et al. Oxidative stress-induced Notch1 signaling promotes cardiogenic gene expression in mesenchymal stem cells[J]. Stem Cell Res Ther,2013,4(2):43.
[10] Deskin B, Lasky J, Zhuang Y. Requirement of HDAC6 for activation of Notch1 by TGF-β1[J]. Sci Rep,2016,6:31086.
[11] Tang G, Liu Y, Zhang Z, et al. Mesenchymal stem cells maintain blood-brain barrier integrity by inhibiting aquaporin-4 upregulation after cerebral ischemia[J]. Stem Cells , 2014, 32(12):3150-62.
[12] Kamarehei M. Modulation of notch signaling pathway to prevent H2O2/menadione-induced SK-N-MC cells death by EUK134 [J]. Cell Mol Neurobiol, 2014, 34(7): 1037-45.
[13] Cui C, Cui Y, Gao J, et al. Intraparenchymal treatment with bone marrow mesenchymal stem cell-conditioned medium exerts neuroprotection following intracerebral hemorrhage[J]. Mol Med Rep, 2017, 15(4):2374-82.
[14] Hsieh M J, Lin C W, Chen M K, et al. Inhibition of cathepsin S confers sensitivity to methyl protodioscin in oral cancer cellsviaactivation of p38 MAPK/JNK signaling pathways[J]. Sci Rep, 2017, 7:45039.
[15] Ding Y, Tian Y, Zeng Z, et al. YCl3 promotes neuronal cell death by inducing apoptotic pathways in rats[J]. Biomed Res Int, 2017, 2017:2183658.

