填料塔离子液体气相内脱水实验研究
吴连昆 高立东 邓俊宝 赵宏,
1.北京化工大学教育部超重力工程研究中心 2.北京化工大学苏州(相城)研究院
气体中的水分往往会对气体的使用、运输和工业生产造成不良影响。例如,石油化工行业中产生的CO2等酸性气体溶于水后会腐蚀输送管道[1-2];天然气与水蒸气在一定条件下会形成水合物造成阀门和管道堵塞,降低管道输送能力[3-5];锂电行业中,空气中含量过高的水分被电池吸收,会造成电池鼓胀、漏液[6]。因此,脱水是气体净化工艺中非常重要的环节。常用的脱水方法有物理吸附法、溶剂吸收法、冷却分离法等[7-12]。溶剂吸收法因具有处理量大、气体压降小、运行稳定等优点,得到了广泛的应用,常用脱水剂为三甘醇(triethylene glycol,以下简称TEG)[6]。但三甘醇在操作过程中存在挥发损失较大、易被污染而发泡、易氧化分解等缺点。因此,需要开发一种更加高效稳定的吸收剂。
离子液体(ionic liquids,简称IL)是一种由体积相对较大、不对称的有机阳离子和体积相对较小的无机或有机阴离子相互结合而成、在室温或低温下呈液态的盐类化合物[13-16]。与传统的有机溶剂相比,离子液体具有一系列突出的优点:①离子液体蒸气压非常低,作为气体吸收剂可以避免挥发损失,且对被净化气体无二次污染;②在减压条件下能有效分离出溶解在其中的易挥发性气体,再生性能良好,可循环利用;③具有较高的热稳定性和化学稳定性,与许多气体不发生化学反应[17-19]。基于以上优点,离子液体在气体分离、化学反应、电化学等领域得到了广泛应用[20-22]。
本研究以[BMim][Ac]离子液体(以下简称离子液体)为吸收剂,用空气和水蒸气的混合气模拟含水湿气,在填料塔中进行脱水实验。考察了离子液体流量、离子液体贫液含水量、液体温度、空气流量以及进气含水量对脱水效果的影响,以期为离子液体脱水的工业化应用提供数据支持。
1 实验部分
1.1 试剂与仪器
离子液体(质量分数≥98%,林州市科能材料科技有限公司)、空气压缩机(BLT-10A, 博莱特(上海)压缩机有限公司)、蠕动泵、手持式露点仪(vaisala DM 70,量程:-40~60 ℃,精度±2 ℃)、KF-1型水分测定仪、恒温加热磁力搅拌器、玻璃转子流量计等。
1.2 实验流程
实验流程如图1所示。脱水填料塔由玻璃圆筒、喷头、θ金属网环填料等组成。玻璃圆筒内径30 mm,塔高600 mm,内装θ金属网环(Φ3 mm×3 mm),填料层总高度450 mm。由空气压缩机输出的空气经转子流量计进入加湿装置,增湿的空气在缓冲罐除去夹带的液态水后,在室温下由塔底进入填料塔。离子液体由蠕动泵输送至塔顶,经喷头喷淋在填料表面。气液在填料塔中逆流接触,发生气液相物质交换。脱水后离子液体由塔底液体出口流入储罐,干气由塔顶排出。采用手持式露点仪在气体进出口测定空气露点和含水量,计算空气露点降。利用卡尔-费休(KF)滴定法测定离子液体含水量。

采用露点降(dew point depression)表示脱水深度,露点降计算公式如式(1)所示:
Δtd=td,in-td,out
(1)
式中: Δtd为露点降,℃;td,in为进口湿气露点,℃;td,out为出口干气露点,℃。
2 结果与讨论
2.1 离子液体流量对脱水效果影响
在空气流量(以下简称气量)1 m3/h、离子液体贫液中水质量分数1%、液体温度20 ℃、进气中水质量浓度17.10 g/m3的条件下,考察了离子液体流量(以下简称液量)对脱水效果的影响,见图2。由图2可知,随着液量的增加,空气露点降逐渐增大,当液量超过12 L/h后,露点降的增大趋势开始变缓。这是因为液量增加增大了填料塔内持液量和气液接触面积,提高了传质系数。同时,液量增大为单位体积流量气体提供了更多的吸收剂,降低了离子液体含水量,提高了传质推动力,因此,露点降逐渐增大。当液量继续增大时,仅增加了液膜厚度和液体下降速度,而液膜面积基本保持不变,且气液物质交换开始趋近于平衡态,因此,导致露点降增幅变缓。虽然增大液量可获得更高的脱水深度,但降低了富液中水的质量分数,不利于解吸,加大了设备负荷与再生能耗,导致运行费用增加。因此,在满足工业要求的情况下,应尽量减小溶液循环量。在本实验条件下,溶液循环量选择9~12 L/h 为宜。

2.2 气量对脱水效果的影响
在液量9 L/h、离子液体贫液中水质量分数1%、液体温度20 ℃、进气中水质量浓度18.26 g/m3的条件下,考察了气量对脱水效果的影响,见图3。由图3可知,当气量小于1 m3/h时,气量增加对空气露点影响较小,气量超过1 m3/h时,空气露点增加明显。气量增大一方面促使液气湍动程度加剧,气液接触面积增大,有利于传质;另一方面,气量增大导致填料塔中气速加快,气体在填料塔中停留时间变短,缩短了气液接触时间,造成部分水分未能及时被吸收而大量逃逸。同时,气量的增加造成填料塔中液量相对变小,增大了单位体积吸收剂的吸水负荷,不利于传质的进行。在本实验条件下,气量选择1 m3/h为宜。

2.3 离子液体贫液含水量对脱水效果的影响
在液量9 L/h、气量1 m3/h、液体温度20 ℃、进气中水质量浓度为17.10 g/m3的条件下,考察了离子液体贫液含水量对脱水效果的影响,见图4。由图4可知,随着离子液体贫液含水量的增加,露点降明显降低。这是因为离子液体贫液中含水量增加,一方面增大了气液两相间传质阻力,导致离子液体吸水能力变弱,不利于吸收过程;另一方面,水分子的加入会破坏离子液体内部的氢键网格结构[23],离子液体贫液含水量增加降低了水分子与离子液体间的相互作用力。因此,离子液体贫液含水量增加导致露点降变小,出口干气露点增大。对比图2与图4发现,离子液体贫液含水量对露点降的影响更加明显,实验结果表明,与增加液量相比,降低离子液体贫液含水量可获得更大的露点降。综上所述,为获得更好的脱水效果,应尽量减少离子液体贫液含水量。

2.4 离子液体温度对脱水效果的影响
在液量9 L/h、气量1 m3/h、贫液中水质量分数1%、进气中水质量浓度16.96 g/m3的条件下,考察了离子液体温度对脱水效果的影响,见图5。由图5可知,随着离子液体温度的升高,空气露点降随之减小。研究发现,离子液体吸水性强弱主要取决于阴阳离子氢键作用,在离子液体和水的各种相互作用中,氢键占主导作用,阴阳离子氢键作用越强,吸水性就越强[24-25],而温度的升高使氢键键能降低,破坏了水分子与离子液体阴阳离子间氢键,造成离子液体与水之间的相互作用力变弱。另一方面,离子液体脱水是典型的物理过程,服从亨利定律。由亨利定律可知,亨利系数是温度的函数,温度升高,亨利系数增大,挥发性溶质的挥发能力增强,不利于吸收;因此,温度升高,出口干气露点升高,露点降变小。综合考虑脱水工艺操作条件和温度对离子液体黏度的影响,在本实验条件下,温度选择20~30 ℃为宜。

2.5 进气含水量对脱水效果的影响
在液量9 L/h、气量1 m3/h、贫液中水质量分数1%、液体温度20 ℃的条件下,考察了进气含水量对脱水效果的影响,见图6。由图6可知,随着进气含水量增加,露点降逐渐升高。离子液体脱水过程分为两步进行,首先,水分子被离子液体表面层吸收;然后,水分子从表面层扩散到离子液体液相主体中[26]。离子液体脱水过程显示为气膜控制过程,第1步是限速步骤,进气含水量的增加,增大了气相中水气分压,提高了气液相间传质推动力,有利于水分子快速被离子液体表面层吸收从而进入液相主体中。因此,气体进口含水量增加,露点降增大。另一方面,当溶液循环量不变时,进气含水量增加会增大吸收剂的吸水负荷,导致出口气体含水量增加,出口气体露点升高。

2.6 离子液体与三甘醇对比
在液量9 L/h、气量1 m3/h、溶液温度20 ℃、进气中水质量浓度为17.10 g/m3的条件下,对比了离子液体与TEG在不同贫液含水量下的脱水效果,见图7。由图7可知,空气露点降随离子液体与TEG贫液含水量的增加而降低,在相同的实验条件下,离子液体脱水效果明显优于三甘醇。
离子液体与三甘醇物性数据对比如表1所列。与三甘醇相比,离子液体液态范围宽,蒸气压极低,在常压、室温的条件下呈液体状态,几乎不挥发,作为吸收剂可以减少溶剂损失,且容易再生,在70 ℃、绝压5.06 kPa的条件下即可有效分离出溶解在其中的水分。离子液体性质稳定、无腐蚀性,避免了三甘醇因氧化分解造成的溶剂损失和设备腐蚀等问题。同时,离子液体无可燃性、无着火点,更加安全可靠。离子液体热容小,吸收容量大,在水含量较高时也能获得良好的脱水效果,减小了吸收剂用量和再生过程中的能耗。值得一提的是,离子液体种类繁多,可以通过改变阴阳离子的不同组合设计出具有不同功能的离子液体,从而满足不同的用途和场合,故离子液体用于气体脱水展现出良好的应用潜力。
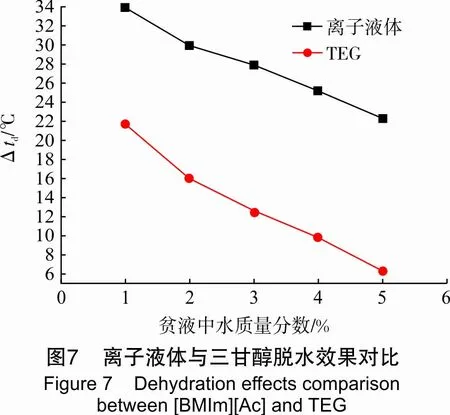

表1 离子液体与三甘醇物性数据对比Table 1 Physical properties data comparison between ionic liquid and TEG吸收剂种类密度/(kg·m-3) (20 ℃)黏度/(mPa·s)(20 ℃)定压热容/(kJ·kg-1·K-1) (20 ℃)蒸气压/kPa(25 ℃)离子液体1 055.75501.9-TEG1 124.6492.20.000 18
3 结 论
(1) 采用填料塔离子液体脱水实验研究获得了最佳实验条件,取得了良好的脱水效果,为其工业化应用提供了数据支持。
(2) 实验结果表明,液量、离子液体温度、贫液含水量、气量和进气含水量都会对脱水效果产生影响,液气比越大,离子液体温度越低,贫液含水量越小,脱水效果越明显,干气露点越低。在较佳的实验条件下,气体露点降可达40 ℃以上,干气露点达-20 ℃以下。
(3) 与传统的有机溶剂相比,离子液体蒸气压低、不挥发,具有良好的热稳定性和化学稳定性,避免了三甘醇易氧化变质、发泡、挥发等问题。此外,离子液体结构和性质可调,可用于多种领域的气相脱水。
参考文献
[1] 陈曦, 邓道明, 万宇飞. CO2的三甘醇脱水分析[J]. 石油与天然气化工, 2014: 43(6): 585-589.
[2] GRYNIA E, CARROLL J J, GRIFFIN P J. Dehydration of acid gas prior to injection[J]. Proceedings of Annual Gas Processing Symposium, 2010: 177-185.
[3] 王倩. 天然气脱水技术现状综述[J]. 辽宁化工, 2015, 44(4): 432-434.
[4] 刘建勋, 宁雯宇. 天然气脱水方法综述[J]. 当代化工, 2015, 44(7): 1548-1549.
[5] 张良, 刘勇, 韩超. 三甘醇脱水装置影响因素定量分析[J]. 内蒙古石油化工, 2010, 36(8): 24-27.
[6] 李铁南. 锂电池生产露点控制[J]. 内江科技, 2010, 31(10): 113.
[7] 翁军利, 夏勇, 黄昌猛, 等. 靖边气田三甘醇脱水溶液净化方法研究[J]. 石油与天然气化工, 2017, 46(4): 16-21.
[8] 颜筱函, 李柏成. 基于粒子群算法的天然气三甘醇脱水工艺参数优化研究[J]. 石油与天然气化工, 2017, 46(3): 22-26.
[9] 陈赓良. 天然气三甘醇脱水工艺的技术进展[J]. 石油与天然气化工, 2015, 44(6): 1-9.
[10] 贺三, 刘阳, 樊林华, 等. DRIZO脱水工艺模拟分析[J]. 天然气与石油, 2016, 34(1): 44-48.
[11] 李旭成, 郑小林, 肖军, 等. 三甘醇脱水装置运行常见问题分析及处理对策[J]. 石油与天然气化工, 2015, 44(5): 17-20, 27.
[12] 丁玲, 蒋洪. 煤层气三甘醇脱水优化设计[J]. 石油与天然气化工, 2015, 44(5): 28-33.
[13] 李林. 常用气体脱水干燥工艺介绍及应用[J]. 化工技术与开发, 2013(7): 38-41.
[14] 蒋伟燕, 余文轴. 离子液体的分类、合成及应用[J]. 金属材料与冶金工程, 2008, 36(4): 51-54.
[15] WELTON T. Room-temperature ionic liquids. Solvents for synthesis and catalysis[J]. Chemical Reviews, 1999, 99(8): 2071-2084.
[16] ENDRES F, EL ABEDIN S Z. Air and water stable ionic liquids in physical chemistry[J]. Physical Chemistry Chemical Physics, 2006, 8(18): 2101-2116.
[17] FREEMANTLE M. An introduction to ionic liquids[M]. Cambrigde: Royal Society of Chemistry, 2010.
[18] WALKER A J, BRUCE N C. Cofactor-dependent enzyme catalysis in functionalized ionic solvents[J]. Chemical Communications, 2004(22): 2570-2571.
[19] EARLE M J, ESPERANCA J M S S, GILEA M A, et al. The distillation and volatility of ionic liquids[J]. Nature, 2006, 439(7078): 831-834.
[20] CAO Y Y, SUN X F, CHEN Y, et al. Water sorption in amino acid ionic liquids: kinetic, mechanism, and correlations between hygroscopicity and solvatochromic parameters[J]. ACS Sustainable Chemistry & Engineering, 2013, 2(2): 138-148.
[21] SHIFLETT M B, DREW D W, CANTINI R A, et al. Carbon dioxide capture using ionic liquid 1-butyl-3-methylimidazolium acetate[J]. Energy & Fuels, 2010, 24(10): 5781-5789.
[22] POTDAR M K, MOHILE S S, Salunkhe M M. Coumarin syntheses via Pechmann condensation in Lewis acidic chloroaluminate ionic liquid[J]. Tetrahedron Letters, 2001, 42(52): 9285-9287.
[23] KANG M G, RYU K S, CHANG S H, et al. A new ionic liquid for a redox electrolyte of dyE-sensitized solar cells[J]. ETRI Journal, 2004, 26(6): 647-652.
[24] CAMMARATA L, KAZARIAN S G, SALTER P A, et al. Molecular states of water in room temperature ionic liquids[J]. Physical Chemistry Chemical Physics, 2001, 3(23): 5192-5200.
[25] ZHANG Q G, WANG N N, WANG S L, et al. Hydrogen bonding behaviors of binary systems containing the ionic liquid 1-butyl-3-methylimidazolium trifluoroacetate and water/methanol[J]. The Journal of Physical Chemistry B, 2011, 115(38): 11127-11136.
[26] 王晓静, 牟天成. 离子液体的吸水性研究进展[J]. 科学通报, 2015, 60(26): 2516-2524.

