腹部脂肪分布与结直肠息肉的相关性
叶骅骏,徐含烟,蒋学佩,何茜茜,黄智铭
(温州医科大学附属第一医院,浙江 温州 325015,1.消化内科;2.呼吸与危重症医学科)
肠息肉是指起源于肠黏膜,突出于肠腔的宽基底或带蒂的良性隆起性病变。肥胖已被证实能增加结直肠息肉的发生率[1-2]。人体内的脂肪组织可分为内脏脂肪组织(visceral adipose tissue,VAT)和皮下脂肪组织(subcutaneous adipose tissue,SAT)。过多的VAT会增加糖尿病、高血压、肿瘤等疾病的发生率和严重程度[3-5]。本研究通过对结直肠息肉患者和正常对照者进行回顾性分析,探讨腹部脂肪组织分布等因素与结直肠息肉发生的相关性,以期为结直肠息肉的病因研究和建立有效的预防控制措施提供依据。
1 资料和方法
1.1 一般资料 收集温州医科大学附属第一医院体检中心2014年7月-2015年10月期间进行体检且其体检项目包括腹部CT与结肠镜检查项目的876例患者的临床资料。病理学检查确诊为结直肠息肉的330例为息肉组,余546例结肠镜检查未见异常者为对照组。所有研究对象均排除结直肠癌、炎症性肠病、肠结核、幼年性息肉及家族性结肠腺瘤病。
腹部VAT与SAT面积测定方法[6-7]:采用多排螺旋CT(discovery CT750,美国GE公司),选取脐水平面腹部横断面,设定脂肪组织CT值范围为-250~-50 Hu,通过MATLAB2013软件计算,以腹壁肌肉内缘及脊柱前缘为分界线。
1.2 方法 收集对照组与息肉组的临床资料,主要内容包括性别、年龄、体质量指数(body mass index,BMI)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、总脂肪组织(total adipose tissue,TAT)、VAT、SAT、内脏脂肪比率(VAT/TAT)、病理类型、息肉数量、息肉大小等临床数据。
1.3 统计学处理方法 应用SPSS21.0统计学软件进行统计学分析。计数资料以百分数表示,2组间比较采用χ2检验;正态分布计量资料以±s表示,2组比较采用t检验,多组比较采用单因素方差分析。应用非条件logistic回归分析独立危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 息肉组年龄、男性比、TAT、VAT、VAT/TAT、BMI、TG、HDL-C均高于对照组,差异均有统计学意义(P<0.05),而SAT、TC、LDL-C差异无统计学意义(P>0.05),见表1。多因素logistic回归分析结果显示,年龄、男性、VAT为息肉发生事件的危险因素(P<0.05),见表2。根据VAT结果,通过四等分离散化方法对患者进行分级,分为1级(≤60.32 cm2)、2级(60.33~99.41 cm2)、3级(99.42~143.11 cm2)、4级(≥143.12 cm2)并计算OR值及95%CI,以1级为基准,2级的OR(95%CI)为1.477(0.927~2.354),但差异无统计学意义(P>0.05),3级和4级的OR(95%CI)分别为1.666(1.038~2.674)与2.074(1.289~3.337),差异均有统计学意义(P<0.05)。
表1 对照组与息肉组的相关因素比较( ±s)

表1 对照组与息肉组的相关因素比较( ±s)
与对照组比:aP<0.05,bP<0.01
因素 对照组(n=546) 息肉组(n=330)年龄(岁) 44.60±10.00 49.51±10.00b男性[ n(%)] 331(60.1) 251(76.1)b TAT(cm2) 243.70±95.30 272.00±93.50b SAT(cm2) 147.60±60.30 154.00±57.30 VAT(cm2) 96.10±52.30 118.00±55.60b VAT/TAT(%) 38.20±11.90 42.60±11.20b BMI(kg/m2) 23.70± 3.40 24.60± 3.30b TC(mmol/L) 5.24± 1.27 5.39± 0.98 TG(mmol/L) 1.83± 1.89 2.15± 1.48b HDL-C(mmol/L) 1.33± 0.41 1.26± 0.36a LDL-C(mmol/L) 3.14± 0.97 3.19± 0.89
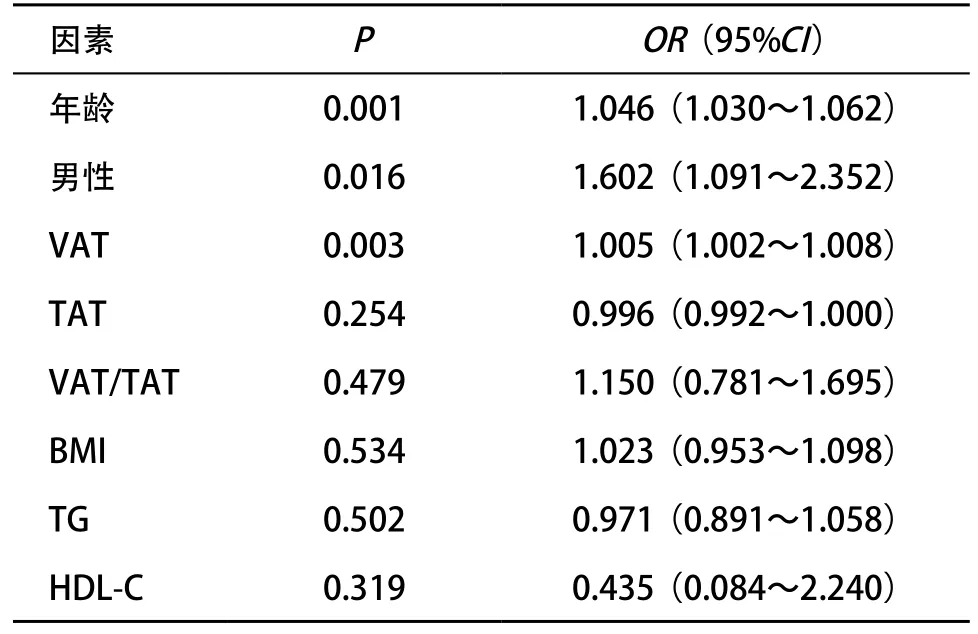
表2 多因素logistic回归分析结果
2.2 不同病理类型结直肠息肉患者的脂肪情况 根据活检病理结果对息肉组进行再分组,当同时有腺瘤性息肉和其他病理类型息肉入腺瘤性息肉组,幼年性息肉伴其他类息肉时入其他组,增生性息肉伴炎性息肉时入增生性息肉组。分组后得到炎性息肉75例,增生性息肉105例,腺瘤性息肉150例,3组间VAT、SAT、VAT/TAT差异均无统计学意义(P>0.05),见表3。
2.3 息肉大小及数量与脂肪的关系 根据内镜检查结果对息肉组进行再分组,对于有多颗息肉者,以最大的息肉为准,单个息肉≥1.0 cm为大息肉组(共21例),单个息肉<1.0 cm为小息肉组(共309例)。大息肉组与小息肉组在VAT、SAT、VAT/TAT上的差异均无统计学意义(P>0.05),见表3。根据息肉数量分为1个、2个、≥3个3组,3组间VAT、SAT、VAT/TAT差异均无统计学意义(P>0.05),见表3。
表3 不同息肉特点患者的脂肪情况比较( ±s)

表3 不同息肉特点患者的脂肪情况比较( ±s)
组别 n VAT(cm2) SAT(cm2) VAT/TAT(%)病理类型炎性息肉组 75 113.8±55.6 160.3±53.2 40.4±11.9增生性息肉组 105 122.8±54.8 159.3±63.3 43.2±11.0腺瘤性息肉组 150 116.8±56.3 147.0±54.3 43.3±11.0息肉大小大息肉 21 133.0±53.5 170.4±41.7 42.7±10.0小息肉 309 117.0±55.6 152.8±58.0 42.6±11.3息肉数量(个)1204 116.2±54.9 154.1±55.5 42.2±11.7247 116.9±55.1 152.5±64.5 43.0± 9.0≥3 79 123.4±58.0 154.4±58.1 43.4±11.3
2.4 不同性别结直肠息肉患者的脂肪情况 男性息肉组VAT、SAT、VAT/TAT均高于对照组,差异有统计学意义(P<0.01),女性息肉组与对照组VAT、SAT、
VAT/TAT差异均无统计学意义(P>0.05)。Logistic回归分析显示VAT、VAT/TAT与男性息肉发生存在统计学意义(P<0.05),而SAT与息肉发生无明显关联,见表4-5。
2.5 男性腹部脂肪分级与息肉的关系 根据VAT结果,通过四等分离散化方法对男性患者进行分级(分级标准见2.1),计算OR值及95%CI,结果显示,男性VAT 2级与4级患结直肠息肉的风险更高,且4级较2级风险更高。男性VAT/TAT分为1级(≤39.8%)、2级(39.9%~45.3%)、3级(45.4%~52.0%)、4级(≥52.1%),计算OR值及95%CI,结果显示,男性VAT/TAT 4级患结直肠息肉的风险更高。见表5。
表4 不同性别息肉组与对照组的脂肪情况( ±s)

表4 不同性别息肉组与对照组的脂肪情况( ±s)
与对照组比:bP<0.01
组别 n VAT(cm2) SAT(cm2) VAT/TAT(%)男性对照组 331 109.6±51.8 132.8±52.1 44.0±9.4息肉组 251 130.0±54.9b 145.1±51.4b 46.5±9.0b女性对照组 215 75.3±45.9 170.4±65.0 29.3±9.7息肉组 79 79.7±37.9 182.0±65.6 30.3±8.4
3 讨论

表5 结直肠息肉的危险因素分析
结直肠癌是最常见的恶性肿瘤之一,其发病率和病死率在我国分别居恶性肿瘤的第3位和第2位[8]。随着我国国民生活水平的提高和饮食习惯的改变,结直肠癌的发病率和病死率近年来也呈不断上升趋势,其中90%以上发现时已为中晚期,其早诊早治至关重要[9-10]。研究显示,80%以上的结直肠癌是由结直肠腺瘤性息肉转变而来[11]。根据Morson的组织学分类,结直肠息肉在病理上可分为腺瘤性息肉、增生性息肉、炎性息肉、幼年性息肉,其中增生息肉和炎性息肉又可转变为腺瘤性息肉[12]。因此,研究结直肠息肉发生的危险因素对于预防结直肠恶性肿瘤具有非常重要的意义。由于幼年性息肉、家族性息肉病等为先天基因相关性,目前亦无明显相关研究证据显示其与肥胖存在关联,而本研究旨在分析内脏脂肪导致的炎症状态对结直肠息肉形成的相关性,故排除先天遗传性息肉。
肥胖现已被证明是多种疾病的病理基础,研究显示肥胖人群患结直肠息肉的概率亦明显增加[1]。脂肪组织不仅是储能组织,还作为一种内分泌器官,可产生多种蛋白、激素与细胞因子。研究显示,脂肪组织,尤其是VAT,在全身炎症调节中具有关键的作用[13]。VAT与各种疾病的相关性要明显大于SAT,VAT可以释放脂肪因子如瘦素和脂联素,以及多种不同的细胞因子包括IL-10、IL-6、TNF-α,趋化因子如MCP-1或IL-8等,对机体的免疫系统和内分泌系统产生调控作用[14-18]。既往对脂肪组织的研究多采用腰围、腰臀比、BMI等间接指标,与人种、锻炼、遗传和检测方法有关,影响因素较多,不能准确反映脂肪总量和分布,而VAT才是致病的关键因素,故本研究采用螺旋CT测量可更为直接地反映脂肪总量及分布情况。
本研究息肉组平均年龄、男性比率均高于对照组,在危险因素的回归分析中也提示高龄、男性是结直肠息肉发生的危险因素(OR分别为1.046、1.602),与之前的文献[19-21]报道相符。男性患病率高于女性的原因,可能是男性更多地暴露在结直肠息肉的危险因素之下,如进食蛋白质类食物、抽烟等,研究已证实性别对炎症水平和代谢有非常大的影响[21];也有研究认为雌激素可以降低结直肠息肉的发病风险[22]。通过总体分析显示,VAT为结直肠息肉发生的危险因素,且脂肪水平越高则息肉发生可能性越高(第2、第3、第4级VAT的OR值分别为1.477、1.666、2.074),而BMI、SAT、血脂等因素与息肉发生均无明显相关性,证实了VAT与SAT在功能上存在较大的差别以及其在疾病发生中的重要作用。在国外有类似的研究报道,VAT水平升高可增加结直肠腺瘤与结直肠癌发生的风险而SAT则不会[3]。本研究发现,腺瘤性息肉、增生性息肉、炎性息肉患者的VAT均要高于对照组,但是在腺瘤性息肉、增生性息肉、炎性息肉3组之间进行的两两比较显示无明显差异,提示此3种息肉的发生机制均与脂肪组织代谢相关,脂肪组织相关细胞因子可能作用于结直肠息肉发生的各个阶段,研究证实,VAT比SAT在合成代谢上更为活跃并产生可导致炎症、增生、胰岛素抵抗的细胞因子,从而产生有利于息肉或肿瘤发生的内环境[23-24]。对于脂肪组织与息肉大小及个数之间的关系,本研究显示无明显统计学差异,息肉大小及数量代表息肉疾病进展的不同程度,而脂肪组织代谢可能对于息肉发生的启动有重要作用,而与息肉的疾病进展及严重程度无密切关系。本研究还发现,男性组中结直肠息肉患者的VAT、VAT/TAT要明显高于对照组且与息肉发生密切相关,而女性组的结果显示息肉发生与脂肪组织不存在明显相关性,男性在脂肪总量上亦要明显大于女性。男性人群脂肪组织多在腹部位置堆积,过去称为腹型肥胖,而女性人群的脂肪组织多在大腿和臀部堆积,称为周围性肥胖,男性以VAT为主,而女性以SAT为主,这使得男性人群的VAT要较女性人群的VAT相对要多,这在之前可能部分解释了男性结直肠息肉发病率要高于女性的原因。但本研究排除了SAT因素后,发现女性人群的结直肠息肉的患病率与VAT无明显相关性,提示男性与女性在息肉的发生机制上可能存在着差异,男性的息肉发生过程中脂肪组织代谢的作用要明显大于女性,其机制可能是由男女不同性别在性激素、细胞因子水平上的差异造成,从而引起男性患结直肠息肉及肿瘤的概率明显大于女性。在对男性患者的VAT及VAT/TAT分组后显示,随着VAT总量水平的升高,其息肉发生的可能性也明显增加(第2、3、4级VAT的OR值分别为1.781、1.350、2.544);对于脂肪分布异常造成的腹型肥胖患者的息肉发生可能性也要明显增大(VAT/TAT≥52.1%时OR值为2.103)。
结直肠息肉的发病机制复杂,在多种因素影响下,通过多病因、分阶段连续作用形成,从正常肠上皮依次演变为增生性改变、早期腺瘤、中期腺瘤、晚期腺瘤、癌的过程已较为清晰,一般需要10年以上[25]。在漫长的演变过程中,各种致病因子可能单独或协同作用于不同阶段,从而最终引起癌变。本研究显示男性高VAT和高VAT/TAT可能是一主要的始发危险因素,但其发生机制仍有待更深入的研究。对于肥胖男性,尤其是腹型肥胖男性,应建议行内镜检查。在早发现、早处理结直肠息肉的同时,更应该注重对健康人群的宣教工作,注意饮食控制,加强锻炼,以减少结直肠息肉的发生。
[1] COMSTOCK S S, HORTOS K, KOVAN B, et al. Adipokines and obesity are associated with colorectal polyps in adult males: a cross-sectional study[J]. PLoS One, 2014, 9(1): e85939.
[2] LEE J Y, KWAK S M, MYUNG S K, et al. Obesity and colorectal adenomatous polyps: a cross-sectional study in Korean adults[J]. Obesity (Silver Spring), 2014, 22(2): 518-525.
[3] KIMURA Y, MATSUMOTO H, OOSAWA M, et al. Relationship between visceral fat and development of colorectal neoplasms using computed tomographic colonography and adipocytokine levels[J]. Nihon Shokakibyo Gakkai Zasshi,2014, 111(11): 2121-2130.
[4] MATHIEU P, POIRIER P, PIBAROT P, et al. Visceral obesity: the link among inf l ammation, hypertension, and cardiovascular disease[J]. Hypertension, 2009, 53(4): 577-584.
[5] SAMARAS K, BOTELHO N K, CHISHOLM D J, et al.Subcutaneous and visceral adipose tissue gene expression of serum adipokines that predict type 2 diabetes[J]. Obesity(Silver Spring), 2010, 18(5): 884-889.
[6] SEKINE K, NAGATA N, SAKAMOTO K, et al. Abdominal visceral fat accumulation measured by computed tomography associated with an increased risk of gallstone disease[J]. J Gastroenterol Hepatol, 2015, 30(8): 1325-1331.
[7] GOODPASTER B H. Measuring body fat distribution and content in humans[J]. Curr Opin Clin Nutr Metab Care,2002, 5(5): 481-487.
[8] 李景南, 赵莉, 郑威扬, 等. 结肠癌近20年临床特点的变迁分析[J]. 中华内科杂志, 2010, 49(3): 226-229.
[9] 苗大壮, 刘正, 王锡山. 代谢异常对结直肠癌发病的影响[J]. 中华消化外科杂志, 2014, 13(12): 995-998.
[10] 房静远. 预防是控制结直肠癌的关键[J]. 中华消化杂志,2015, 35(3): 145-147.
[11] GUARINOS C, SANCHEZ-FORTUN C, RODRIGUEZSOLER M, et al. Serrated polyposis syndrome: molecular,pathological and clinical aspects[J]. World J Gastroenterol,2012, 18(20): 2452-2461.
[12] KANG H W, KIM D, KIM H J, et al. Visceral obesity and insulin resistance as risk factors for colorectal adenoma: a cross-sectional, case-control study[J]. Am J Gastroenterol,2010, 105(1): 178-187.
[13] LYON C J, LAW R E, HSUEH W A. Minireview: adiposity,inflammation, and atherogenesis[J]. Endocrinology, 2003,144(6): 2195-2200.
[14] JUGE-AUBRY C E, HENRICHOT E, MEIER C A. Adipose tissue: a regulator of inf l ammation[J]. Best Pract Res Clin Endocrinol Metab, 2005, 19(4): 547-566.
[15] BATRA A, PIETSCH J, FEDKE I, et al. Leptin-dependent toll-like receptor expression and responsiveness in preadipocytes and adipocytes[J]. Am J Pathol, 2007, 170(6): 1931-1941.
[16] NEUMEIER M, WEIGERT J, SCHAFFLER A, et al. Different effects of adiponectin isoforms in human monocytic cells[J]. J Leukoc Biol, 2006, 79(4): 803-808.
[17] LUMENG C N, DEYOUNG S M, BODZIN J L, et al. Increased inflammatory properties of adipose tissue macrophages recruited during diet-induced obesity[J]. Diabetes,2007, 56(1): 16-23.
[18] MANTOVANI A, SICA A, SOZZANI S, et al. The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends Immunol, 2004, 25(12): 677-686.
[19] GRAHN S W, VARMA M G. Factors that increase risk of colon polyps[J]. Clin Colon Rectal Surg, 2008, 21(4): 247-255.
[20] LEUNG W K, HO K Y, KIM W H, et al. Colorectal neoplasia in Asia: a multicenter colonoscopy survey in symptomatic patients[J]. Gastrointest Endosc, 2006, 64(5): 751-759.
[21] MACOTELA Y, BOUCHER J, TRAN T T, et al. Sex and depot differences in adipocyte insulin sensitivity and glucose metabolism[J]. Diabetes, 2009, 58(4): 803-812.
[22] ROSSOUW J E, ANDERSON G L, PRENTICE R L, et al. Risks and benef i ts of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial[J]. JAMA,2002, 288(3): 321-333.
[23] DONOHOE C L, DOYLE S L, REYNOLDS J V. Visceral adiposity, insulin resistance and cancer risk[J]. Diabetol Metab Syndr, 2011, 3: 12.
[24] PARK J, EUHUS D M, SCHERER P E. Paracrine and endocrine effects of adipose tissue on cancer development and progression[J]. Endocr Rev, 2011, 32(4): 550-570.
[25] ZAUBER A G, WINAWER S J, O’BRIEN M J, et al. Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths[J]. N Engl J Med, 2012, 366(8): 687-696.

