EB病毒LMP1 C端重组蛋白多克隆抗体的制备和鉴定
毛珊珊,王路得,周萌,吕开绩,朱进顺,Kamara Saidu,叶晓鲜,张丽芳
(温州医科大学 分子病毒与免疫研究所 病原生物与免疫学系,浙江 温州 325035)
EB病毒(Epstein-Barr virus,EBV)属于人类γ疱疹病毒科,广泛存在于人群中,且主要以潜伏感染的形式存在。EBV感染与某些肿瘤的发生和发展密切相关,如伯基特淋巴瘤(Burkitt’s lymphoma,BL)、霍奇金病(Hodgkin’s lymphoma,HL)、鼻咽癌(Nasopharyngeal carcinoma,NPC)等[1],且与某些自身免疫性疾病的发病也密切相关,如系统性红斑狼疮(systemic lupus erythematosus,SLE)[2]。EBV在潜伏感染的过程中表达3种潜伏膜蛋白(latent membrane protein,LMP),包括LMP1、LMP2A和LMP2B。其中,LMP1为66 kDa的跨膜蛋白,是由386个氨基酸组成的功能蛋白,在细胞膜上可形成多次跨膜,其N端的1~23和C端的187~386均游离于胞浆区,具有生物学意义[3]。EBV LMP1的N端在维持B细胞激活、转化及免疫调节上起作用,而胞
浆区的187~386段,即EBV LMP1 C端,是LMP1的功能区域,在EBV诱导细胞发生转化的过程中发挥着重要作用。本研究选取了C端的200个氨基酸(187~386)作为研究对象,通过原核表达的方式制备了EBV LMP1 C端重组蛋白及其兔多克隆抗体,并检验其生物学特性。
1 材料和方法
1.1 材料E.coliBL21(DE3)感受态细菌购自美国Invitrogen公司;鼻咽癌细胞株C666-1、CNE-2Z、人黑色素瘤细胞株A375均由本实验室保存;1 kb DNA marker、DL2000 DNA marker、限制性内切酶NdeI和XhoI购自美国NEB公司;镍螯合亲和层析胶(Ni-NTA Agarose)购自德国Qiagen公司;异丙基硫代-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)购自上海杰瑞生物有限公司;His-tag单克隆鼠源抗体、HRP Goat anti-Mouse IgG(H+L)抗体、HRP Goat anti-Rabbit IgG(H+L)抗体、ECL化学发光液均购自杭州联科生物技术股份有限公司。
1.2 方法
1.2.1 pET21a(+)/EBV LMP1 C端重组质粒构建及测序分析:对LMP1 C端进行密码子优化,送杭州擎科梓熙生物公司全基因合成,将公司合成的LMP1 C端基因构建到pET21a(+)载体,并转入E.coliBL21(DE3)感受态细菌中,挑取单个的菌落接种到含有氨苄青霉素的LB培养基中,提取的质粒进行酶切和测序鉴定。
1.2.2 pET21a(+)/EBV LMP1 C端重组蛋白表达、纯化及鉴定:将测序正确的阳性质粒转化E.coliBL21(DE3)感受态细菌中,接种于LB液体培养基中,37 ℃,250 r/min培养至菌液OD600=0.6~0.8;加入IPTG至终浓度为1.0 mmol/L,250 r/min,37 ℃恒温振荡培养6 h;利用高速离心机收集菌液;PBS溶解后超声裂解细菌,并12000 r/min离心10 min,收集上清;经镍螯合亲和层析胶纯化重组蛋白,收集得到LMP1 C端重组蛋白;经SDS-PAGE分析;用His-Tag mAb为一抗,HRP Goat anti-Mouse IgG(H+L)为二抗,进行Western blot分析和鉴定。
1.2.3 EBV LMP1 C端兔多克隆抗体的制备:取4只白兔随机分为2组,用于免疫EBV LMP1 C端蛋白和PBS;免疫蛋白前,对大耳白兔于耳缘静脉采血,将样品作为0周对照组;以500 μg/只的量于第1、第3、第5周依次进行背部皮下多点注射;初次免疫EBV LMP1 C端重组蛋白与完全弗氏佐剂以1∶1(V∶V)的比例混合乳化,第2、第3次免疫时换为不完全弗氏佐剂,并在第2、第4、第6周耳缘静脉取血;第8周进行心脏取血,37 ℃水浴1 h后于预冷的超速离心机中,4 ℃,4000 r/min离心20 min,收集上层血清,低温保存备用。
1.2.4 EBV LMP1 C端兔多克隆抗体与重组蛋白结合的特异性检测:LMP1 C端蛋白经SDS-PAGE后转膜,用一抗稀释液以1∶5000稀释兔多克隆抗体,HRP标
记的山羊抗兔二抗进行免疫印迹反应,ECL显色。
1.2.5 EBV LMP1 C端兔多克隆抗体反应及效价检测:用包被缓冲液稀释LMP1 C端蛋白,以终浓度10 μg/mL包被ELISA板,PBS免疫血清作为对照组;0.3 g/mL脱脂牛奶封闭;0、2、4、6、8周兔血清作为一抗;1∶10000稀释的HRP Goat Anti-Rabbit IgG(H+L)为二抗;TMB显色,H2SO4终止;酶标仪读
取450~630 nm处吸光值读数。用ELISA方法检测
免疫8周后血清抗体效价,将8周血清分别倍比稀为1∶40、1∶160、1∶640、1∶2560、1∶10240、1∶40960、1∶163840、1∶655360,所有血清标本均重复3孔,读取450~630 nm处吸光值读数。
1.2.6 EBV LMP1 C端兔多克隆抗体特异性识别天然EBV LMP1蛋白:将C666-1、CNE-2Z、A375细胞以104个/孔接种于细胞爬片上,置于4%多聚甲醛37 ℃固定10 min;0.3% triton x-10037 ℃孵育10 min;PBST洗3次,置于摇床上清洗,每次3 min;用5%山羊血清,置于37 ℃封闭90 min。取出6孔板,加入PBST,每孔2 mL,于摇床上清洗3 min;加入兔抗EBV C端蛋白多克隆抗体(1∶5000稀释),4 ℃孵育过夜;PBST洗3次;用FITC标记的羊抗兔二抗IgG(H+L)(1∶2000),避光37 ℃孵育1 h;PBST洗3次;避光加入RNA酶(1∶100)和PI(1∶1000)避光染色5 min;避光PBST洗3次;显微镜下观察拍照。
2 结果
2.1 pET21a(+)/EBV LMP1 C端重组质粒的鉴定
用NdeI和XhoI限制性内切酶对重组质粒pET21a(+)/EBV LMP1 C端进行酶切,得到一条约600 bp的条带(见图1);选取阳性菌株送公司测序分析,经Blast比对,重组序列与目的片段完全一致。
2.2 pET21a(+)/EBV LMP1 C端重组质粒的原核表达、纯化及鉴定 培养含有pET21a(+)/EBV LMP1 C端重组质粒的BL21(DE3)大肠杆菌,收集加入和未加入IPTG诱导表达的样品及纯化后的蛋白样品进行SDS-PAGE电泳分析,在27 kDa处出现单一的蛋白条带(见图2A)。His-Tag mAb抗为一抗(1∶10000)进行Western blot分析,在27 kDa处可见阳性反应条带(见图2B)。
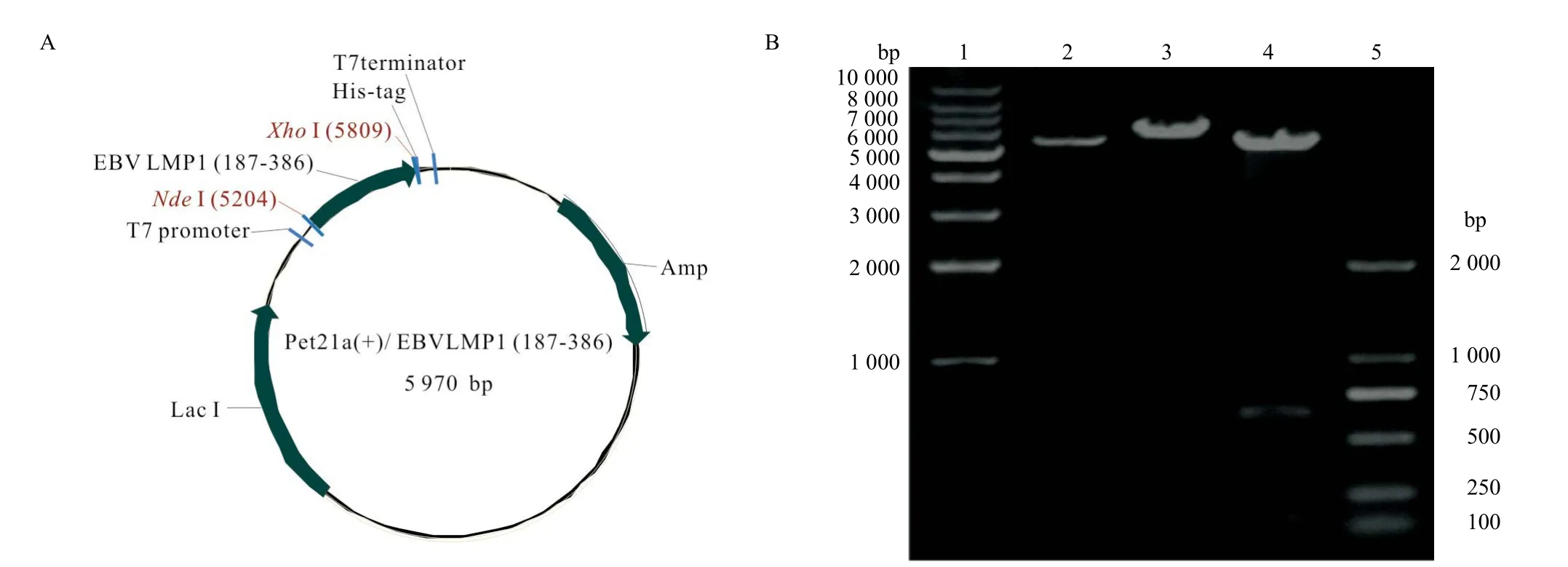
1:1 kb DNA marker;2:pET21(+);3:pET21a(+)/EBV LMP1 C端+Nde I;4:pET21a(+)/EBV LMP1 C端+Nde I+Xho I;5:DL 2000 DNA marker

图2 EBV LMP1 C端蛋白表达及纯化的SDS-PAGE电泳(A)和Western blot分析(B)
2.3 EBV LMP1 C端特异性兔多克隆抗体反应及效价 采用ELISA方法对以重组蛋白LMP1 C端为抗原得到的兔血清抗体进行检测。重组蛋白包被酶标板,0、2、4、6、8周兔多克隆抗体作为一抗,结果显示,LMP1 C端重组蛋白免疫的白兔在第2周开始产生特异性抗体,至第8周达到高峰(见图3A)。取8周时血清做抗体稀释滴度检测,结果显示,LMP1 C端兔多克隆抗体的效价可达1∶40000(见图3B)。
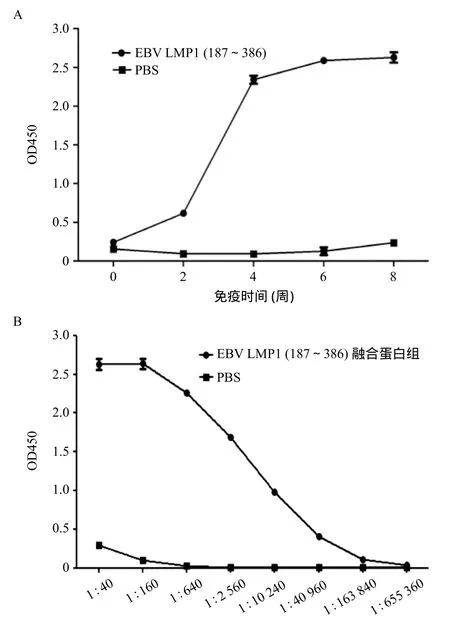
图3 EBV LMP1 C端重组蛋白免疫兔血清抗体反应(A)及效价分析(B)
2.4 EBV LMP1 C端兔多克隆抗体特异性结合重组蛋白的检测 利用Western blot方法对获得的兔多克隆抗体与LMP1 C端蛋白结合和识别的特异性进行检测分析,以第8周兔多克隆抗体为一抗(1∶5000),在相对分子质量27 kDa处可见特异性阳性条带(见图4)。
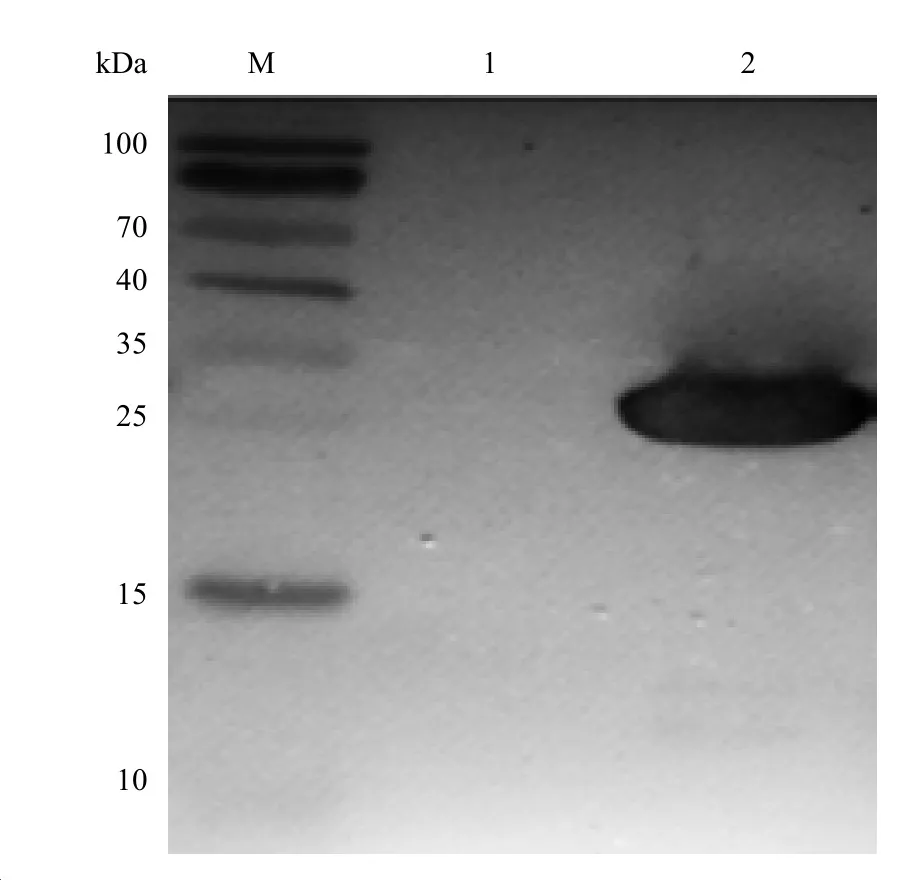
图4 兔血清EBV LMP1 C端Western blot分析
2.5 EBV LMP1 C端兔多克隆抗体特异性识别天然EBV LMP1蛋白 选择EBV LMP1表达阳性的鼻咽癌细胞C666-1、CNE-2Z细胞株作为实验组,同时选取LMP1表达阴性的人黑色素瘤细胞株A375作为对照组,用以检测EBV LMP1 C端蛋白多克隆抗体与鼻咽癌肿瘤细胞中天然表达的LMP1特异性识别和结合的能力。结果显示,EBV LMP1 C端多克隆抗体能够在C666-1和CNE-2Z的胞浆中,与LMP1特异性结合,表现为数个团块状绿色荧光,而A375细胞中未见明显的绿色荧光(见图5)。结果表明,EBV LMP1 C端蛋白兔多克隆抗体能够特异性识别细胞中天然表达的LMP1蛋白。
3 讨论
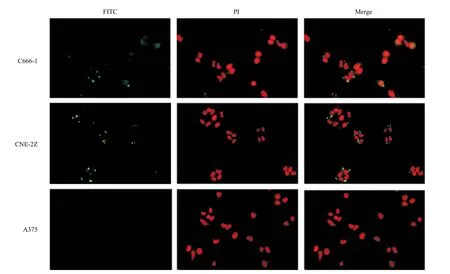
图5 LMP1 C端兔血清多克隆抗体特异性免疫荧光鉴定(×400)
EBV LMP1 C端是游离于胞浆区的200个氨基酸,含有3个功能结构域,即C末端活化区域(C-termina1 activation region,CTAR)1、CTAR2和CTAR3,这3个结构域提供了信号分子对接蛋白的结合位点,如TNFR相关因子(TNFR-associated factors,TRAFs)、TNFR相关死亡结构域(TNFR-associated death domain,TRADD)、受体相互作用蛋白激酶(receptor interacting protein kinase,RIP)和BS69等,通过NF-κB、p38-MAPK、PI3-K/Akt、ERKMAPK和JAK/STAT等信号通路转导细胞信号[4-7]。从而产生促进细胞增殖、抑制细胞凋亡、增强细胞迁移等多种生物学作用[8-9]。如C端功能区的CTRA1和CTAR2可直接与TNFRs蛋白或TRADD结合,从而激活NF-κB的活性,促进细胞增生[10-11];CTAR3通过募集JAK3,进而活化STAT3[12]。因此,EBV LMP1 C端的187~386氨基酸序列在EBV诱导细胞转化和癌变过程中发挥重要作用。
通过原核表达制备靶蛋白,是研究靶蛋白生物学作用的重要途径之一。目前研究表明,EBV LMP1可通过原核表达制备重组蛋白,对其生物学功能进行研究,用于原核表达的载体主要包括pET32a载体和PGEM-T载体[13-15],但这些载体表达的融合蛋白携带有载体本身蛋白,而载体蛋白对实验结果会产生一定的干扰作用。为此,本研究设计了起始密码子后的第1个密码子即为目的蛋白翻译的起始密码子,利用pET21a载体系统获得的蛋白即为全长目的蛋白,即LMP1 C端蛋白,从而避免了载体成分对实验结果的影响。经过免疫日本大耳白兔制备的抗体具有效价高的特点,利用Western blot和免疫荧光分析,该蛋白可特异性识别EBV LMP1蛋白,表明本研究制备的EBV LMP1 C末端蛋白具有较强的免疫原性和抗原性。
目前,商业化的EBV LMP1单克隆抗体主要有下列几种,即能识别位于LMP1 C端的多个抗原表位的单克隆抗体混合而成的抗体(CS1、CS2、CS3、CS4),可识别20种地理位置上不同的EBV分离株(CS 1~4)及可识别EBV LMP1 C末端Asp293-Asp312位点的单克隆抗体(D24-G)。但上述单克隆抗体仍然有一些问题存在,如针对的抗原表位有限且成本昂贵。多克隆抗体则由于识别谱广,制备简单方便,且经济实惠,在免疫学检测及实验中具有较为广泛的应用前景。本研究通过LMP1 C端蛋白制备的兔多克隆抗体,可特异性识别LMP1的C末端,且效价高,特异性强,可为EBV LMP1的基础研究和临床应用提供依据。
[1] RAAB-TRAUB N. Epstein-Barr virus in the pathogenesis of NPC[J]. Semin Cancer Biol, 2002, 12(6): 431-441.
[2] MIDDELDORP J M, PEGTEL D M. Multiple roles of LMP1 in Epstein Barr virus induced immune escape[J]. Semin Cancer Biol, 2008, 18(6): 388-396.
[3] HENNESSY K, FENNEWAID S, HUMME I M, et al. A membrane protein encoded by Epstein-Barr virus in latent growth-transforming infection[J] . Proc Natl Acad Sci U S A, 1984, 81(22): 7207-7211.
[4] LI H P, CHANG Y S. Epstein-Barr virus latent membrane protein 1: structure and functions[J]. J Biomed Sci, 2003, 10(5): 490-504.
[5] MORRIS M A, DAWSON C W, YOUNG L S. Role of the Epstein-Barr virus-encoded latent membrane protein-1,LMP1, in the pathogenesis of nasopharyngeal carcinoma[J].Future Oncol, 2009, 5(6): 811-825
[6] TSAO S W, TRAMOUTANIS G, DAWSON C W, et aI. The signif i cance of LMP1 expression in nasopharyngeal carcinoma[J]. Semin Cancer Biol, 2002, 12(6): 473-487.
[7] LEE D Y, SUGDEN B. The latent membrane protein 1 oncogene modif i es B-cell physiology by regulating autophagy[J].Oncogene, 2008, 27(20): 2833-2842.
[8] WANG D, LIEBOWITZ E, KIEFF E. An EBV membrane protein expressed in immortalized lymphocytes transforms established rodent cells[J]. Cell, 1985, 43(3 Pt 2): 831-840.
[9] SHAIR K H, SCHNEGG C I, RAAB-TRAUB N. Epstein-Barr virus latent membrane protein-1 effects on junctional plakoglobin and induction of a cadherin switch[J]. Cancer Res, 2009, 69(14): 5734-5742.
[10] HUEN D S, HEDNERSON S A, CROOM-CARTER D, et al.Epstein-Barr virus latent membrane protein-1 (LMP1) mediates activation of NF-kappa B and cell surface phenotype via two effector regions in its carboxy-terminal cytoplasmic domain[J]. Oncogene, 1995, 10(3): 549-560.
[11] MOSIAIOS G, BIRKENBACH M, YAIAMANCHIII R,et al. The Epstein-Barr virus transforming protein LMP1 engages signaling proteins for the tumor necrosis factor receptor famiIy[J]. Cell, 1995, 80(3): 389-399.
[12] RUSSELL S M, TAYEBI N, NAKAJIMA H, et al. Mutation of Jak3 in patient wilh SClD: essential role of Jak3 in lymphoid development[J]. Science, 1999, 270(5237): 797-800.
[13] 余琳, 张雪雁, 李孜. E B病毒LMP 1-CTAR 2结构域的原核表达及蛋白质纯化[J]. 中国卫生检验杂志, 2010,20(7):1583-1585.
[14] 张雪雁, 杨英, 马桂璋. EB病毒LMP1蛋白CTAR23结构域的原核表达及纯化[J]. 热带医学杂志, 2004, 4(2): 117-121.
[15] 林勇平, 吴淑华, 杨英, 等. EBV-LMP1c DNA的克隆测序及原核表达质粒构建[J]. 热带医学杂志, 2002,2(4): 337-340.

