靶向高通量测序在非小细胞肺癌中的临床应用*
最新数据表明,肺癌是我国发病率和致死率最高的恶性肿瘤[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最为常见的组织学类型,占总体的80%~85%[2]。近些年,随着基因组学和转化医学的快速发展,人们对NSCLC的认识已经从组织水平深入到分子水平,越来越多的肿瘤驱动基因被逐渐发现。同时,基于各种驱动基因变异的靶向治疗在临床上表现出极大的抗肿瘤活性,为NSCLC的治疗开辟了一条新的道路。如应用表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)吉非替尼、厄洛替尼、阿法替尼、奥西替尼等治疗携带EGFR突变的NSCLC患者,克唑替尼治疗携带ALK融合基因、ROS1融合基因、MET扩增和14外显子跳跃突变的NSCLC患者,卡博替尼、凡德他尼治疗携带RET重排的患者。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中,建议对NSCLC患者进行至少8种与NSCLC个性化治疗方案高度相关的驱动基因并行检测,以确定最佳的治疗方案。
DNA高通量测序(next-generation sequencing,NGS)是一种大规模并行测序的技术,可用作检测多种DNA变异形式,包括点突变、小片段插入缺失、基因重排和拷贝数变异等。靶向高通量测序可以针对特定的基因区域进行准确高效的深度测序而筛选潜在药物靶点,给癌症患者提供更多的治疗选择和预后提示。本研究针对212例NSCLC样本中8种与NSCLC个性化治疗方案高度相关的点突变、小片段插入缺失、基因重排及拷贝数变异进行高通量测序,以分析不同类型基因变异与临床病理特征的关系,为临床医生的个体化诊疗提供参考。
1 材料与方法
1.1 研究对象
收集天津医科大学肿瘤医院于2016年6月至2017年8月212例NSCLC肿瘤患者。其中94例为手术样本、96例为穿刺病理样本、10例为胸腔积液样本、12例为石蜡包埋(FFPE)肿瘤样本。男性患者106例,女性患者106例,中位年龄为60(25~88)岁。所有病例均经病理确诊为肺癌,其中肺腺癌171例、肺鳞癌27例、其余14例。本研究获得了患者的书面知情同意书,并通过了天津医科大学肿瘤医院医学伦理委员会审查批准。
1.2 方法
1.2.1 取材 新鲜组织(手术样本/切检穿刺样本),胸腔积液样本和FFPE样本。使用DNA提取试剂盒QIAamp DNA Mini Kit(德国Qiagen公司)提取新鲜组织和胸腔积液样本DNA。使用DNA提取试剂盒QIAamp FFPE DNATissue Kit(德国Qiagen公司)提取FFPE样本DNA。使用朗克Lung CureTM8种基因试剂盒(广州燃石公司)构建高通量测序文库,对EGFR(突变、拷贝数)、KRAS(突变)、BRAF(突变)、ALK(突变、融合)、MET(突变、拷贝数)、ERBB2(突变、拷贝数)、ROS1(突变、融合)、RET(突变、融合)8种NCCN指南中明确与NSCLC个性化治疗高度相关的基因突变、重排、拷贝数的变异情况进行检测。使用300循环测序试剂(MiSeq Reagent Micro Kit v2,300 cycles),采用MiSeq测序仪(美国Illumina公司)进行测序。
1.2.2 生物信息学分析 使用序列比对软件BWA(版本0.7.10)将原始数据比对到人类参考基因组(hg19)。使用GATK 3.2、MuTect和VarScan进行序列本地比对优化和变异识别。使用VarScan fpfilter模块对变异进行过滤,过滤掉测序深度<100×的位点。根据ExAC、1000 Genomes、dbSNP、ESP6500SI-V2数据库,人群频率>0.1%的变异为胚系变异。使用ANNOVAR和SnpEff V3.6对变异位点进行注释。使用Tophat2和Factera
1.4.3 对基因融合进行分析。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。计量资料的比较采用t检验,计数资料的比较采用χ2检验或Fisher精确检验。所有比较均为双侧检验,P<0.05为差异具有统计学意义。
2 结果
2.1 数据质量评估和位点筛选
每个样本产生的总测序数据量约为125 640~1882 140读段,平均841 667读段。对于二代测序目标区域,平均中位测序深度913×。全组样本中,96.7%(205/212)的样本>80%目标测序区域的平均测序深度>200×。98.1%(208/212)的样本DNA插入片段长度≥170 bp。100%的样本Q30>80%。99.5%(211/212)的样本文库复杂度>25%,测序数据的可靠性高。经过生物信息分析,过滤掉非目标区突变、同义突变、胚系突变、低质量突变,最终得到215个高质量非同义突变用于后续分析。
2.2 基因变异在NSCLC患者中的分布
对212例NSCLC标本中8种基因的变异图谱进行分析(图1)。8种基因中,EGFR基因发生改变占比最高为52.8%,其次为KRAS(8.5%)ALK(8.0%)、ERBB2(6.1%)、MET(3.8%)、BRAF(1.4%)、RET(0.9%)、ROS1(0.9%),发现75%(159/212)的样品至少检出1个驱动基因变异,且驱动基因间呈现强烈互斥。
本研究对EGFR变异的类型及分布情况进行了分析,发现最常见的EGFR基因突变位点集中在EGFR基因的外显子19和21,分别占40%,18、20外显子及其他外显子的分布所占比例较少,分别占4%、9%和7%。EGFR存在多种突变类型,最常见的19外显子缺失、L858R突变分别占22.6%、22.2%。在所观察的样本中,EGFR 19外显子缺失亚型分析,发现存在13种突变亚型,最常见的是p.E746_A750del,约占60.4%,其余少见亚型占39.6%。
EGFR 19外显子缺失、L858R呈现出明显的互斥现象,而所有检测到的T790M突变都与上面两个突变位点伴随出现。除了T790M的伴随出现,还对19外显子缺失和L858R突变是否携带非EGFR T790M突变进行了比较。结果表明,存在19外显子缺失患者携带非EGFR T790M突变比例低于L858R突变患者携带非EGFR T790M突变的趋势(6.3%vs.21.3%,P=0.04),提示EGFR 19外显子缺失相较于L858R突变,可能致病程度更高。此外,15.2%(17/112)EGFR突变伴有EGFR扩增,携带EGFR扩增且EGFR突变率>40%的患者比例高于无EGFR扩增患者且EGFR突变率>40%的患者比例(82.4%vs.6.3%,P<0.01)。
212例患者中,ALK变异检出率为8.0%(17/212),存在3种变异类型,基因融合(包括EML4-ALK融合和其他罕见融合)、错义突变和移码突变。其中ALK融合在5.7%(12/212)NSCLC患者检出,75%(9/12)为经典EML4-ALK融合,经典融合中EML4(外显子6)-ALK(外显子20)融合出现最多(4/9);其次是EML4(外显子13)-ALK(外显子20)融合(2/9)。
212例患者中,检测到3.8%(8/212)的样本存在MET基因变异,包括3种类型:MET扩增、MET 14外显子跳跃突变、MET错义突变。其中MET 14外显子跳跃突变在1.4%(3/212)NSCLC患者中检出,MET扩增在0.5%(1/212)NSCLC患者中检出。
此外,8.5%(18/212)样本存在KRAS基因变异,其中83.3%(15/18)集中在12或13密码子。1.4%(3/212)样本存在BRAF基因变异,均为V600附近突变(p.N581D,p.K601E,p.D594A)。ERBB2变异在6.1%(13/212)的NSCLC患者检出,其中38.5%为20外显子插入,0.9%NSCLC患者检出ERBB2扩增。
2.3 基因变异与临床病理的关系
212例患者中206例有临床病理信息。观察常见驱动基因变异与年龄、性别、肿瘤位置(5例肿瘤原发为双侧的病例不纳入分析)、吸烟史、病理分型、临床分期、淋巴结转移(2例淋巴结转移状态未知的病例不纳入分析)、转移、治疗情况的关系(表1)。携带非KRAS突变患者的年龄显著较小[(59±9)岁vs.(63±8)岁,P=0.005],而携带KRAS G12X突变的患者年龄较大[(65±7)岁vs.(60±9)岁,P=0.055];携带ALK融合基因的患者平均年龄显著小于不携带此融合基因的患者[(55±10)岁vs.(61±9)岁,P=0.031]。在检测中,女性、不吸烟以及腺癌患者易发生EGFR特别是EGFR敏感突变(P<0.01,表2),女性患者中66.0%(68/103),非吸烟患者中64.1%(66/103)、腺癌患者中56.8%(96/169)携带EGFR敏感突变(表2)。与鳞癌相比,腺癌患者携带EGFR扩增的占比更高(腺癌vs.鳞癌为9.5%vs.0,P=0.013),并且Ⅱ、Ⅲ、Ⅳ期携带EGFR扩增的患者明显增加(Ⅰvs.Ⅱvs.Ⅲvs.Ⅳ为3.0%vs.15.4%vs.18.9%vs.9.0%,P=0.048),有淋巴结转移携带EGFR扩增的患者明显增加(13.8%vs.4.8%,P=0.027,表2)。男性,左侧肺癌,吸烟患者KRAS突变的发生率较高(P=0.009,P=0.048,P=0.037,表2)。初诊和复治患者的突变谱无明显差异。而对于本研究中的低频突变,BRAF、RET和ROS1基因变异和患者的临床病理关系见表3。

▶图1 8种基因的变异图谱

表1 驱动基因突变与临床病理的关系 例

表2 KRAS、ALK、EGFR基因突变与临床病理的关系
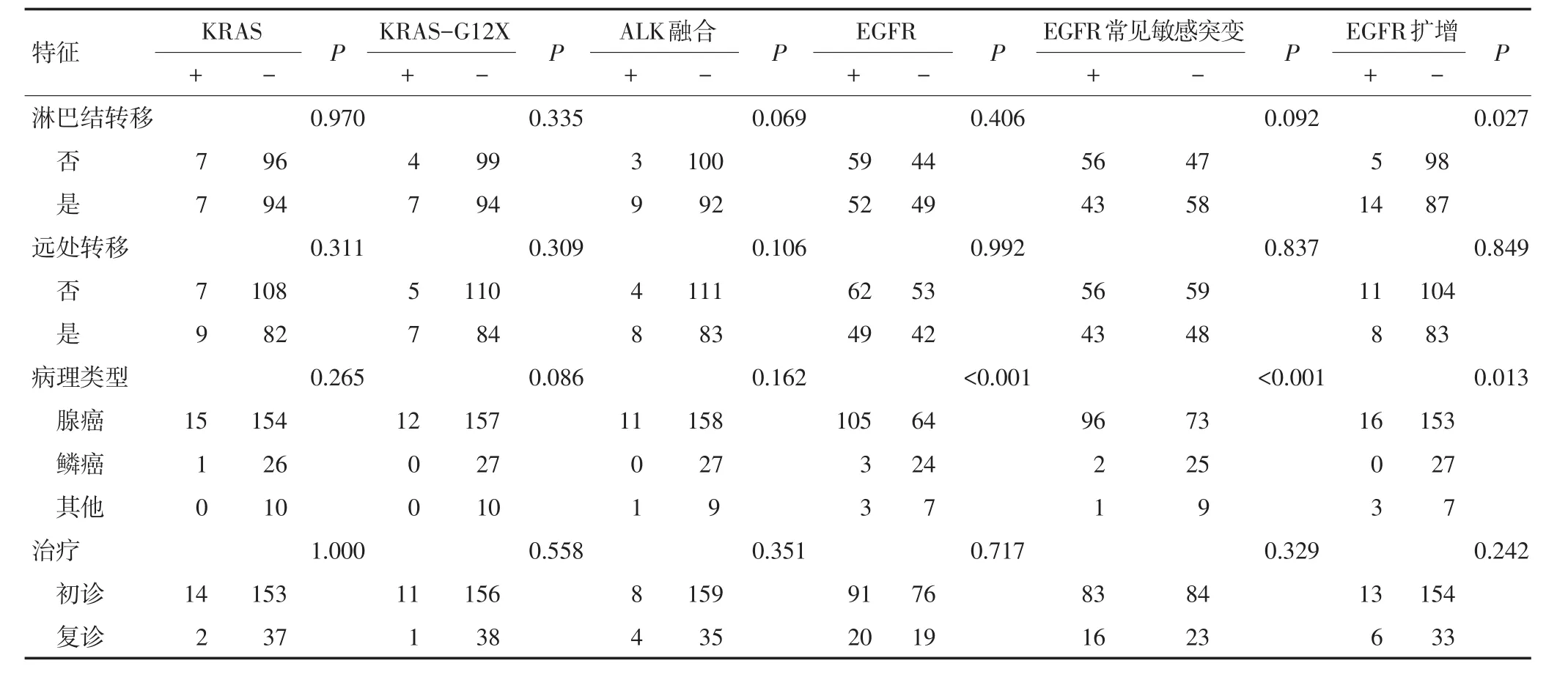
表2 KRAS、ALK、EGFR基因突变与临床病理的关系(续表2)

表3 携带低频基因变异患者的临床病理特征
3 讨论
随着高通量测序技术的进步,以基因检测为基础的临床诊疗在NSCLC治疗模式中日益广泛,是改善患者临床预后的最佳例证之一[3]。NCCN指南中明确指出须对8种与NSCLC个性化治疗高度相关的基因突变、重排、拷贝数的变异情况进行检测以确定晚期NSCLC最佳的治疗方案。一代测序即Sanger测序是当今基因检测的金标准,但其测序效率低、通量小、成本高,因此,准确、高通量及经济-效益比更高的基因检测方法对恶性肿瘤个体化精准治疗有重要意义。高通量测序可以同时对多种基因多种变异类型进行分析,并能定量检测基因突变率,为临床医师提供全面信息[4]。随着精准医疗的快速发展,越来越多的医疗机构可以提供小基因组合(panel)的高通量测序,检测数据的生物信息分析和变异解读相对容易快捷,患者经济负担小,并且短时间内即可获得针对性强的检测报告并制定下一步治疗计划。但和美国FDA批准的纪念斯隆凯特琳癌症研究中心(MSK)的癌症基因检测分析平台MSK-IMPACT和美国Foundation Medicine公司的FoundationOne CDx(F1CDx)高通量测序相比,小panel的高通量测序往往支持单一癌种的检测以指导治疗,不能揭示肿瘤发生发展的机制以及肿瘤突变负荷的评估。本研究中,对治疗指南中的8种基因进行高通量测序,观察在我国NSCLC患者中的变异情况。
EGFR是NSCLC最常见的突变基因,本研究的检测中EGFR基因变异发生率为52.8%,符合亚洲人群中EGFR变异频率。最常发生的EGFR基因突变位点为19外显子缺失、L858R突变,19外显子缺失亦存在多种亚型。和传统的方法相比,NGS检测EGFR基因变异类型更全面,可以提高EGFR19外显子突变的检出率,使更多的患者受益。除了常见的EGFR突变外,也观察到了EGFR少见突变,少见突变对EGFR-TKI有效率低于常见突变,但少见突变相关的临床随机数据相对较少,存在异质性。212例患者中,32例(15.1%)患者存在EGFR基因内共存改变。T790M突变是TKI最常见的获得性耐药机制,原发T790M突变率低,本研究检测到携带T790M突变均为继发性耐药的患者,无原发耐药患者。4例(1.9%)患者为T790M与EGFR19外显子缺失或L858R共存出现的复治患者,而19外显子缺失患者携带非EGFR T790M突变比例低于L858R突变患者携带非EGFR T790M突变比例的趋势,提示相较于L858R突变,19外显子缺失可能是致病程度更高的突变。
尽管EGFR存在TKI敏感位点,但TKI的耐药不可避免,EGFR 20外显子突变是TKI原发耐药的原因之一,突变率约2%,有效率10%,本研究阳性检出率为1.9%,和文献报道[5]相近;尽管20外显子突变会激活EGFR,但未增加激活的EGFR受体与TKI结合力;而20外显子A763_Y764insFQEA突变对TKI有效[5]。
本研究存在EGFR扩增的患者中,Ⅱ、Ⅲ、Ⅳ期携带EGFR扩增的患者明显增加,有文献报道,随着患者TNM分期的增高,EGFR扩增率呈增加的趋势[6],EGFR扩增可能与肿瘤进展相关[7]。本结果提示有淋巴结转移的患者中,携带EGFR扩增的患者占14%,是无淋巴结转移患者的3倍。有文献报道[7],有淋巴结转移的肺癌患者中,EGFR扩增率可高达90%,几乎是无淋巴结转移患者携带率的2倍,这意味着EGFR扩增可能与NSCLC的侵袭转移以及疾病进展有关。
突变丰度与靶向治疗效果密切相关,Li等[8]研究发现血液中EGFR突变丰度高,肺癌患者靶向治疗效果好,中位生存期更长。结果提示存在EGFR突变患者中,携带EGFR扩增患者且EGFR突变率>40%的患者明显多于不携带EGFR扩增患者且EGFR突变率>40%患者,这可能提示EGFR突变丰度高,且携带EGFR扩增患者容易出现临床分期较晚有淋巴结转移的临床特征。有研究[9]提示EGFR-TKI在肺癌辅助治疗中显示了较好的疗效,也就意味着EGFR-TKI在非晚期肺癌患者呈现出治疗疗效,而同时携带EGFR高丰度突变和EGFR扩增非晚期患者的靶向治疗疗效需要进一步观察。
ALK融合是肺癌重要的驱动基因,在检测中8.0%患者存在ALK基因变异,ALK融合的阳性检出率为5.7%,其中EML4-ALK是最常见的融合类型,占融合类型的75%。携带ALK突变,特别是携带ALK融合基因的患者平均年龄为55岁,显著小于不携带此融合基因的患者,这和文献报道相符[10]。12例ALK融合阳性的患者中,9例继续行ALK(D5F3)免疫组织化学方法的验证,结果表明9例(100%)结果阳性,也说明了高通量测序的ALK融合检出和免疫组织化学方法一致性很高,高通量测序的方法可以作为免疫组织化学ALK融合检测的备选手段。在结果中也可以看到,检测到3例ALK罕见融合类型(1例KLC1-ALK、1例TMEM17-ALK、1例LTBP1-ALK)约占1.4%,其中TMEM17-ALK和LTBP1-ALK为两例罕见融合尚未见报道,机制需进一步探索,但根据文献报道,一旦发现ALK融合,不论与其融合的配体是来自哪个基因,可能对ALK抑制剂敏感[11]。此外,有报道提示非EML4-ALK融合发生率很低,400例NSCLC只检测到3例阳性患者,发生率约为0.75%,可能由于样本例数的限制和人群的不同,本研究的非EML4-ALK融合阳性率相对高,并且由于文献中罕见ALK融合大部分为个案报道,尚需进一步研究[12]。
KRAS基因突变在吸烟男性中发生比例显著高于女性,和之前报道一致[13],此外,本研究KRAS基因突变的患者中,特别是KRAS-G12X位点突变的患者,左侧肺癌发生率较右侧高,提示肿瘤原发灶的位置可能与突变相关,但机制尚不明确,也可能受样本量的限制。在结直肠癌中发现,KRAS基因突变在原发部位为右半结肠癌的患者中发生率较高[14],也提示KRAS突变与肿瘤原发病灶位置具有一定的相关性。
欧美的研究结果显示,非鳞NSCLC患者由MET 14外显子跳跃引起的MET基因突变率为3%~4%[15-16]。而本研究结果显示,3.8%(8/212)样本存在MET基因变异,而MET 14外显子跳跃突变在1.4%(3/212)NSCLC患者检出,低于欧美国家。Liu等[17]研究结果提示,MET 14外显子跳跃突变仅在0.9%的中国肺腺癌患者中发生,Zheng等[18]研究结果提示,MET 14外显子跳跃突变在1.3%中国NSCLC患者中发生,均低于既往国外研究的结果。可能是由于种族差异,在我国NSCLC患者中MET 14外显子跳跃突变率低于欧美人群。
本研究检测到1.4%(3/212)样本存在BRAF变异。检测的肺癌患者中,BRAF突变均为非经典的V600E突变,为V600附近突变(p.N581D,p.K601E,p.D594A),提示非V600E突变在NSCLC中是重要的亚型之一。文献报道BRAF V600E是重要的驱动基因,其中约一半的黑色素瘤患者存在BRAF V600E突变。在NSCLC中,2%~4%患者存在BRAF突变,55%突变为V600E,35%为G469A,15%为D594G,其中携带V600E突变的NSCLC对达拉非尼和曲美替尼联合治疗有效[19],携带K601E的恶性黑色素瘤患者对曲美替尼有效[20],而N581用药效果尚不明确。
因此,使用高通量测序技术对8种与肺癌个性化治疗方案高度相关的基因进行测序,揭示了NSCLC患者的变异情况以及临床病理特征,为临床医生的个体化诊疗提供了参考。此外,NSCLC的基因检测从最初单基因检测发展到NCCN指南推荐的多基因检测,使NSCLC更加趋向细化诊断以及精准治疗。以多基因为基础的高通量测序为NSCLC的诊疗提供了更多的可能性。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]Davidson MR,Gazdar AF,Clarke BE.The pivotal role of pathology in themanagement of lungcancer[J].J Thorac Dis,2013,5(Suppl 5):S463-478.
[3]Sheikine Y,Kuo FC,Lindeman NI.Clinical and technical aspects of genomic diagnostics for precision oncology[J].J Clin Oncol,2017,35(9):929-933.
[4]McGinn S,Gut IG.DNA sequencing-spanning the generations[J].N Biotechnol,2013,30(4):366-372.
[5]Castellanos E,Feld E,Horn L.Driven by Mutations:The predictive Value of Mutation Subtype in EGFR-Mutated Non-Small Cell Lung cancer[J].J Thorac Oncol,2017,12(4):612-623.
[6]Jia XF,Li J,Zhao HB,et al.Correlation of EGFR gene amplification with invasion and metastasis of non-small cell lung cancer[J].Genet Mol Res,2015,14(3):11006-11012.
[7]Yatabe Y,Takahashi T,Mitsudomi T.Epidermal growth factor receptor gene amplification is acquired in association with tumor progression of EGFR-mutated lung cancer[J].Cancer Res,2008,68(7):2106-2111.
[8]Li X,Cai W,Yang G,et al.Comprehensive analysis of EGFR-Mutant Abundance and Its Effect on Efficacy of EGFR TKIs in Advanced NSCLC with EGFR mutations[J].J Thorac Oncol,2017,12(9):1388-1397.
[9]Zhong WZ,Wang Q,Mao WM,et al.Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA(N1-N2)EGFR-mutant NSCLC(ADJUVANT/CTONG1104):a randomised,open-label,phase 3 study[J].Lancet Oncol,2018,19(1):139-148.
[10]Shaw AT,Yeap BY,Mino-Kenudson M,et al.Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK[J].J Clin Oncol,2009,27(26):4247-4253.
[11]Jiang J,Wu X,Tong X,et al.GCC2-ALK as a targetable fusion in lung adenocarcinoma and its enduring clinical responses to ALK inhibitors[J].Lung Cancer,2018,115:5-11.
[12]Iyevleva AG,Raskin GA,Tiurin VI,et al.Novel ALK fusion partners in lung cancer[J].Cancer Lett,2015,362(1):116-121.
[13]Liu L,Liu J,Shao D,et al.Comprehensive genomic profiling of lung cancer using a validated panel to explore therapeutic targets in East Asian patients[J].Cancer Sci,2017,108(12):2487-2494.
[14]高静,孙志伟,李艳艳,等.中国结直肠癌患者966例中KRAS和BRAF基因突变分析[J].中华病理学杂志,2012,41(9):579-583.
[15]Frampton GM,Ali SM,Rosenzweig M,et al.Activation of MET via diverse exon 14 splicing alterations occurs in multiple tumor types and confers clinical sensitivity to MET inhibitors[J].Cancer Discov,2015,5(8):850-859.
[16]Paik PK,Drilon A,Fan PD,et al.Response to MET inhibitors in patients with stage IV lung adenocarcinomas harboring MET mutations causing exon 14 skipping[J].Cancer Discov,2015,5(8):842-849.
[17]Liu SY,Gou LY,Li AN,et al.The Unique characteristics of MET Exon 14 Mutation in Chinese patients with NSCLC[J].J Thorac Oncol,2016,11(9):1503-1510.
[18]Zheng D,Wang R,Ye T,et al.MET exon 14 skipping defines a unique molecular class of non-small cell lung cancer[J].Oncotarget,2016,7(27):41691-41702.
[19]Sereno M,Moreno V,Moreno RJ,et al.A significant response to sorafenib in a woman with advanced lung adenocarcinoma and a BRAF non-V600 mutation[J].Anticancer Drugs,2015,26(9):1004-1007.
[20]Bowyer SE,Rao AD,Lyle M,et al.Activity of trametinib in K601E and L597Q BRAF mutation-positive metastatic melanoma[J].Melanoma Res,2014,24(5):504-508.

