前列腺癌冷冻消融联合抗CTLA-4抗体增强小鼠肿瘤引流淋巴结免疫反应的实验研究*
杨伊 张浩楠 李凤娥 司同国
冷冻消融作为一种介入治疗手段,可作为局限性前列腺癌(prostate cancer,PCa)的一线治疗手段[1-2]。冷冻消融后,PCa坏死组织所释放的大量肿瘤相关抗原及细胞因子等引起树突状细胞活化,从而激活效应T细胞以发挥肿瘤免疫反应(anti-tumor immune response,ATIR),又称“冷冻免疫反应”[3]。调节性T细胞(regulator T cell,Treg)是一个具有免疫抑制功能的T细胞亚群,在肿瘤的免疫逃逸中发挥重要的作用[4-5]。细胞毒性T淋巴细胞抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)是Treg表面的一种免疫检查点[6],CTLA-4不仅可以通过与CD28竞争结合抗原提呈细胞表面的CD80(B7)阻断共刺激信号,产生免疫抑制作用,还能够传递抑制性信号,抑制细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的增殖与活化,进而抑制其抗肿瘤作用[6]。本研究旨在通过动物实验,探究冷冻消融联合抗CTLA-4抗体治疗对肿瘤引流淋巴结(tumor draining lymph nodes,TDLNs)中Treg和CTL免疫功能状态的改变,及其对小鼠总生存期(overall survival,OS)的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 小鼠PCa细胞(RM-1)株由复旦大学细胞库提供。清洁级纯种近交系C57BL/6(H-2Db/b)7~9周雄性小鼠100只购自中国医学科学院血液学研究所,体质量17~23 g,饲养于天津医科大学肿瘤医院SPF动物实验室。100只小鼠随机分为空白对照(A)组,冷冻消融治疗(B)组,冷冻消融联合抗CTLA-4抗体治疗(C)组,抗CTLA-4抗体治疗(D)组。本实验遵从动物实验基本管理条例和动物伦理学条例。
1.1.2 主要实验设备及试剂 氩氦冷冻消融系统购自美国Endocare公司,流式细胞仪购自美国BD公司,PBS缓冲液购自北京中杉公司,FBS胎牛血清购自美国Hyclone公司,红细胞裂解液购自上海哈灵公司,抗CTLA-4抗体购自美国Bioss公司,Fixation&Permeabilization Buffer购自美国eBioscience公司,抗CD4-PerCP、抗CD8-PE/Cy7、抗FOXP3-Alexa Flour 488、抗CD25-PE流式抗体及相应同型对照购自美国Biolegend公司,乳酸脱氢酶(LDH)杀伤实验试剂盒购自美国Promega公司。
1.2 方法
1.2.1 PCa小鼠模型建立 收集处于对数生长期的细胞,使用PBS溶液调整细胞浓度至1×107/mL,将100 μL RM-1细胞重悬液接种于小鼠右腹股沟皮下,每天观察肿瘤生长状态。
1.2.2 冷冻消融 待肿瘤生长直径为0.8~1.0 cm时,将小鼠固定在无菌操作台上,术区备皮、消毒、铺巾,采用10%水合氯醛(3.5 mL/kg)麻醉,在瘤旁切开约1.5 mm的切口,将直径2.0 mm的氩氦刀插入瘤体中心部位。A组未治疗。B组行2次冷冻消融治疗,每次先启动氩气,控制冷冻时间约30 s,冰球完全覆盖肿瘤,瘤体表面完全覆盖白色冻霜,中心约-115℃,再启动氦气,复温至10℃后,撤出氩氦刀,皮肤缝合,肌注庆大霉素(8万U/d)3天预防感染。C组方法同B组,并给予抗CTLA-4抗体(50 μg/只)腹腔注射。D组给予抗CTLA-4抗体(50 μg/只)腹腔注射。
1.2.3 标本采集 各组分别于治疗前及治疗后7、14、21天四个时间点,取各组5只小鼠,测量肿瘤大小并采集标本。高浓度CO2处死小鼠,瘤旁皮肤消毒并切开,手术钳行钝性分离,于股动静脉鞘上方解剖分离TDLNs标本,配合PBS冲洗液于滤网内研磨均匀,加入红细胞裂解液混匀,使用10%FBS培养液配置单细胞悬液。生存起点定义为小鼠接受治疗的时间点,生存终点定义为小鼠治疗后的自然死亡时间。记录各组最后5只小鼠OS。
1.2.4 流式细胞术检测 取100 μL TDLNs细胞悬液加入流式管,分别在实验组的标本管中,以抗CD4-PerCP、抗CD8-PE/Cy7流式抗体标记CTL,以抗CD4-PerCP、抗CD25-PE流式抗体分选Treg后使用Fixation&Permeabilization Buffer固定破膜处理30 min,以抗FOXP3-Alexa Flour 488流式抗体标记Treg;同时分别设置相应的同型对照管。分别使用PBS配制200 μL细胞重悬液,上机进行检测。
1.2.5 LDH细胞杀伤检测 取TDLNs细胞悬液中分离出CD8+T细胞作为效应细胞,RM-1细胞作为靶细胞。效应细胞与靶细胞按效靶比20:1混合,LDH法检测细胞杀伤活性。同时设本底组、自然释放组、最大释放组、机体校正组,计算杀伤率。杀伤率(%)=(实验组吸光度-效应细胞自然释放组吸光度-靶细胞自然释放组吸光度)/(最大释放组吸光度-靶细胞自然释放组吸光度)×100%。1.3 统计学分析
采用SPSS 22.0软件进行统计学分析,绘图采用GraphPad Prism 6软件。数据以±s表示,各时间点组间比较采用ANOVA方差分析、两样本的比较采用t检验,生存分析采用Kaplan-Meier法。P<0.05为差异具有统计学意义。
2 结果
2.1 不同治疗方法对TDLNs中Treg比例的影响
治疗后14天与A组FOXP3+Treg比例相比,B、C组均下降(均P<0.05);与D组FOXP3+Treg比例相比,B、C组均下降(均P<0.05)。治疗后21天B、C组中FOXP3+Treg比例恢复至治疗前(表1,图1)。

表1 流式细胞术检测TDLNs中的Treg比例(n=25)

图1 治疗后14天各组FOXP3+Treg比例变化
2.2 不同治疗方法对TDLNs中CTL比例的影响
治疗后14天与A组CD8+CTL比例相比,B、C、D组均增加(P<0.05、P<0.001、P<0.05);C组CD8+CTL比例较B、D组显著增加(均P<0.001)。治疗后21天C、D组CD8+CTL比例均较A组增加(均P<0.05);C、D组CD8+CTL比例均较B组增加(均P<0.05)。见表2,图2。
2.3 不同治疗方法对CTL杀伤活性的影响
治疗后7天C组CTL杀伤活性较A、B、D组升高(均P<0.05)。治疗后14天与A组CTL杀伤活性相比,B、C、D组均升高(P<0.05、P<0.001、P<0.05);C组CTL杀伤活性较B、D组升高(均P<0.05)。治疗后21天与A组CTL杀伤活性相比,C、D组均升高(均P<0.001)。见表3。

表2 流式细胞术检测TDLNs中CD8+CTL比例(n=25)
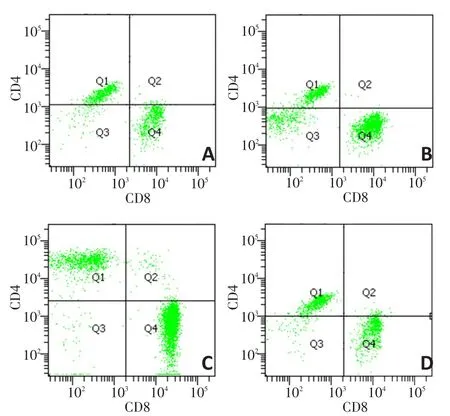
图2 治疗后14天各组CD8+CTL比例变化

表3 TDLNs中CTL对RM-1细胞的杀伤活性(n=25)
2.4 不同治疗方法对肿瘤大小及小鼠OS的影响
与A组肿瘤体积相比,B、C、D组均缩小(P<0.05、P<0.001、P<0.05);B组与D组比较差异无统计学意义(P>0.05)。C组肿瘤体积较B、D组均显著缩小(均P<0.05)。冷冻消融治疗或抗CTLA-4抗体治疗后肿瘤体积缩小,联合治疗后肿瘤体积缩小更显著(表4)。
A、B、C、D组OS分别为(25.60±1.52)天、(34.20±6.98)天、(43.60±2.88)天、(31.00±4.64)天。与A组小鼠OS相比,B、C组均延长(P<0.05、P<0.001)。C组小鼠OS较B、D组显著延长(P<0.05、P<0.001)。冷冻消融治疗使小鼠OS延长,联合治疗效果更加显著(图3)。

表4 各组肿瘤大小变化(n=25)

图3 各组小鼠总体生存曲线
3 讨论
近年来,我国PCa发病率呈上升趋势,占男性恶性肿瘤的第6位[7]。对于早期PCa,冷冻消融治疗的效果可以达到外科根治术水准[8],同时也可作为中晚期PCa的补救治疗[9-10],但单纯冷冻消融不能完全控制肿瘤的转移和复发,其引发的“冷冻免疫反应”有可能作为突破治疗瓶颈的关键点。Treg是对ATIR产生负性调控作用的一个重要因素,CTL则是ATIR中产生肿瘤杀伤效应的一个重要因素。抗CTLA-4抗体可以阻断Treg表面的CTLA-4与CD80结合,从而增强CTL功能并增强ATIR[11]。距离PCa原发病灶最近的TDLNs是机体中重要的免疫监视场所,因其含有大量的免疫细胞,最先产生ATIR;在肿瘤进展的过程中,TDLNs逐渐产生免疫耐受甚至免疫抑制,故其成为PCa转移的第一个组织,因此,TDLNs在PCa的发展中具有重要的监测价值。
本研究发现,与对照组相比冷冻消融对下调Treg比例及上调CTL比例有一定作用,在降低Treg负性调节作用和增强CTL杀伤活性的同时加强ATIR,肿瘤体积显著缩小,荷瘤小鼠OS延长。值得注意的是,单纯抗CTLA-4抗体治疗虽未明显引起Treg比例变化,荷瘤小鼠OS也无明显变化,但却上调了CTL比例,至治疗后21天仍保持逐渐增长的趋势,此时CTL杀伤活性持续增强,肿瘤体积显著缩小,ATIR持续时间较长,提示抗CTLA-4抗体影响CTL效应,但与Treg数量无关,可能与阻断Treg负性调节信号,增加正性共刺激信号的分子功能有关。本研究还显示,联合治疗对下调Treg比例及上调CTL比例的效果显著,且持续治疗21天后,此时CTL杀伤活性持续增强,ATIR明显加强,与单纯冷冻消融或抗CTLA-4抗体治疗相比,肿瘤体积缩小更加显著,荷瘤小鼠OS得到明显延长。
Waitz等[12]发现,对小鼠左侧PCa移植瘤行冷冻消融后,在右侧种植PCa移植瘤,并给予抗CTLA-4抗体治疗后肿瘤微环境和脾脏中CD8+T细胞数量显著增加,肿瘤内效应T细胞与Treg数量之比提高,机体提高了对第二个肿瘤的抵抗性,小鼠OS延长。Benzon等[13]在同一小鼠腹部两侧分别种植一大一小两个PCa移植瘤,在注射抗CTLA-4抗体2天后,对大种植瘤进行冷冻消融治疗。该研究中的单纯抗CTLA-4抗体治疗组既未减缓肿瘤生长也未延长小鼠OS,与单纯冷冻消融组相比,联合治疗组的小种植瘤生长推迟了14.7天,小鼠死亡率下降4倍,提示联合治疗具有协同作用并对小种植瘤产生“远位效应”。联合治疗组Treg和CD8+T细胞比例均有所上升,但是二者比值却未发生明显改变,与本研究得出的ATIR与Treg数量无关的结论具有一致性,有待进一步探究Treg影响ATIR的具体作用机制。
本研究通过探讨冷冻消融联合抗CTLA-4抗体对Treg及CTL的影响,提示免疫检查点CTLA-4可能是抑制Treg功能的重要分子靶点,冷冻消融联合免疫治疗可能是提高ATIR的治疗方案,为PCa的系统治疗提供了动物实验依据,具有临床指导意义。
[1]Onik G,Vaughan D,Lotenfoe R,et al.The"male lumpectomy":focal therapy for prostate cancer using cryoablation results in 48 patients with at least 2-year follow-up[J].Urol Oncol,2008,26(5):500-505.
[2]Onik G.Rationale for a"male lumpectomy,"a prostate cancer targeted approach using cryoablation:results in 21 patients with at least 2 years of follow-up[J].Cardiovasc Intervent Radiol,2008,31(1):98-106.
[3]Si TG,Guo Z,Wang HT,et al.Cryoablation for prostate cancer induces tumor-specific immune response[J].Zhonghua Nan Ke Xue,2009,15(4):350-353.
[4]den Brok MH,Sutmuller RP,Nierkens S,et al.Efficient loading of dendritic cells following cryo and radiofrequency ablation in combination with immune modulation induces anti-tumour immunity[J].Br J Cancer,2006,95(7):896-905.
[5]Beyer M,Schultze JL.Regulatory T cells in cancer[J].Blood,2006,108(3):804-811.
[6]Grosso JF,Jure-Kunkel MN.CTLA-4 blockade in tumor models:an overview of preclinical and translational research[J].Cancer Immun,2013,13:5.
[7]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[8]Edison E,Tariq Shah T,Ahmed HU.Focal ablation of early-stage prostate cancer:candidate selection,treatment guidance,and assessment of outcome[J].Urol Clin North Am,2017,44(4):575-585.
[9]Golbari NM,Katz AE.Salvage Therapy options for local prostate cancer reecurrence after primary radiotherapy:a literature review[J].Curr Urol Rep,2017,18(8):63.
[10]Yilmaz S,Özdogan M,Cevener M,et al.Use of cryoablation beyond the prostate[J].Insights Imaging,2016,7(2):223-232.
[11]Li F,Guo Z,Yu H,et al.Anti-tumor immunological response induced by cryoablation and anti-CTLA-4 antibody in an in vivo RM-1 cell prostate cancer murine model[J].Neoplasma,2014,61(6):659-671.
[12]Waitz R,Solomon SB,Petre EN,et al.Potent induction of tumor immunity by combining tumor cryoablation with anti-CTLA-4 therapy[J].Cancer Res,2012,72(2):430-439.
[13]Benzon B,Glavaris SA,Simons BW,et al.Combining immune checkpoint blockade and cryoablation in an immunocompetent hormone sensitive murine model of prostate cancer[J].Prostate Cancer Prostatic Dis,2018,21(1):126-136.

