ALC1蛋白在食管鳞癌中的表达及其对细胞增殖 侵袭 迁移的影响
李芳芳 马磊 张振 朱颖慧 关新元③ 王鹏 秦艳茹
食管癌作为人类最常见的恶性肿瘤之一,在我国恶性肿瘤死亡率中位居第四位[1]。目前基因诊断与基因治疗在恶性肿瘤中的作用越来越突出。ALC1(amplified in liver cancer 1)为肝癌的最新候选癌基因,是从人体肝癌细胞的染色体1q21区分离并克隆的一个新基因,又名CHD1L(chromodomain helicase/ATPase DNA binding protein 1-like gene)[2-4]。目前该基因与食管癌发生发展的关系鲜见报道。此次研究采用免疫组织化学法检测ALC1在食管鳞癌组织及其癌旁组织中蛋白水平的表达,从而探讨其与食管癌临床病理特征的关系,并从细胞水平探讨ALC1对食管癌细胞的增殖、侵袭及迁移能力的影响。
1 材料与方法
1.1 材料
收集林州市人民医院在2002年2月至2008年12月间手术获取的289例食管癌组织及距癌组织超过5cm正常黏膜组织。用以上组织构建食管癌组织芯片,其中44例组织标本在免疫组织化学染色后不同程度缺失,予以剔除,剩余245例标本经组织病理学检查证实为原发性食管鳞状细胞癌,其中男性109例,女性136例;年龄在40~82岁,所有患者术前均未接受放疗或化疗。本研究获得患者知情同意,符合伦理学要求。
主要试剂:CHD1L(ALC1)兔抗人多克隆抗体及小牛血清蛋白(美国Sigma公司),非免疫山羊血清(福建迈新生物技术公司),苏木素(hematoxylin,Mayer's)、二步法抗兔/鼠通用型免疫组织化学检测试剂盒(丹麦DAKO公司),氯仿、二甲苯、无水乙醇、30%过氧化氢(广州化学试剂厂),TRIzol Reagent(美国Invitrogen公司),逆转录试剂(美国Invitrogen公司);DMEM(Gibco公司),脂质体Lipfectamine 2000(Invitrogen公司)等。
食管癌细胞株:EC18&HKESC1为来自中国患者的两种食管癌细胞株,KYSE30、KYSE140、KYSE180、KYSE410、KYSE510为来自日本患者的五种食管癌细胞株,由中山大学肿瘤防治中心实验研究部保存。细胞用含10%胎牛血清的DMEM培养基在37℃、5%CO2条件下培养。真核表达质粒载体pcDNA3.1(+)、感受态大肠杆菌Ecoli DH5α由中山大学肿瘤防治中心实验研究部保存。
1.2 方法
1.2.1 免疫组织化学染色(SP法) 采用生产第二抗体的正常动物血清封闭非特异性免疫球蛋白反应,与省略第一抗体阴性切片作为空白对照,采用已知的阳性切片作阳性对照。主要步骤如下:石蜡切片脱蜡、梯度酒精至去离子水;3%H2O2室温孵育15 min,纯水洗涤1次;在0.5M EDTA缓冲液中煮沸20 min进行热抗原修复;芯片滴加非免疫山羊血清,室温孵育20 min;加一抗,PBS+4%BSA混合液按1:900配制一抗工作液,每张芯片滴加150 μL一抗工作液,置湿盒内,4℃冰箱孵育过夜12 h;室温孵育20 min;二抗37℃孵育30 min;每张组织芯片滴加DAB工作液150 μL,光镜下观察显色,终止反应;苏木素复染60 s;自来水冲洗1 min阻断复染;1%盐酸酒精浸泡1 s分化;二甲苯透明,中性树胶封片。阳性细胞标准:ALC1蛋白在食管癌组织中阳性表达主要定位于细胞核,在正常黏膜组织中ALC1的阳性表达主要定位于细胞核和胞浆。根据染色程度及阳性细胞数的乘积评分[5]:a染色程度:0分为细胞核蓝色,1分为细胞核淡黄色,2分为细胞核棕黄色,3分为细胞核棕褐色;b阳性细胞数:0分为阳性细胞数<25%,1分为阳性细胞数25%~50%,2分为阳性细胞数50%~75%,3分为阳性细胞数>75%,a×b为4~9分者评为免疫组织化学染色阳性。显微镜×200镜下计数至少5个随机视野,取平均值。
1.2.2 细胞培养及转染 对筛选出的KYSE30食管癌细胞株培养(用含10%胎牛血清的DMEM培养基在37℃、5%CO2条件下培养),转染前一天细胞计数,最适宜细胞数量为80%~90%细胞覆盖培养皿,然后按Lipofectamine 2000试剂说明书转染细胞。实验应用pcDNA3.1(+)进行转染,转染后细胞通过G418药物筛选,并挑选单克隆建立稳转细胞株,PCR验证,并送公司进行测序,验证转染序列。
1.2.3 RT-PCR法检测转染后细胞中ALC1mRNA的表达 提取转染后食管癌细胞及空载体细胞的cRNA行逆转录,RT-PCR引物设计见表1。
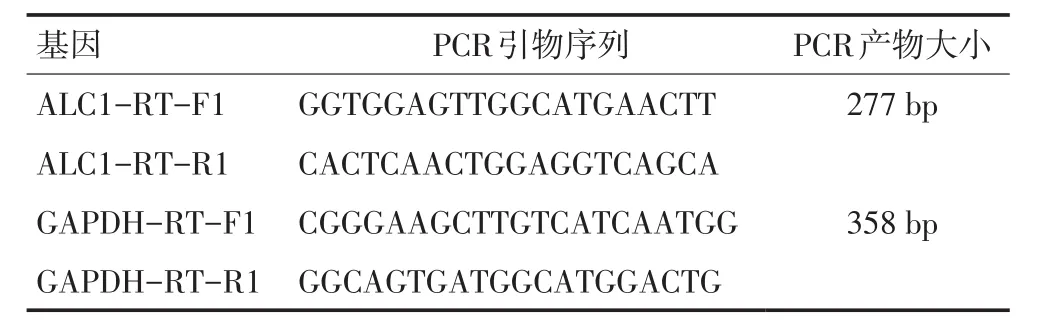
表1 PCR引物序列
ALC1 PCR反应条件:94℃预变性5 min;95℃ 30 s,60℃ 30 s 72℃ 1 min共30 Cycles 72℃延伸5 min;GAPDH PCR反应条件94℃预变性5min;95℃ 30 s,58℃ 30 s 72℃ 1 min共26 Cycles 72℃延伸5 min;4℃冰箱保存PCR产物。用1.8%琼脂糖凝胶电泳分析ALC1基因及GAPDH内参产物。
1.2.4 MTT比色试验 取对数生长期KYSE30-目的基因细胞及KYSE30-Vector细胞。以1×104个/孔接种于96孔板培养,每组3个复孔,实验重复3次,每孔100 μL。条件培养48 h后,于不同时间点每孔加入MTT溶液,孵育4 h后离心弃上清,另加入二甲基亚砜(DMSO)振荡数分钟,选择吸光度490 nm波长,在酶标仪上测定各孔的吸光度A值,并记录结果。细胞生长抑制率=(实验组平均A490-对照组平均A490)/对照组平均A490×100%,重复3次
1.2.5 平板克隆形成试验 分别取对数生长期的KYSE30-目的基因细胞及KYSE30-Vector细胞。胰酶消化,DMEM培养基重悬,计数,将细胞悬液分别进行适当稀释后加入6孔板中(1 000个细胞/孔),每孔2 mL,每组设3个平行孔。使细胞分散均匀,置37℃、5%CO2条件下,连续培养2~3周。当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加75%乙醇溶液5 mL,固定30 min。2%结晶紫染液染30 min。将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆。
1.2.6 Transwell侵袭实验检测细胞的侵袭能力 将Matrigel胶按50 μL/孔铺在Transwell小室底部微孔聚碳酸膜上,恒温孵育2 h成胶。调整KYSE30-目的基因细胞及KYSE30-Vector细胞的细胞密度为5×104个/mL,小室上室分别加入200 μL各实验组细胞悬液并套入下室,下室加入500 μL含15%FBS的PRMI 1640培养液,37℃培养箱常规培养48 h后取出小室,并用70%甲醇固定30 min,消毒棉签擦去上室内面的Matrigel和未穿越的细胞,结晶紫染色,在高倍镜视野下计数小室下面细胞数即为穿膜细胞数。实验重复3次。
1.2.7 细胞划痕实验检测细胞的迁移能力 制备KYSE30-目的基因细胞及KYSE30-Vector细胞的细胞悬液,在细胞培养皿中均匀种植相同数量细胞,用枪头均匀划痕细胞后给予PBS清洗脱离下来的细胞,然后将培养皿放入37℃、5%CO2培养箱中继续培养,分别在0、24、48 h显微镜下观察细胞划痕的愈合情况。1.3 统计学分析
采用SPSS16.0统计软件进行统计学分析,分类资料用χ2检验;Kaplan-Meier分析ALC1表达与食管癌患者的生存关系。P<0.05为差异具有统计学意义。
2 结果
2.1 ALC1蛋白在ESCC及癌旁组织中表达
食管鳞癌组织中ALC1蛋白表达阳性率为41.6%(102/245),食管正常黏膜组织中ALC1蛋白表达阳性率为21.2%(52/245),两组间比较差异具有统计学意义(P<0.05,表2,图1)。
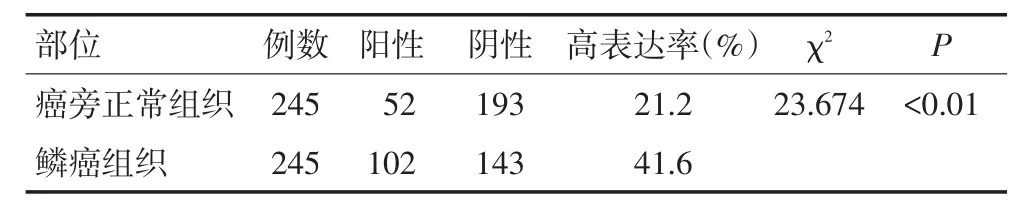
表2 ALC1蛋白在食管鳞癌组织及癌旁组织中的表达 例
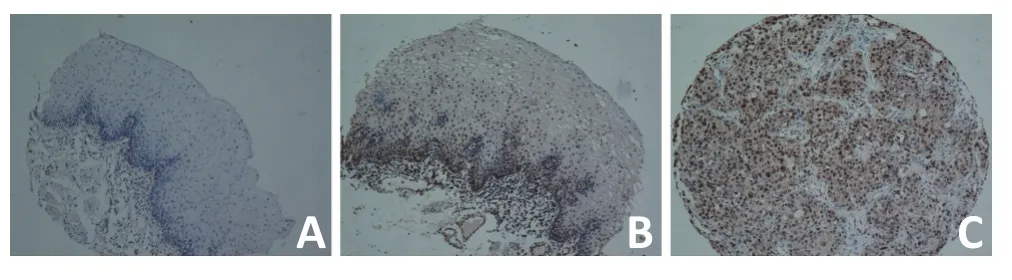
图1 食管鳞癌组织中ALC1蛋白阳性表达
2.2 ALC1蛋白表达与食管鳞癌临床病理特征的关系
ALC1在ESCC中的表达增高与性别、年龄、肿瘤细胞分化程度无关(P>0.05)。ALC1与肿瘤的浸润深度、TNM分期和淋巴结转移显著相关(P<0.05,表3)。
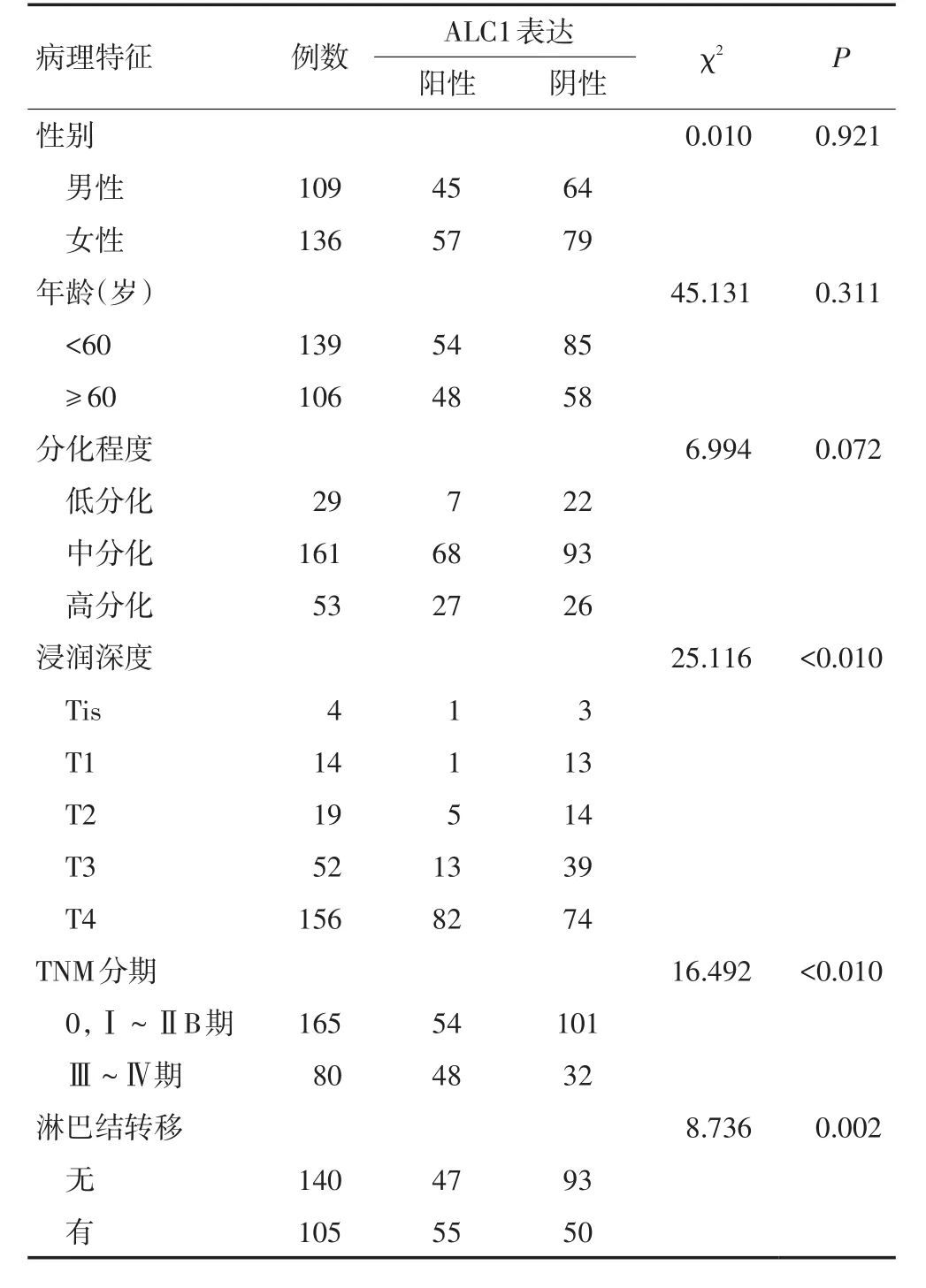
表3 ALC1蛋白的表达与食管鳞癌临床病理特征的关系 例
2.3 ALC1表达对食管鳞癌患者预后的影响
ALC1蛋白表达升高的食管鳞癌患者的总生存率明显低于ALC1蛋白低表达的食管鳞癌患者(P<0.05,图2)。
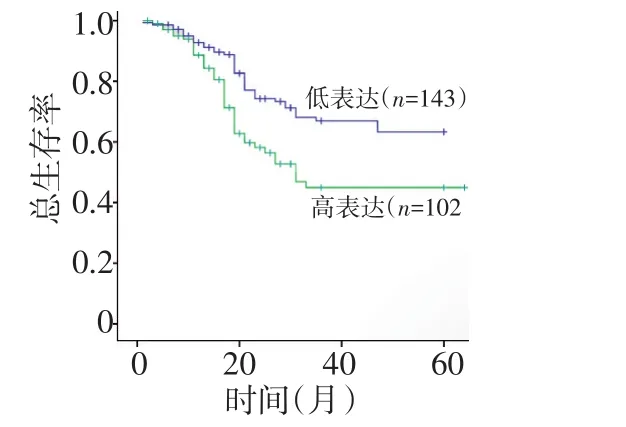
图2 ALC1表达与食管鳞癌患者总生存的关系
2.4 RT-PCR检测ALC1在食管癌细胞株中的表达情况
半定量RT-PCR结果显示KYSE30、KYSE410、KYSE510三株食管癌细胞株ALC1表达较低,EC18、KYSE180、HKESC1、KYSE140四株食管癌细胞株ALC1呈现显著高表达(图3),因而选择表达相对较低的KYSE30转染ALC1。
2.5 MTT检测转染了ALC1的KYSE30细胞生长情况
MTT检测ALC1在24、48及72h测定细胞增殖并进行统计,以上实验重复3次。结果发现KYSE30细胞转染ALC1后的细胞生长较对照组均明显升高,细胞体外增殖能力明显增强,差异具有统计学意义(P<0.05,图4)。

图3 RT-PCR检测ALC1在不同食管鳞癌细胞株中表达
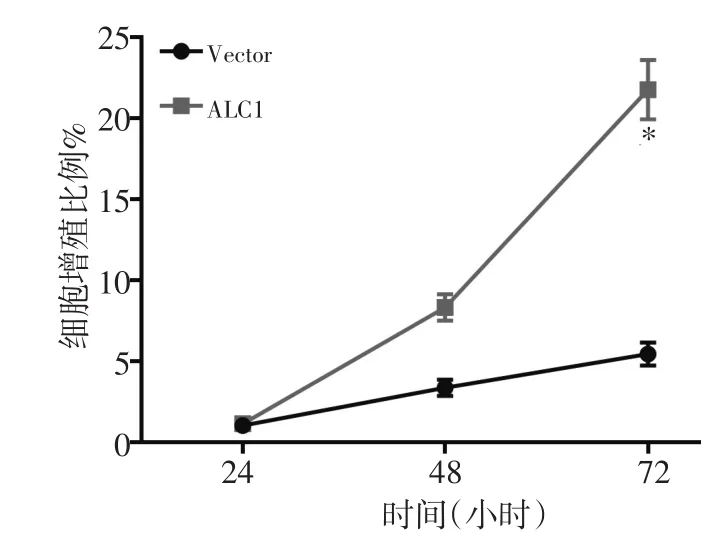
图4 转染ALC1的KYSE30细胞生长情况
2.6 平板克隆形成实验检测ALC1对KYSE30增殖能力的影响
克隆形成实验结果发现转染了ALC1组的KYSE-30细胞克隆形成率较对照组明显升高,差异具有统计学意义(P<0.05,图5)。
2.7 Transwell侵袭实验检测ALC1对KYSE30细胞侵袭能力的影响
Transwell实验表明,稳定表达ALC1基因的KYSE30细胞体外侵袭能力显著增强(图6A),以上实验重复三次。KYSE30-Vector及KYSE30-ALC1每组随机抽取10个视野计数并进行统计。统计学结果显示过表达ALC1基因的KYSE30食管癌细胞的体外侵袭能力显著增强,差异具有统计学意义(P<0.05,图6B)
2.8 细胞划痕实验检测ALC1对KYSE-30细胞迁移能力的影响
KYSE30-Vector及KYSE30-ALC1在0、24和48 h的划痕实验图片见图7A,以上实验重复3次。两组细胞在0 h均形成边缘整齐且锐利的划痕,划痕宽度无显著差异;24、48 h时,KYSE30-ALC1伤口愈合率明显高于对照组,统计学结果显示过表达ALC1基因的KYSE30食管癌细胞的体外迁移能力显著增强,差异具有统计学意义(P<0.05,图7B)。

图5 平板克隆形成实验检测ALC1对KYSE30增殖的影响
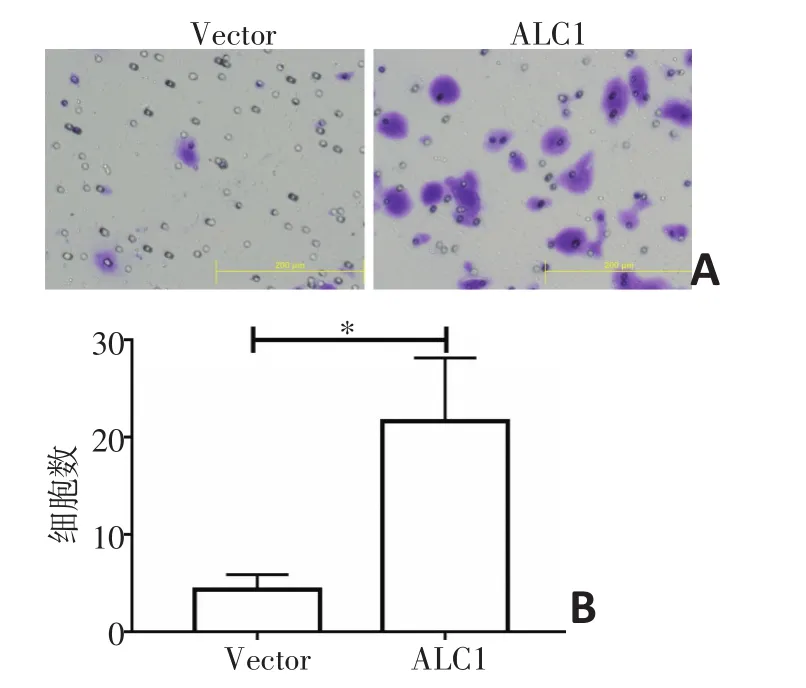
图6 Transwell侵袭实验检测ALC1对KYSE30侵袭的影响
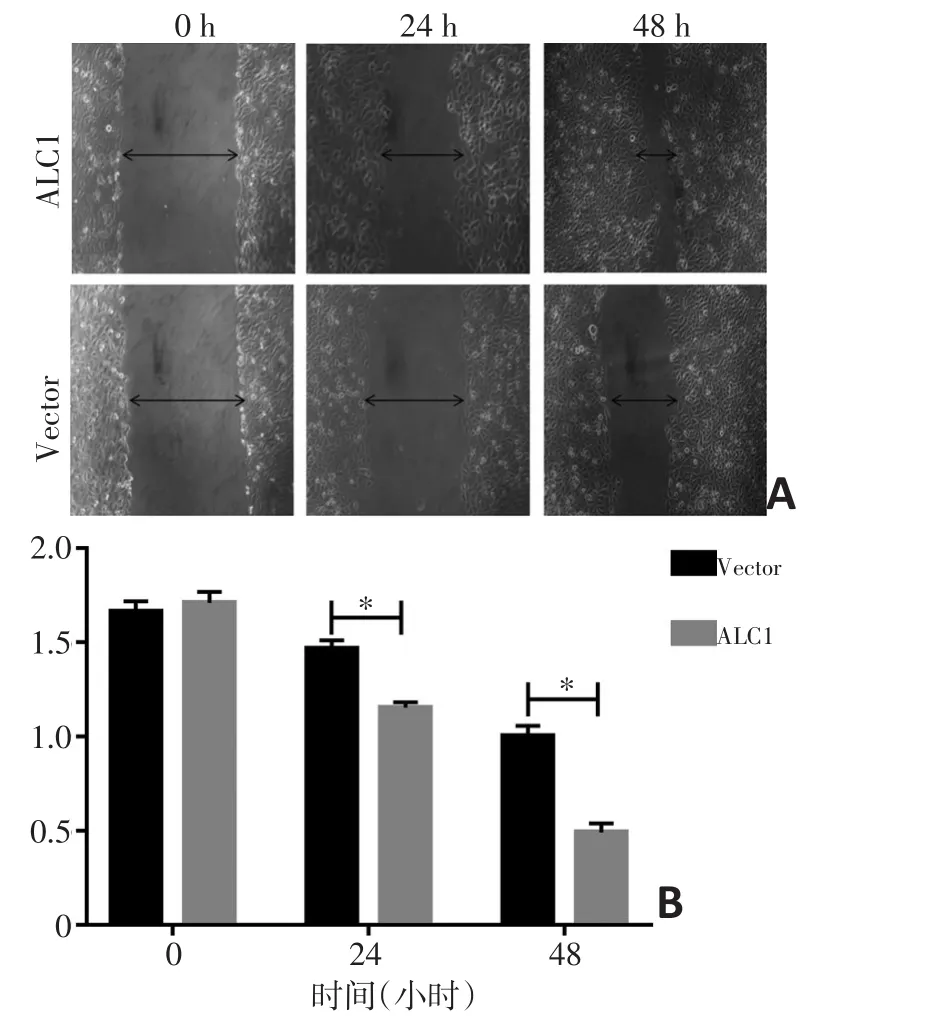
图7 细胞划痕实验检测ALC1对KYSE30迁移的影响
3 讨论
ALC1(基因库登记号AF537213),位于1q21.1,基因全长2.98 kb,编码89kDa分子蛋白[2],属于SNF-2类家族,具有调控基因转录的功能[3-4],是该家族中唯一一个具有致癌作用的基因。本研究发现ALC1蛋白在食管癌组织中的表达明显高于正常组织,对食管癌的生长具有重要作用,可能与其调控下游基因及促进细胞增殖相关。既往研究发现,ALC1基因通过下调蛋白p53以及其下游效应基因p21、同时上调Cdk2及细胞周期蛋白Cyclin E的表达,从而促进DNA合成及G1期到S期的进程,促进细胞增殖,导致肿瘤的发生[6-9]。p21蛋白又可以通过C端与增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)结合,阻断正在复制的DNA进程[10-11]。
本研究中还发现ALC1在ESCC中的表达升高与肿瘤的浸润深度、TNM分期和淋巴结转移显著相关。且ALC1蛋白表达升高的食管鳞癌患者的总生存率明显低于ALC1蛋白低表达的食管鳞癌患者。这主要与ALC1具有抗细胞凋亡的能力和增强细胞侵袭能力相关。ALC1通过与孤儿受体超家族Nur77结合[12-13]抑制Nur77从细胞核到线粒体的移动,从而阻碍细胞色素C向细胞质的释放,抑制细胞凋亡蛋白酶9和细胞凋亡蛋白酶3的激活,阻碍细胞凋亡。从ALC1蛋白中分离的相关蛋白ARHGEF9可调控活性GTP状态与无活性GDP状态的转化。ARHGEF9介导Cdc42激活,从而增强细胞的游动性及诱导丝状伪足细胞形成及上皮细胞向间叶细胞的转化,发生EMT,增强肿瘤细胞的迁移、侵袭和转移作用[14-15]。近年来有相关研究表明ALC1在肝癌、肺癌、胃癌、前列腺癌及结肠癌、乳腺癌等恶性肿瘤中呈现高表达[16-20],并且在细胞学方面的相关实验表明该基因的异常表达与某些恶性肿瘤的发生发展、侵袭及转移过程密切相关。同时有研究报道ALC1表达与肝癌、结肠癌的不良预后正相关,预示其可能是肿瘤细胞恶性转化的一个关键因素。
本实验证实了ALC1可能作为一个新的食管癌候选癌基因,其可能与食管癌的进展及不良预后密切相关,对进一步了解食管鳞癌的分子发病机制具有一定意义。
[1]杨正梅,卜友泉,刘革力,等.siRNA介导的Plk1表达沉默对食管癌细胞生长的影响[J].西南大学学报(自然科学版),2009,31(8):61-66.
[2]Ma NF,Hu L,Jackie MF,et al.Isolation and Characterization of Novel Oncogene,Amplified in Liver Cancer 1,within a Commomly Amplified Region at 1q21 in Hepatocellular Carcinoma[J].Hepatology,2008,47(2):503-510.
[3]Chen LL,TIM H,Guan XY.Chromosome 1q21 amplification and oncogenes in hepatocellular carcinoma[J].Acta Pharmacologica Sinica,2010,31:1165-1171.
[4]Tseng YC,Cabot B,Cabot RA.ARID1A,a component of SWI/SNF chromatin remodeling complexes,is required for porcine embryo development[J].Mol Reprod Dev,2017,84(12):1250-1256.
[5]Kita Y,Natsugoe S,Okumura H,et al.Expression of osteopontin in oesophageal squamous cell carcinoma[J].Br J Cancer,2006,95(5):634-638.
[6]Turnquist C,Horikawa I,Foran E,et al.p53 isoforms regulate astrocyte-mediated neuroprotection and neurodegeneration[J].Cell Death Differ,2016,23(9):1515-1528.
[7]Yan Y,Zhu Y,Sun F,et al.Extracellular regulated pro-tein kinases 1/2phosphorylation is required for hepatic differentiation of human umbilical cord-derived mesenchymalstem cells[J].Exp Biol Med(Maywood),2015,2 40(4):534-545.
[8]Bali A,Edwards LS,Sutherland RL,et al.Cyclin D1,p53,and p21Waf1/Cip1 expression is predictive of poor clinical outcome in serous epithelial ovarian cancer[J].Clin Cancer Res,2004,10(15):5168-5177.
[9]He L,Ning X,Sun Y,et al.Inhibition of DNA replication by an anti-PCNA aptamer/PCNA complex[J].Nucleic Acids Res,2018,46(1):25-41.
[10]Soria G,Gottifredi V.PCNA-coupled p21 degradation after DNA damage:The exception that confirms the rule[J].DNA Repair(Amst),2010,9(4):358-364.
[11]Abbas T,Sivaprasad U,Terai K,et al.PCNA-dependent regulation of p21 ubiquitylation and degradation via the CRL4Cdt2 ubiquitin ligase complex[J].Genes Dev,2008,22(18):2496-2506.
[12]Zhao Y,Bruemmer D.NR4A orphan nuclear receptors:transcriptional regulators of gene expression in metabolism and vascular biology[J].Arterioscer Thromb Vasc Biol,2010,30(8):1535-1541.
[13]Bonta Pl,Vos M,Pols TW,et al.Nuclear receptor Nur77,Nurr1,and NOR-1 expressed in atherosclerotic lesion macrophages reduce lipid loading and inflammatory responses[J].Arterioscler Thromb Vasc Biol,2006,26(10):2288-2294.
[14]Dinicola S,Masiello MG,Proietti S,et al.Nicotine increases colon cancer cell migration and invasion through epithelial to mesenchymal transition(EMT):COX-2 involvement[J].J Cell Physiol,2018,233(6):4935-4948.
[15]李杨,冯丽,陈娟,等.ALC1介导的MAPK信号通路激活对肝癌细胞增殖的影响[J].解剖学研究,2016,38(1):48-51.
[16]Jayachandran A,Shrestha R,Dhungel B,et al.Murine hepatocellular carcinoma derived stem cells reveal epithelial-to-mesenchymal plasticity[J].World J Stem Cells,2017,9(9):159-168.
[17]Su Z,Zhao J,Xian G,et al.CHD1L is a novel independent prognostic factor for gastric cancer[J].Clin Tranl Oncol,2014,16(8):702-707.
[18]李师淼,花京文,袁汀浩,等.干扰CHD1L基因对肝内胆管细胞癌细胞系增殖和侵袭的影响[J].肿瘤防治研究,2017,44(8):520-524.
[19]马海芳,李发勇.过表达CHD1L基因对结肠癌细胞增殖、侵袭及迁移的影响[J].中国卫生检疫杂志,2016,26(7):1010-1012.
[20]李师淼,花京文.CHD1L在癌症中相关分子机制的研究进展[J].医学研究生学报,2016,29(4):445-448.

