胸苷磷酸化酶多态性对结直肠癌患者接受卡培他滨的辅助化疗疗效的影响*
张德志 张宇 朱少功 梅家转 季节
结直肠癌(colorectal cancer,CRC)是全球发病率排名第三位的恶性肿瘤[1],目前在中国每年新发病例约为37.5万例,每年死亡病例为19.1万例[2]。近年来贝伐珠单抗开启了晚期CRC靶向治疗的先河[3-4]。瑞戈非尼的获批上市也为晚期CRC患者带来新的治疗选择[5]。另外,在辅助化疗领域,基于对“IDEA研究”的认可,2018年第1版美国国立综合癌症网络(NCCN)指南指出对于低危的Ⅲ期结肠癌患者推荐3个月的Xelox辅助化疗方案[6]。目前,CRC术后辅助化疗仍是以卡培他滨为基础的化疗方案为主[7]。但是,该方案在临床应用过程中的疗效有较大的个体化差异,部分患者会耐药。因此,亟需进一步研究其敏感人群。
人体内的胸苷磷酸化酶(thymidine phosphorylase,TYMP)在卡培他滨的代谢中发挥关键作用[8]。此过程将卡培他滨转化为具有细胞毒作用的5-FU。另有研究表明,TYMP酶在肿瘤细胞内和血小板衍生内皮细胞生长因子结构非常相似[9],具有促进肿瘤血管新生和转移的重要作用[10]。多数研究也发现在不同的肿瘤中,TYMP均为高表达[11-13]。
TYMP基因位于染色体22q13.33,包含10个外显子。TYMP基因在中国人群并不保守[8]。Huang等[14]研究探讨在晚期胃肠道肿瘤中TYMP基因多态性位点rs11479的临床意义。结果表明,在晚期胃肠道肿瘤中,携带T等位基因的患者,TYMP基因的表达水平较高。然而,目前在CRC辅助化疗领域,尚缺乏TYMP基因5633C>T位点和预后的关联研究;另外,该基因的多态性位点和其mRNA表达的研究也较少。
因此,本研究旨在评估TYMP基因5633C>T位点与接受卡培他滨为基础辅助化疗的CRC患者总生存期(overall survival,OS)的相关性,并探讨该位点和CRC组织中TYMP基因mRNA表达的相关性。
1 材料与方法
1.1 病例资料
回顾性分析2010年1月至2016年12月在郑州人民医院行R0切除术后接受辅助化疗的CRC患者235例。入组标准:1)年龄≥18岁,ECOG评分在0~2分,心功能正常(左心室射血分数>50%),肾功能正常(肌酐≤1.5×ULN),骨髓功能正常(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L,血红蛋白≥9 g/dL);2)预期寿命≥3个月。排除标准:家族性腺瘤性息肉病,其他遗传性CRC综合征,失访的患者。本研究获得医院伦理委员会的批准(批号:ZZRMYY-100025-3),所有患者均签署了知情同意书。
1.2 方法
1.2.1 化疗方案 辅助化疗的用法用量为:术后3~4周,卡培他滨,1 000 mg/m2,2次/天,第1~14天,每21天为1个周期;奥沙利铂,80~130 mg/m2,静脉滴注,第1天。辅助化疗结合患者情况进行6~8个周期。根据治疗过程中出现的血液学或非血液学毒性调整相应的给药剂量,如果发生可能威胁生命的不良反应则中止治疗。
1.2.2 血液样本收集及基因分型 治疗过程中收集患者的外周血样本4 mL,采用苯酚氯仿法提取基因组DNA,之后置于-20°C保存。通过飞行时间质谱(美国Sequenom公司)的方法,按照说明书的标准操作步骤对每个样本进行基因分型。分析设置阴性参照,10%的样本至少分析1次来确保样本未被污染,部分样本的分型结果通过限制性片段长度多态性聚合酶链反应(PCR-RFLP)法进行验证。
设计包含5633C>T位点(rs11479)的上下游PCR引物,上游引物为:5'-TCTAACAGCCCCTCGCTCT-3',下游引物为:5'-GGGTCACGTGTTCATCGAG-3'。产物片段为266 bp,内切酶为BclI,通过片段长度判断该位点的基因型。CC型:1条266 bp条带;TT型:1条171 bp条带,1条95 bp条带;CT型:1条266 bp条带,1条171 bp条带,1条95 bp条带。
1.2.3 组织样本收集及TYMP表达分析 手术过程中收集每例患者被切除的CRC组织标本,最终87例组织标本纳入研究,液氮保存。之后使用Trizol试剂进行RNA提取,应用上海罗氏real-time PCR仪器检测TYMP mRNA表达,TYMP基因的上游引物为:5'-AT GGCAGCCTTGATGACC-3',下游引物为:5'-TTATT GCTGCGGCGGCAG-3'。实时定量PCR反应体系如下:SYBN Premix Ex Tag溶液 10 μL,TYMP F primer(20 μM)0.2 μL,TYMP R primer(20 μM)0.2 μL,ddH2O 7.6 μL,cDNA 2 μL;反应体系总计20 μL,GAPDH mRNA表达作为内参。TYMP mRNA采用相对定量法 2-ΔΔCt进行计算[15]。1.3 统计学分析
本研究中所有的变量均采用SPSS 19.0软件进行统计学分析。χ2检验分析多态性位点基因分型是否符合哈迪温伯格平衡。在基线临床资料中,离散型的变量和5633C>T(rs11479)位点不同基因型的分布采用χ2检验,当数据较少时采用Fisher精确检验。连续型的变量和5633C>T位点不同基因型的分析采用非参检验的Mann-Whitney U(两组间)或者Kruskal-Wallis H(多组间)检验。采用Stata 14.0软件绘制Kaplan-Meier曲线比较不同基因型患者OS的差异,曲线间的差异采用对数秩检验进行比较。OS的计算为手术的时间至患者死亡或最后一次随访结束。多变量分析时,对OS构建采用Cox风险比例模型,用向后LR的选择步骤来筛选和校正潜在的混杂变量。以P<0.05为差异具有统计学意义。
2 结果
2.1 235例CRC患者基线临床资料及5633C>T位点基因分型情况
入组的235例患者的基线临床资料如表1所示,入组患者中位年龄为53岁,大部分患者为男性(63.83%)。结肠和直肠分别为143例和92例,大部分患者肿瘤分化中等(68.09%)。在临床分期方面,Ⅱ期患者63例,Ⅲ期160例,Ⅳ期12例。辅助化疗方面,所有患者均接受术后辅助化疗,其中卡培他滨联合奥沙利铂方案158例(67.23%),卡培他滨单药方案77例(32.77%)。
5633C>T位点的基因分型结果为:野生型CC型149例(63.40%),CT型73例(31.06%),TT型13例(5.54%),最小等位基因频率为0.21,3种基因型分布频率符合哈迪温伯格平衡(P=0.313)。考虑到突变纯合子TT型患者相对较少,后期分析中将CT和TT型患者合并。该位点不同基因型在基线临床资料中的分布基本均衡(表1)。
将CT和TT型患者合并后共86例。在针对OS的单变量分析中,野生型CC型和突变型CT/TT型的两组患者在OS上均具有显著性差异,携带突变基因的CT/TT型患者和野生型CC型患者的中位OS分别为
2.2 TYMP基因5633C>T位点对预后的影响
5.9年和4.5年(图1)。野生型CC型患者相对于CT和TT型患者OS较差(P=0.009)。另外,本研究构建Cox风险比例模型,将可能影响OS的风险因素,如年龄、性别、肿瘤分化情况、病理分期以及5633C>T位点纳入该模型。经过多变量校正发现,5633C>T位点对OS独立的影响意义依然存在,并且具有显著性差异(HR=0.67,P=0.015,表2),其他在Cox模型中具有显著性差异的变量为年龄(HR=2.21,P=0.005)和病理分期(HR=2.87,P<0.001)。

图1 TYMP基因5633C>T位点不同基因型患者的OS曲线对比
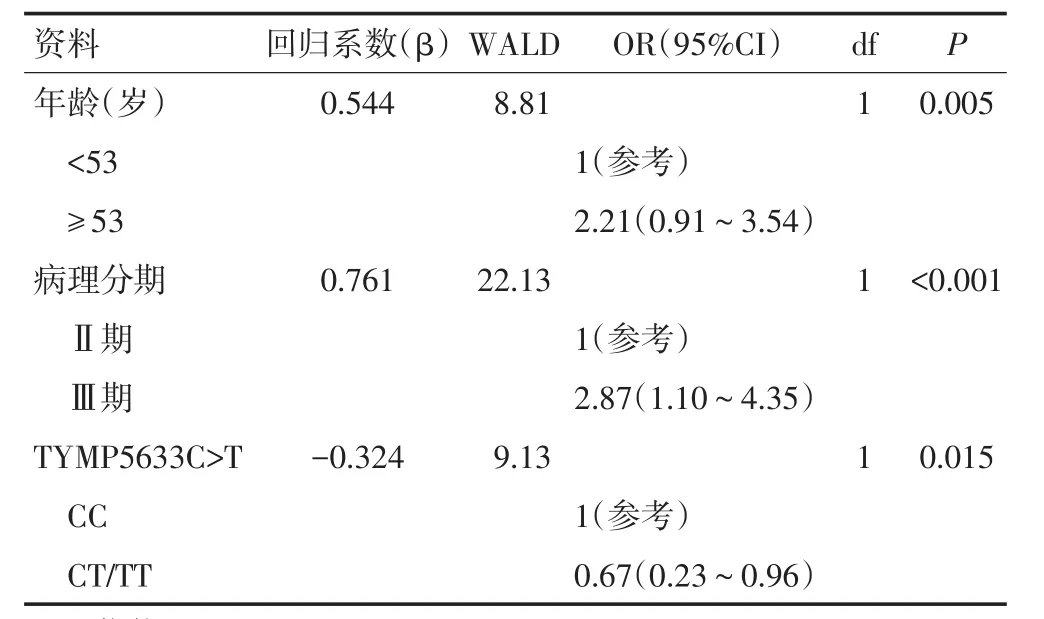
表2 影响OS的基线临床资料和多态性位点的多变量Cox风险比例模型
2.3 5633C>T位点对TYMP基因mRNA表达的影响
此外,本研究还纳入87例术后切除的癌组织标本,通过提取的RNA对TYMP的表达情况进行分析,并和5633C>T位点的基因型进行相关性统计。在87例癌组织标本中,CC型55例,CT型27例,TT型5例,3种基因型分布频率符合哈迪温伯格平衡(P=0.495)。TT型患者相对较少,将TT和CT型患者合并共32例。野生型CC型相对于突变型CT和TT型患者,TYMP mRNA表达水平明显较低,且具有显著性差异(P=0.019,图2)。

图2 TYMP基因5633C>T位点不同基因型表达情况对比
3 讨论
本研究纳入235例行手术治疗的CRC患者,通过对TYMP基因5633C>T位点基因分型和患者的预后进行关联性分析,发现该位点野生型CC型患者相对于携带T等位基因的CT和TT型患者OS较差,并通过87例组织标本的TYMP基因mRNA表达水平分析发现,该位点不同的基因型患者的mRNA表达水平呈较大的差异。5633C>T位点可能通过影响TYMP基因的表达,进而使CRC患者从卡培他滨为基础的辅助化疗当中获益。
CRC是异质性较强的恶性肿瘤[16]。目前,国内外有大量预测CRC疗效的生物标记物研究报道相继出现:2015年报道的CYP3A5多态性对FOLFIRI治疗结果的影响[17];2016年报道的胸苷酸合成酶TS多态性对结肠癌一线5-FU放疗疗效的影响[18];2017年报道的四氢叶酸转移酶MTHFR多态性对5-FU疗效的影响[19]。
本研究结果表明,在中国CRC患者接受卡培他滨为基础的辅助化疗时,TYMP基因5633C>T位点的T等位基因携带者可通过影响该基因的表达,从而使得该基因型患者对卡培他滨更为敏感,进而从卡培他滨的辅助化疗中获益。本研究结果和Huang等[14]研究结果基本一致,该研究纳入晚期胃肠道肿瘤患者,结果表明5633C>T位点的T等位基因携带者和较高的TYMP基因表达水平有关,这和本研究中CT/TT型患者的TYMP mRNA表达水平较高一致。然而,可能因为样本量较少,该研究并未发现该位点和OS有显著相关性。另外,Jennings等[20]研究发现,5633C>T位点的T等位基因携带者与接受卡培他滨治疗的CRC患者较多的不良反应有关。上述研究结果均表明,5633C>T位点的T等位基因携带者对卡培他滨可能更为敏感。另一方面,在TYMP基因表达水平和CRC预后的关系上,目前各项研究尚存在较大的争议。本研究表明TYMP mRNA高表达的人群更能从卡培他滨的治疗中获益,从而具有较好的预后,和Lu等[21]的研究结果一致。该研究纳入57例1线接受卡培他滨联合紫杉醇治疗的晚期胃癌患者,分析TYMP mRNA的表达水平和治疗的反应率以及与OS的关系,发现高表达的人群反应率较高,OS较好。然而,有其他研究结果发现,TYMP基因是促进肿瘤血管新生的重要因子,因此该基因高表达时通常伴随较高的肿瘤负荷,从而肿瘤更易复发和转移,进而预后更差[22]。但是上述研究中并未观察卡培他滨的治疗情况。因此,本研究推测TYMP基因在体内具有双重作用,一方面通过刺激肿瘤细胞血管新生促进肿瘤生长;另一方面,该基因是卡培他滨的重要代谢基因,是5-FU类化疗药物发挥细胞毒作用的关键基因,从而具有杀灭肿瘤细胞的作用。
综上所述,本研究发现在中国CRC患者中TYMP基因5633C>T位点是独立的OS影响因素。但本研究存在部分局限性,首先纳入研究的样本量较小,未在大样本中评估该位点的预后指导意义;其次,本研究为回顾性分析,存在一定偏倚。本研究对5633C>T位点的预后影响进行评估,同时从TYMP基因mRNA表达层面揭示该位点造成预后差异的部分原因,以期对CRC患者的预后指导提供参考。
[1]Bos A,Matthijsen RA,van Erning FN,et al.Treatment and outcome of synchronous colorectal carcinomas:a nationwide study[J].Ann Surg Oncol,2017,25(2):414-421.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]Rosen LS,Jacobs IA,Burkes RL.Bevacizumab in colorectal cancer:current role in treatment and the potential of biosimilars[J].Target Oncol,2017,12(5):599-610.
[4]冯稳,吴新新,郭永军,等.结直肠癌中微卫星不稳定性与PD-L1表达的关系及临床意义[J].中国肿瘤临床,2017,44(12):589-593.
[5]Li J,Qin S,Xu R,et al.Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer(CONCUR):a randomised,doubleblind,placebo-controlled,phase 3 trial[J].Lancet Oncol,2015,16(6):619-629.
[6]Lonardi S,Sobrero A,Rosati G,et al.PhaseⅢtrial comparing 3-6 months of adjuvant FOLFOX4/XELOX in stageⅡ-Ⅲ colon cancer:safety and compliance in the TOSCA trial[J].Ann Oncol,2017,28(12):3110.
[7]McQuade RM,Stojanovska V,Bornstein JC,et al.Colorectal cancer chemotherapy:the evolution of treatment and new approaches[J].Curr Med Chem,2017,24(15):1537-1557.
[8]Lam SW,Guchelaar HJ,Boven E.The role of pharmacogenetics in capecitabine efficacy and toxicity[J].Cancer Treat Rev,2016,(50):9-22.
[9]高庆,刘剑,张继民.结直肠癌组织胸苷磷酸化酶表达临床意义研究的现状[J].中华肿瘤防治杂志,2012,19(01):76-80.
[10]Elamin YY,Rafee S,Osman N,et al.Thymidine phosphorylase in cancer;enemy or friend[J]?Cancer Microenviron,2016,9(1):33-43.
[11]Zhang Q,Zhang Y,Hu X,et al.Thymidine phosphorylase promotes metastasis and serves as a marker of poor prognosis in hepatocellular carcinoma[J].Lab Invest,2017,97(8):903-912.
[12]Furukawa T,Tabata S,Yamamoto M,et al.Thymidine phosphorylase in cancer aggressiveness and chemoresistance[J].Pharmacol Res,2018,(132):15-20.
[13]Toi M,Masuda N,Lee SJ.Capecitabine for primary breast cancer[J].Oncotarget,2017,8(67):110739-110740.
[14]Huang L,Chen F,Chen Y,et al.Thymidine phosphorylase gene variant,platelet counts and survival in gastrointestinal cancer patients treated by fluoropyrimidines[J].Sci Rep,2014,(4):5697.
[15]Freitag D,Koch A,Lawson McLean A,et al.Validation of reference genes for expression studies in human meningiomas under different experimental settings[J].Mol Neurobiol,2017.[Epub a head of print].
[16]Shaikh T,Handorf EA,Meyer JE,et al.Mismatch repair deficiency testing in patients with colorectal cancer and nonadherence to testing guidelines in young adults[J].JAMA Oncol,2018,4(2):e173580.
[17]Dong N,Meng F,Wu Y,et al.Genetic polymorphisms in cytochrome P450 and clinical outcomes of FOLFIRI chemotherapy in patients with metastatic colorectal cancer[J].Tumour Biol,2015,36(10):7691-7698.
[18]Patricia Rios-Ibarra C,Janeth Rodriguez-Silva C,Alonso Lopez-Chuken Y,et al.Thymidylate synthase polymorphism in Mexican patients with colon cancer treated with 5-fluorouracil[J].J BUON,2016,21(4):935-940.
[19]Yeh CC,Lai CY,Chang SN,et al.Polymorphisms of MTHFR C677T and A1298C associated with survival in patients with colorectal cancer treated with 5-fluorouracil-based chemotherapy[J].Int J Clin Oncol,2017,22(3):484-493.
[20]Jennings BA,Loke YK,Skinner J,et al.Evaluating predictive pharmacogenetic signatures of adverse events in colorectal cancer patients treated with fluoropyrimidines[J].PLoS One,2013,8(10):e78053.
[21]Lu M,Gao J,Wang XC,et al.Expressions of thymidylate synthase,thymidine phosphorylase,classⅢbeta-tubulin,and excision repair cross-complementing group 1 predict response in advanced gastric cancer patients receiving capecitabine plus paclitaxel or cisplatin[J].Chin J Cancer Res,2011,23(4):288-294.
[22]Huang X,Wang L,Chen Y,et al.Poor prognosis associated with high levels of thymidine phosphorylase and thrombocytosis in patients with renal cell carcinoma[J].Urol Int,2017,98(2):162-168.

