BCD方案不同疗程数对于初治多发性骨髓瘤的疗效影响*
多发性骨髓瘤(multiple myeloma,MM)作为恶性肿瘤,发病率为4.7/10万例,随着新药的广泛应用,以及自体造血干细胞移植(autologous hematopoietic stem cell transplantation,ASCT),疾病缓解率(disease response rate,DRR)、无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS)均有明显提高[1]。以硼替佐米(bortezomib)为基础的3药联合诱导,包括硼替佐米、环磷酰胺(cyclophosphamide)、地塞米松(dexamethasone)即BCD 3药联合是众多MM指南一线推荐方案[2-3],然而不同疗程数的硼替佐米为基础诱导治疗MM的早期疗效比较分析国内尚鲜有报道。尽管理论推测疗程数增加可能带来缓解深度的提高及生存获益,但同时药物的不良反应,如硼替佐米引起的周围神经病变会导致患者生存质量的下降。本研究回顾性分析不同疗程BCD方案3药联合的疗效分析,为诱导治疗时限的选择提供数据支持。
1 材料与方法
1.1 病例资料
入选标准:1)2014年1月1日至2016年7月30日北京大学人民医院初诊MM患者;2)一线治疗采用BCD方案,具体治疗剂量:硼替佐米1.3 mg/m2d1、d4、d8、d11;环磷酰胺300 mg/d d1~5;地塞米松20 mg d1~4,40 mg d7、d10。对于合并糖尿病、年龄>70岁或ECOG评分≥2分的患者,地塞米松减量为20 mg d1~4。治疗过程若出现硼替佐米相关的周围神经病变2级剂量改为1 mg/m2或每周1次皮下注射,出现3级周围神经病变后暂停使用待症状缓解后改为0.7 mg/m2,每周1次;3)所有患者疾病疗效评价为未达到(not reach,NR)或疾病进展(progression of disease,PD)则更换为其他二线治疗,部分患者仅达到微小缓解(micro response,MR)根据临床情况选择更换为二线方案。排除标准:合并淀粉样变性;合并非骨旁和骨旁髓外浆细胞瘤;未能完成2个疗程BCD化疗。最终共入选70例患者,其中男性36例,女性34例。中位年龄为58.4(33~81)岁。病例资料包括:血尿常规、生化、血清蛋白电泳、血尿免疫固定电泳、免疫球蛋白定量、血尿总轻链定量、血白蛋白、β2微球蛋白(β2-MG)、肌酐、尿素氮、血钙、24 h尿蛋白定量、骨髓形态、免疫分型、骨髓基因(癌睾抗原-C1/CT7、MAGEC1/CT7)、骨髓染色体G带和荧光原位杂交(FISH)等。
1.2 方法
所有MM患者均采用国际骨髓瘤工作组(IMWG)2014年诊断标准[4],且所有病例均有流式细胞术(flow cytometry,FCM)证实浆细胞克隆性。所有患者不合并淀粉样变性。DS分期:Ⅰ期为符合全部下述4项:1)血红蛋白>100 g/L;2)血清钙正常;3)无骨质破坏;4)M成分水平IgG<50 g/L,IgA<30 g/L,尿轻链<4 g/24 h。Ⅲ期为符合下述一项或一项以上:1)血红蛋白<85 g/L;2)高钙血症;3)进展性溶骨病变;4)M-成分水平:免疫球蛋白IgG>70 g/L,免疫球蛋白IgA>50 g/L,尿轻链>12 g/24 h。Ⅱ期为介于Ⅰ、Ⅲ期之间。而每期又分为A、B组,A组肾功能正常(血肌酐SCr<2.0 mg/dL),B组肾功能不正常(血肌酐SCr≥2.0 mg/dL)。ISS分期为根据初诊时血清β2-MG及血清白蛋白(Alb)进行分期,具体为ISS-Ⅰ期:β2-MG<3.5 mg/L、Alb≥3.5 g/dL;Ⅲ期为β2-MG≥5.5 mg/L;Ⅱ期为介于Ⅰ、Ⅲ期之间。R-ISSⅠ期:β2-MG<3.5 mg/L,Alb≥3.5 g/dL,无高危细胞遗传学[17p缺失和(或)t(4;14)和(或)t(14;16)],乳酸脱氢酶(lactate dehydrogenase,LDH)水平正常;R-ISSⅢ期:包括ISS-Ⅲ期(β2-MG≥5.5 mg/L)和高危遗传遗传学或LDH水平高;R-ISSⅡ期:包括所有其他可能的组合。高危G带定义为常规细胞遗传学检测出现亚二倍体或13号染色体缺失[5]。MM的疗效判断标准:具体参照2014年IMWG标准[4]。其中难治性MM定义为疾病对治疗无反应或治疗过程中PD或停止治疗60 d内进展。原发耐药定义为接受一线治疗后未达到MR及以上疗效。
1.3 随访及统计学分析
全部患者均接受电话或门诊随访。PFS为自接受治疗至PD的时间。采用EXCEL 2017及SPSS 23.0软件进行统计学分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料
70例患者中,男性36例,女性34例。中位年龄为58.4(33~81)岁。DS分期Ⅲ期占88.57%(62/70),肾功能受损(SCr≥2 mg/dL)为16例。ISS分期Ⅰ、Ⅱ、Ⅲ期分别为16、18、36例。66例可获得完整R-ISS分期的患者中,R-ISS分期Ⅰ、Ⅱ、Ⅲ期分别为19、29、18例。血小板计数降低患者为14.29%(10/70)。LDH升高比例为11.43%(8/70)。染色体G显带为亚二倍体为6.06%(4/66)。t(4;14)/t(14;16)比例为16.42%(11/67)。Del(17p)比例为4.48%(3/67)。1q21扩增的患者比例为41.79%(28/67),表1。
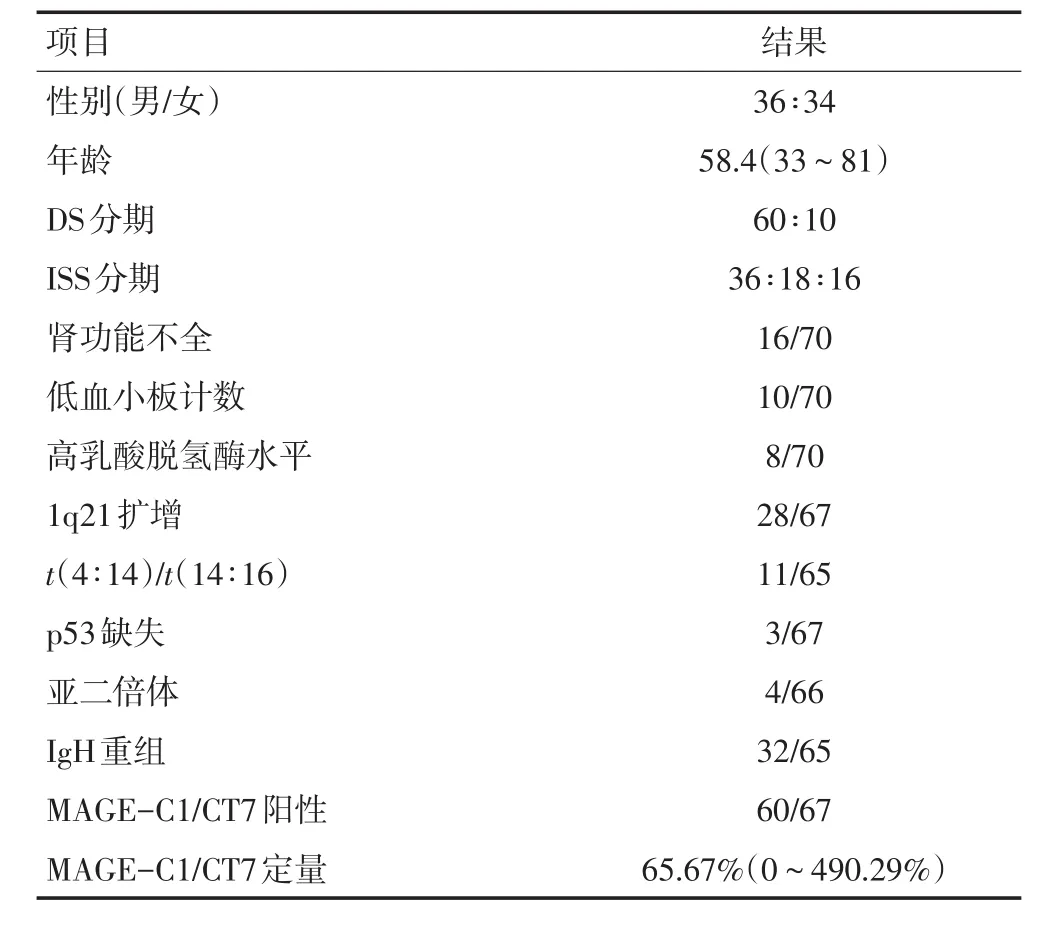
表1 患者一般资料和临床特点
2.2 难治性MM患者临床特点
接受2个疗程化疗未达到MR及以上疗效的病例,即原发耐药的比例为5.71%。所有患者中难治性MM比例为15.71%(11/70,表2)。难治性MM患者R-ISS分期Ⅰ、Ⅱ、Ⅲ期分别为1、7、3例难治性MM患者t(11;14)易位比例为36.4%,相比对照组为10.2%,差异具有统计学意义。

表2 难治性MM患者临床特点 n(%)
2.3 不同疗程数疗效分析
单纯接受2、4、6个疗程BCD诱导化疗的患者分别为14、20、36例。2个疗程14例患者中完全缓解(complete response,CR)2例、非常好的部分缓解(very good partial response,VGPR)4例、部分缓解(partial response,PR)4例、MR 1例、NR 2例、PD 1例。4个疗程20例患者中CR 6例、VGPR 6例、PR 4例、MR 1例、NR 1例、PD 2例。6个疗程36例患者中CR 14例、VGPR 13例、PR 3例、MR 2例、NR 0例、PD 4例。仅接受2个疗程组CR、≥VGPR、≥PR比例分别为14.28%、42.86%和71.42%;仅接受4个疗程组CR、≥VGPR、≥PR比例分别为 30.00%、60.00%和80.00%;仅接受6个疗程组CR、≥VGPR、≥PR比例分别为38.89%、75.00%和83.33%。总体中位随访时间为15.37(2~32)个月,估测中位无进展生存期(median PFS,mPFS)为 21.96(95%CI:19.26~24.70)个月。按患者接受BCD方案疗程分组,2、4、6个BCD疗程组估测 mPFS 分别为:28.82(95%CI:13.04~24.60)个月,23.73(95%CI:18.73~28.73)个月,21.08(95%CI:17.62~24.55)个月;3组PFS比较差异均无统计学意义(P=0.700,图1,2)。
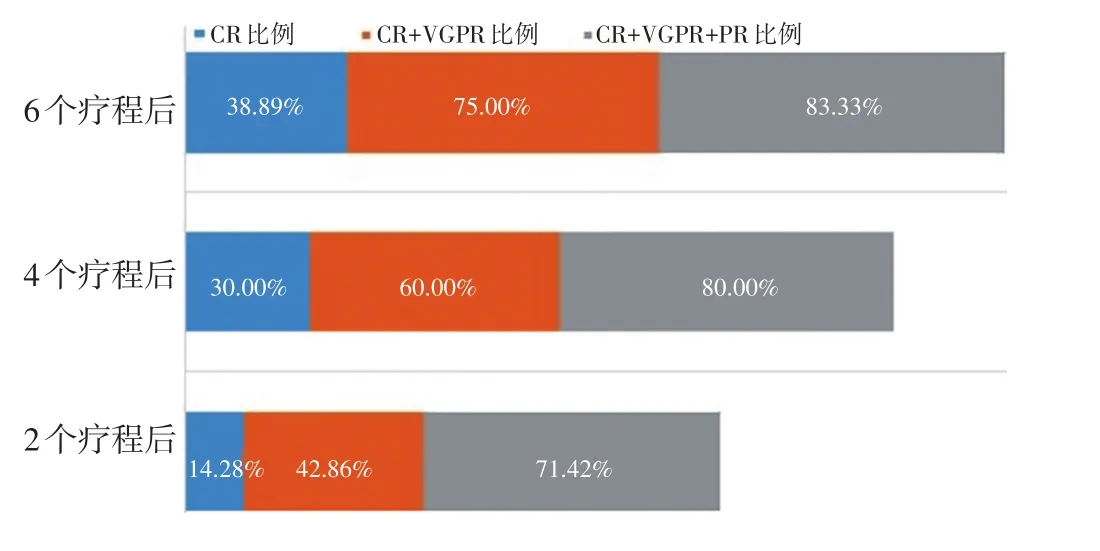
图1 BCD方案2、4、6个疗程疗效评估及比较

图2 70例患者生存曲线
3 讨论
本研究发现,一线治疗采用BCD方案3药诱导治疗模式下,4个疗程患者预估达到接近短期最大疗效,单纯接受4个疗程患者CR率可达30.00%,≥VGPR率可达60.00%,≥PR率可达80.00%。MM在初治时的骨髓瘤细胞总数约为1012个,经过化疗诱导治疗后CR以后,可以下降至106个。达到深层次的缓解总体上PD的时间延长,是获得疾病长期生存的重要保障。因此,选择可以获得更深层次缓解的方案为疾病治疗的首选[6-7]。BCD方案3药联合治疗广泛应用于MM的诱导治疗。根据IMWG的报道,BCD诱导治疗的总缓解率(overall response rate,ORR)可达81%[8]。有研究报道显示[9],硼替佐米为基础的诱导治疗CR可达36.8%,ORR可达84.2%,与本研究结果数据相似。对于MM患者,诱导治疗后均需要接受巩固和维持治疗。即便在新药时代,自体造血干细胞移植仍为适合移植患者的一线巩固治疗方案[10]。移植前疾病缓解状态与移植效果相关[7,11]。移植前硼替佐米为基础的化疗疗程尚无相应数据支持。部分临床试验及真实世界中多采用移植前BCD方案3药联合诱导3~6个疗程[12]。根据本研究的回顾性数据,BCD方案诱导在第4个疗程达到接近短期的最大疗效,继续密集诱导化疗能使VGPR、CR的患者比例进一步提高,但提高范围有限,且代价为药物不良反应的增加。因此,对于适合移植的患者可以在4个疗程BCD方案治疗后序贯ASCT,对于不适合移植的患者可以尝试在疾病尚未进展时期改为其他联合治疗,或进入巩固治疗阶段。由于回顾性分析均为单一的一线化疗方案,故本研究报道的样本量仅为70例,由于样本量过少出现结论偏倚可能性较大为本研究的主要缺陷。综上所述,BCD方案3药诱导治疗MM的最大疗效发生在第4个疗程及以后,4个疗程及以上BCD方案治疗可以作为MM的一线诱导治疗。
[1]Sun T,Wang S,Sun H,et al.Improved survival in multiple myeloma,with a diminishing racial gap and a widening socioeconomic status gap over three decades[J].Leuk Lymphoma,2017,7(9):1-10.
[2]Kumar S.Treatment of newly diagnosed multiple myeloma in transplant-eligible patients[J].Curr Hematol Malig Rep,2011,6(2):104-112.
[3]Traynor AE,Noga SJ,Panel NMMPG.NCCN:multiple myeloma[J].Cancer Control,2001,8(6 Suppl 2):78-87.
[4]Rajkumar SV,Dimopoulos MA,Palumbo A,et al.International myeloma working group updated criteria for the diagnosis of multiple myeloma[J].Lancet Oncol,2014,15(12):e538-548.
[5]Mikhael JR,Dingli D,Roy V,et al.Management of newly diagnosed symptomatic multiple myeloma:updated mayo stratification of myeloma and risk-adapted therapy(mSMART)consensus guidelines 2013[J].Mayo Clin Proc,2013,88(4):360-376.
[6]Flores-Montero J,Sanoja-Flores L,Paiva B,et al.Next generation flow for highly sensitive and standardized detection of minimal residual disease in multiple myeloma[J].Leukemia,2017,31(10):2094-2103.
[7]Chanan-Khan AA,Giralt S.Importance of achieving a complete response in multiple myeloma,and the impact of novel agents[J].J Clin Oncol,2010,28(15):2612-2624.
[8]Reeder CB,Reece DE,Kukreti V,et al.Cyclophosphamide,bortezomib and dexamethasone induction for newly diagnosed multiple myeloma:high response rates in a phaseⅡclinical trial[J].Leukemia,2009,23(7):1337-1341.
[9]杨光忠,陈文明.以硼替佐米为基础的联合方案治疗110例多发性骨髓瘤患者的疗效分析[J].中华医学杂志,2010,90(38):2671-2674.
[10]Das M.Stem cell transplantation in multiple myeloma[J].Lancet Oncol,2017,18(5):e252.
[11]Blade J,Rosinol L,Cibeira MT,et al.Hematopoietic stem cell transplantation for multiple myeloma beyond 2010[J].Blood,2010,115(18):3655-3663.
[12]Scott K,Hayden PJ,Will A,et al.Bortezomib for the treatment of multiple myeloma[J].Cochrane Database Syst Rev,2016,20(4):CD010816

