酸性富含亮氨酸的核磷蛋白32家族成员A 对心肌细胞肥大的影响及机制研究
沈立君 黄永平 祝学勇 刘叶 李红良
心肌肥厚是由生理或病理刺激导致的心脏复杂的重塑过程,早期阶段,心脏肥厚是针对各种刺激产生的适应性反应,可以有效的改善心功能,降低心室壁张力。但是,长期持续性的病理性心肌肥厚导致心脏扩张及一系列失代偿反应,最终导致心力衰竭甚至猝死的发生[1]。寻找靶向心肌肥厚发生发展的重要调控因子是预防和治疗病理性心肌肥厚及其所导致的心力衰竭的有效手段。
酸性富含亮氨酸的核磷蛋白32家族成员A(acidic leucine-rich nuclear phosphoprotein 32 family member A, Anp32a),属于进化上保守的蛋白质家族,其结构特征是富含亮氨酸残基的氨基端结构域和羧基端酸性末尾。研究表明,Anp32a参与多种细胞生命活动过程的调节,包括RNA转运、转录,细胞凋亡,囊泡运输和细胞内信号转导[2]。Anp32a在正常组织以及多种癌症,如乳腺癌、胰腺癌和前列腺癌中表达,并且能够抑制乳腺癌和前列腺癌的进展,同时也参与调控神经退行性疾病[3]。笔者以Anp32a敲低和过表达的细胞为研究对象,以探讨Anp32a在血管紧张素Ⅱ(Ang Ⅱ)刺激诱导的心肌细胞肥大中的作用及机制。
1 材料与方法
1.1生物信息数据分析
在GEO数据库(https://www.ncbi.nlm.nih.gov/gds/)中搜索小鼠心脏主动脉缩窄手术(TAC)组的芯片数据,选择GSE5500数据库插入一篇参考文献中假手术(Sham)组与TAC组进行差异分析。使用R软件包affy读取基因芯片的数据,R软件包gcrma对芯片基因的表达量进行标准化,并使用t检验进行差异显著性检验。差异基因筛选标准为差异表达倍数大于2,且统计学检验P值小于0.05。使用R语言ggplot2软件包,绘制基因表达的火山图。
1.2小鼠心脏主动脉缩窄手术
C57背景野生型,SPF级,8~10周龄雄性小鼠,随机分为模型组和假手术组,利用主动脉缩窄手术构建心肌肥厚模型。小鼠称重后,3%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,麻醉成功后,左侧胸部备皮,固定于倒V形板斜面上,进行气管插管并连接呼吸机。用碘酒及75%酒精充分消毒手术区域皮肤3遍,于第二、三肋间距胸骨左缘2 mm处用剪刀分离肋间肌打开胸腔,显微扩胸器将胸部扩开,充分暴露手术视野,钝性分离出主动脉弓降支,将7-0手术丝线穿过血管,垫针平行放置于主动脉上,打结后迅速去除垫针,术毕关闭胸腔。术后密切观察小鼠状态。假手术组钝性分离主动脉降支后仅穿线不结扎,余步骤与模型组一致。
1.3细胞与分子实验
1.3.1分子克隆 引物序列(Anp32a-seq-F CCGCTCGAGATGGAGATGGACAA,Anp32a-seq-R CGCGGATCCGTTAGTCATCCTCTTG),由上海生工生物工程股份有限公司合成,从大鼠cDNA扩增Anp32a,通过XhoI和BamHI酶切与载体pENTR-CMV连接,构建穿梭载体,通过Gateway®LR ClonaseTMⅡ Enzyme Mix(Invitrogen公司)试剂盒将pENTR-CMV-Anp32a载体与pAd-PL-DEST载体重组,得到包装腺病毒的过表达质粒。
针对大鼠Anp32a基因序列设计RNA干扰靶序列GCAGAGAAATGTCCGAACCTT,在该序列基础上合成shRNA正义链:CCGGGCAGAGAAATGTCCGAACCTTCTCGAGAAGGTTCGGACATTTC-TCTGCTTTTTG,反义链:AATTCAAAAAGCAGAGAAATGTCCGAACCTTCTCGAGAAGG-TTCGGACATTTCTCTGC,引物融合后与AgeI和EcoRI酶切的载体pENTR-U6连接,构建穿梭载体,通过Gateway®LR ClonaseTMⅡ Enzyme Mix(Invitrogen公司)试剂盒将pENTR-U6-Anp32a-shRNA载体与pAd-PL-DEST载体重组,得到包装腺病毒的敲低质粒。
1.3.2细胞转染与感染 重组腺病毒质粒经PacI酶切线性化、纯化,然后转染293A 细胞扩增,最后将多次扩增的病毒液利用氯化铯密度梯度离心-透析联用法进行纯化。利用穿梭质粒上带有的独立启动子表达的GFP来初步判定病毒液的滴度。用纯化后的病毒液感染H9C2心肌细胞24 h后,细胞饥饿处理12 h,加入终浓度为1 μmol/L 的AngⅡ刺激细胞,对照组使用等量PBS混合,刺激时间48 h。
1.3.3蛋白印记(Western blot)检测 提取细胞总蛋白,使用BCA蛋白检测试剂盒(23225; Thermo Fisher Scientific)定量并调平样品浓度,将蛋白样品按30 μg/孔的上样量依次加到SDS-PAGE胶进行电泳,电泳结束后用湿转法转移蛋白至PVDF膜。将转有蛋白的PVDF膜放置TBS中洗去转膜液,5%的脱脂奶粉封闭液室温封闭1 h,加入对应一抗,4℃摇床过夜,次日加入对应二抗,室温孵育1 h,于仪器Bio-RadChemiDocTMXRS+中显影,检测目的条带。文中所用到的一抗包括Anp32a(sc-5652, Santa cruz公司),Anp(A1609, Abclonal公司),β-Mhc(22280-1-AP, Proteintech公司),p-Akt(4060, CST公司),Akt(4691, CST公司),Gapdh(2118, CST公司)。
1.3.4实时荧光定量聚合酶链式反应(qPCR) 使用TRIZOL(15596-026,Invitrogen)提取细胞、小鼠心脏组织总RNA,Nanodrop 2000(Thermo Fisher Scientific,Madison)和凝胶电泳对分离的RNA进行定量并检测其完整性。按照Transcriptor First Strand cDNA Synthesis Kit(4896866001; Roche)说明书逆转录RNA成cDNA。使用LightCycler 480 SYBR Green 1 Master Mix(04887352001,Roche)对PCR扩增产物进行定量。采用Gapdh作为内参基因校准靶基因。文中所用到的引物(武汉擎科创新生物科技有限公司合成)见表1。

表1 qPCR所需的引物序列
1.3.5细胞免疫荧光染色 细胞大小及面积通过细胞免疫荧光染色分析[4]。腺病毒感染24 h后,用AngII及PBS处理H9C2心肌细胞48 h,将细胞置于预热(37℃)的100%甲醇中孵育20 min,以淬取GFP绿色荧光信号,用0.1%Triton X-100于PBS中洗5 min,并用α-辅肌动蛋白(05-384,Merck Millipore,1∶100稀释)染色,加入荧光二抗(驴抗小鼠IgG(H + L)二抗,A21202 ,Invitrogen,1∶200),DAPI封片,于正置荧光显微镜下观察拍照。
1.4统计学方法 所有检测结果均使用平均数±标准差表示,采用SPSS 19.0软件进行统计学分析,两组之间均数比较使用独立样本t检验,多组间均数比较使用单因素方差分析,以P<0.05为差异有显著性。
2 结果
2.1生物信息数据库心脏组织Anp32a的表达
通过挖掘分析数据库(GSE5500)中小鼠心脏组织假手术组与TAC组的芯片数据,发现Anp32a的表达显著下调。如图1所示,红色的点代表TAC手术后表达上调的基因,绿色的点代表TAC手术后表达下调的基因,黑色的点代表没有变化的基因。

图1 火山图
2.2Anp32a在假手术组及TAC组不同时间点心脏组织中的表达
qPCR结果显示Anp32a在两组心脏组织中的mRNA相对表达水平,与假手术组相比,Anp32a在TAC组的表水平随着TAC手术时间延长逐渐降低。见表2。

表2 不同组别Anp32a基因表达
注:与sham组相比,*P<0.05
2.3AdAnp32组及AdGFP组细胞大小及心肌肥厚指标表达水平的比较
Western blot显示AdAnp32感染细胞其蛋白表达水平增加(见图2A),在AdAnp32a感染心肌细胞24 h后,AngII刺激48 h,免疫荧光染色结果显示AdAnp32a组细胞明显小于AdGFP对照组(见图2B)。Image-Pro Plus 6.0分析计数400倍显微镜下心肌细胞面积(cell surface area, CSA),结果见表3。进一步裂解细胞取其上清,通过qPCR进行心肌肥厚相关基因Anp、Bnp、β-Mhc的检测。如表4所示,AdAnp32a组与其对照AdGFP组相比,Anp、Bnp、β-Mhc基因表达水平降低。
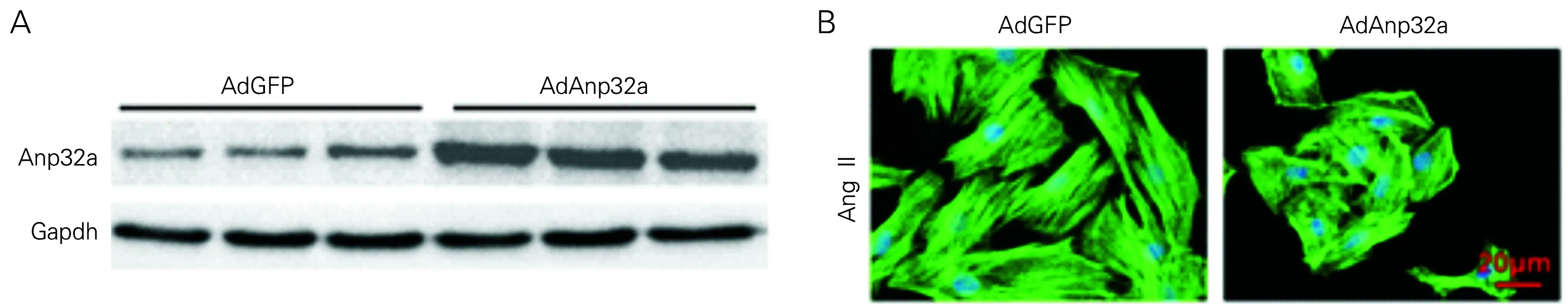
图2 AdGFP组和AdAnp32a组蛋白表达(A)和免疫荧光染色(B)

表3 两组细胞大小面积统计/μm2
注:与AdGFP组比较,*P<0.05

表4 不同组别心肌肥厚基因表达
注:n=3次重复实验。与对照组比较,*P<0.05
2.4AdshAnp32组及AdshRNA组细胞大小及心肌肥厚指标表达水平的比较
Western blot显示AdshAnp32感染细胞检测Anp32a蛋白表达水平明显降低(见图3A),细胞免疫荧光染色结果显示AdshAnp32a组细胞较AdshRNA对照组明显增大(见图3B)。细胞面积分析结果见表5。提取细胞总RNA,qPCR检测两组Anp、Bnp、β-Mhc的基因表达,AdshAnp32a上述基因表达较其对照组明显升高,见表6。

图3 两组Western blot结果(A)和细胞免疫荧光染色(B)

表5 两组细胞大小面积统计/μm2
注:与AdshRNA组组比较,*P<0.05
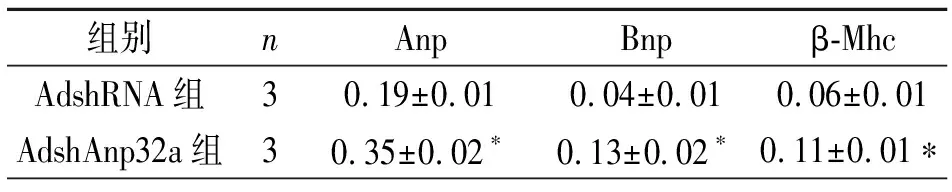
表6 两组心肌肥厚基因表达
注:n=3次重复实验。与AdshRNA组比较,*P<0.05
2.5Anp32a对AKT信号通路的影响
如图4所示,与PBS对照组相比,AngⅡ刺激条件下,Anp、β-Mhc、Akt磷酸化蛋白的水平升高,过表达Anp32a能抑制其升高。

图4 Anp、β-Mhc、p-Akt的蛋白表达
3 讨论
本研究采用Anp32a敲低和过表达的H9C2心肌细胞为研究对象,通过AngⅡ刺激来探讨Anp32a基因在心肌细胞肥大中的作用。实验结果显示Anp32a在心肌肥厚模型中表达显著降低,这与Gao等[5]研究结果相似。过表达Anp32a明显减轻AngⅡ刺激诱导的心肌细胞肥大,并且显著降低Akt的磷酸化水平。因此,Anp32a可能通过抑制AKT信号通路,在AngⅡ刺激诱导的心肌细胞肥大过程中起到负调节作用。
Anp32a家族的成员被广泛认为是核-质穿梭蛋白,涉及不同的信号转导途径及许多重要的细胞过程,包括增殖、分化、细胞凋亡、肿瘤抑制、调节mRNA运输和稳定性、抑制组蛋白乙酰转移酶和基于微管功能的调节。Anp32a结构上由富含亮氨酸重复序列(LRRs)结构域的高度保守的N-末端和主要由聚谷氨酸组成的C-末端组成,其中前者是介导蛋白质-蛋白质相互作用的基序[6]。在当前的研究中,我们发现Anp32a能够在心肌细胞中表达,且在病理性心肌肥厚中表达显著下调。通过构建腺病毒介导Anp32a敲低和过表达的质粒,我们首次发现Anp32a敲低(AdshAnp32a)能够促进心肌细胞肥大,而Anp32a过表达(AdAnp32a)则抑制这一过程。
病理性心肌肥厚发病机制复杂,包括G蛋白偶联受体(GPCR)、丝裂原活化的蛋白激酶(MAPK)级联、钙调磷酸酶-NFAT通路(calcineurin-NFAT circuit)、磷脂酰肌醇3-激酶-丝氨酸/苏氨酸激酶(PI3K-AKT)信号通路等[7-8]在内的多种细胞内信号通路在心肌肥厚的发生发展中发挥关键调控作用。其中,S473和T308介导的AKT磷酸化激活在细胞存活、增殖、代谢、生长等方面发挥重要作用。值得注意的是,在出生后的心脏中,PI3K-AKT-FOXO轴调节心肌细胞大小,其中AKT和FOXO3a的磷酸化水平与体内心脏肥大呈正相关[9]。我们的研究结果显示,AdAnp32a能够抑制AngII刺激诱导的病理性心肌肥厚中磷酸化的AKT水平的上调。此外,Anp32a是磷酸酶2A(PP2A)的强效抑制剂[10],而PP2A是参与调控细胞多种基本功能的重要丝氨酸/苏氨酸磷酸酶[11]。PP2A可能参与Anp32a-AKT调控的病理性心肌肥厚。
综上所述,本研究发现Anp32a在心肌细胞肥大模型中表达降低,过表达Anp32a可有效抑制心肌细胞肥大,这一作用可能是通过抑制AKT等信号通路实现的。因此,靶向Anp32a可能成为预防和治疗病理性心肌肥厚的新策略。
1 Benjamin EJ, Blaha MJ, Chiuve SE, et al. Heart Disease and Stroke Statistics——2017 Update: A Report From the American Heart Association [J]. Circulation, 2017, 135(10): p. e146
2 Opal P, Garcia JJ, McCall AE, et al. Generation and characterization of LANP/pp32 null mice [J]. Mol Cell Biol, 2004, 24(8): 3 140
3 Huyton T, Wolberger C. The crystal structure of the tumor suppressor protein pp32 (Anp32a): structural insights into Anp32 family of proteins [J]. Protein Sci, 2007, 16(7): 1 308
4 Deng KQ, Wang A, Ji YX, et al. Suppressor of IKKε is an essential negative regulator of pathological cardiac hypertrophy [J]. Nat Commun, 2016, 7: 11 432
5 Gao J, Li Y, Wang T, et al. Analyzing gene expression profiles with preliminary validations in cardiac hypertrophy induced by pressure-overload [J]. Can J Physiol Pharmacol, 2018
6 Matilla A, Radrizzani M. The Anp32 family of proteins containing leucine-rich repeats [J].Cerebellum, 2005, 4(1): 7
7 Heineke J, Molkentin JD. Regulation of cardiac hypertrophy by intracellular signalling pathways [J]. Nat Rev Mol Cell Biol, 2006, 7(8): 589
8 Manning BD, Toker A. AKT/PKB signaling: navigating the network [J]. Cell, 2017, 169(3): 381
9 Skurk C, Izumiya Y, Maatz H, et al. The FOXO3a transcription factor regulates cardiac myocyte size downstream of AKT signaling [J]. J Biol Chem, 2005, 280(21): 20 814
10 de Chiara C, Menon RP, Pastore A. Structural bases for recognition of Anp32/LANP proteins [J]. FEBS J, 2008, 275(10): 2 548
11 Costanzo RV, Vilá-Ortíz GJ, Perandones C, et al. Anp32e/Cpd1 regulates protein phosphatase 2A activity at synapses during synaptogenesis [J]. Eur J Neurosci, 2006, 23(2): 309

