白细胞介素1β对左侧星状神经节功能和活性的影响*
赖燕秋 王宇虹 邓洁琳 孟冠南 王梦龙 黄兵 余锂镭 江洪
左侧星状神经节(LSG)是自主神经系统中支配心脏的重要交感神经链,交感神经节前纤维在LSG处换元并发出节后纤维调控心脏功能,其活性增高可促进缺血性室性心律失常的发生[1-2],抑制其活性可降低心律失常严重程度[3]。既往研究已证实系统性炎症反应与心律失常密切相关[4]。在缺血性室性心律失常患者中,炎症因子如白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-2(IL-2)等在血清中的水平较正常人明显升高[5-6]。同时,Rizzo等[7]发现,长QT综合征患者或儿茶酚胺敏感性室性心动过速患者的LSG内有大量炎症细胞浸润,炎症活性明显增强。目前,关于炎症反应与外周自主神经的研究已有大量报道[8-10],但是炎症因子的增多对自主神经节及心脏电生理稳定性影响的研究甚少。笔者推测IL-1β可能通过作用于LSG从而参与增加心脏电生理的不稳定性,故将适量IL-1β局部注入LSG中,观察其干预30 min后对LSG功能和神经活性的影响。
1 材料与方法
1.1实验动物准备 本实验经武汉大学动物实验伦理委员会审核并批准。12只健康成年杂种犬(体重16~20 kg)由武汉大学实验动物中心提供。将12只犬随机分为IL-1β组(n=6)和对照组(n=6)。使用戊巴比妥钠静脉麻醉(30 mg/kg),以2 mg·kg-1·h-1维持麻醉状态。行气管插管连接呼吸机给予正压通气。开通左侧股动静脉通道,经股静脉持续滴注生理盐水(50~150 ml/h)以补充实验过程中液体损失量;经股动脉置管监测动脉血压。将4个电极片分别固定于犬的四肢表皮,监测体表心电图。
1.2IL-1β注射及生理盐水注射 于左侧第三肋间开胸术,暴露LSG,解剖学位置见图1。IL-1β组向LSG中缓慢注射0.1 ml IL-1β (20 μg/ml),而对照组向LSG中缓慢注射0.1 ml 0.9%生理盐水。
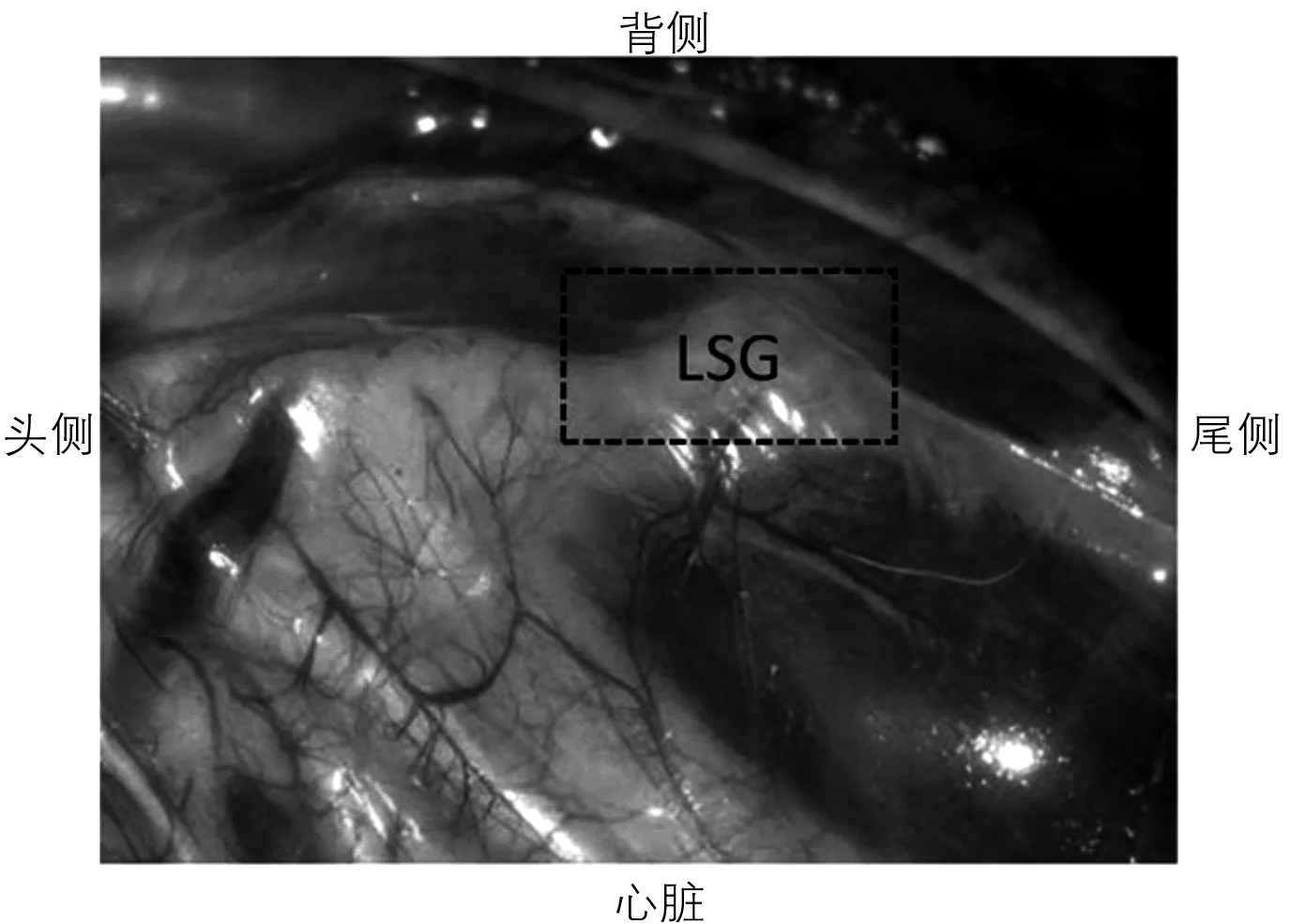
LSG =左侧星状神经节
1.3LSG功能测定 将一根直径为0.1 mm的刺激导线的一端链接于Grass刺激仪(Grass-S88,Grass Instruments,Quincy,MA),另一端放置在LSG表面,在其不同部位发放电压为15 V的高频电刺激(HFS:频率20 Hz,脉宽0.1 ms)30 s,观察不同部位刺激LSG时的血压升高幅度(图2),将刺激时血压升高幅度最大的部位定为血压变化最大的位点,在该处固定刺激导线。在基础状态和LSG局部注射30 min后分别记录每组在不同强度的电压(刺激电压依次为5、10、15、20、25 V)刺激LSG所引起的最大血压变化幅度,用最大收缩压(SBP)改变反映LSG功能。

图2 高频电刺激LSG后心电图(Ⅱ导联)和血压改变情况
1.4LSG活性测定 将三个涂钨的微电极并列固定在轻型固定器上,并调整使其尖端之间距离约2~3 mm,微电极尖端插入LSG中以接触神经元,电极的另一端接入PowerLab神经活性记录仪(8/35,AD Instruments,Australia)。在基础状态下和LSG注射30 min后分别记录1 min的LSG神经活性,最后用labChart Pro软件对神经节放电频率和振幅进行分析。
1.5统计学分析 本实验所有数据均以平均数±标准差表示。采用Graphpad5.0系统进行统计学分析。采用独立样本t检验或配对t检验进行组间或组内比较。以P<0.05为差异有显著性。
2 结果
2.1两组干预对LSG功能的影响 与基础状态相比,IL-1β组注射IL-1β 30 min后HFS刺激LSG所引起的最大SBP改变显著增强(P<0.05),而对照组注射生理盐水30 min后最大SBP改变未见明显变化(P>0.05)。干预30 min后,IL-1β组最大SBP改变显著高于对照组(P<0.05)。见表1。
2.2两组干预对LSG神经活性的影响 与基础状态相比,IL-1β组中注射IL-1β 30 min后LSG神经放电频率和振幅均显著增加(P<0.05),而对照组注射生理盐水30 min后LSG的神经活性频率和振幅均无明显改变(P>0.05)。干预30 min后,IL-1β组LSG神经活性显著高于对照组(P<0.05)。见图3和表2。

表1 两组在不同刺激电压下的最大血压变化幅度/%
注:与同组基础状态(BS)相比,*P<0.05;与对照组相同时间相比,#P<0.05

A:在基础状态下和0.9 %生理盐水干预30 min后,对照组LSG的神经活性。B:在基础状态下和IL-1β干预30 min后,IL-1β组LSG的神经活性

表2 两组干预对LSG神经放电频率和振幅的影响
注:与同组基础状态(BS)相比,*P<0.05;与对照组相同时间相比,#P<0.05
3 讨论
自主神经系统在心血管功能的调节方面发挥重要作用。生理状态下,交感神经和副交感神经活性处于动态平衡,而绝大部分心脏疾病的发生或恶化都与交感神经的过度激活有关。大脑中,下丘脑的室旁核(PVN)是整合交感神经活性和调节心血管功能的中心环节[11]。在心力衰竭大鼠中,PVN内的神经传递素和促炎因子表达水平均升高,从而导致交感神经活性增高[11]。而LSG是自主神经系统在外周参与支配心脏的重要交感组成部分,其活性过度升高在缺血性室性心律失常的发生和维持中发挥重要作用[12]。Rizzo等[7]首次在临床发现,遗传性心律失常患者的LSG中出现大量炎性细胞浸润,恶性室性心律失常的发生可能与LSG中炎症因子的增多有关。Wang等[8]在心肌缺血的犬模型中初步验证了这一观点,他们发现用IL-1β干预LSG发生神经重构增强其活性和功能,促进缺血性心律失常的发生。
IL-1β是IL-1家族的重要成员之一,主要由固有免疫系统中活化的单核细胞、巨噬细胞产生,具有强大的促炎作用,可促进其他炎症因子的大量产生,并与其他炎症因子起到协同效应,引发“炎症级联反应”[14]。有研究表明,大脑中IL-1β水平的升高可激活中枢神经系统,增强交感神经信号的流出,同时可使心脏交感传入神经环路活性增强[13]。PVN中的IL-1β增多可激活下丘脑-垂体-肾上腺轴(HPA轴),同时增强交感神经活性[15]。此外,IL-1β可通过作用于外周感觉神经元表面的IL-1β受体(IL-1βR),激活细胞内MAPK信号通路以及其他信号通路从而增加神经元胞膜的兴奋性,起到一个快速局部神经调节的作用[16]。因此,IL-1β是免疫系统与交感神经系统之间的一个重要媒介。
由此可见,机体的炎症反应对外周神经和心脏稳定性有着重要影响。而本研究的探讨揭示了IL-1β干预LSG 30 min后对其功能和神经活性的影响,实验结果显示,IL-1β能够显著增强LSG功能,而且在体神经活性记录进一步表明了LSG神经活性被明显激活。本实验提示IL-1β可能通过直接调节自主神经的活性从而参与缺血性室性心律失常的发生和维持,或许可以为临床上应用抗炎药物阻止心律失常的形成提供新思路。
1 Ajijola OA, Shivkumar K. Neural remodeling and myocardial infarction: the stellate ganglion as a double agent[J]. J Am Coll Cardiol, 2012, 59(10):962
2 Han S, Kobayashi K, Joung B, et al. Electroanatomic remodeling of the left stellate ganglion after myocardial infarction[J]. J Am Coll Cardiol, 2012, 59(10):954
3 周文杰, 周丽平, 余锂镭,等. 低频电磁场刺激对左侧星状神经节功能的影响[J]. 中国心脏起搏与心电生理杂志, 2016,30(5):436
4 Golia E, Limongelli G, Natale F, et al. Inflammation and cardiovascular disease: from pathogenesis to therapeutic target[J]. Current Atherosclerosis Reports, 2014, 16(9):435
5 Lewek J, Kaczmarek K, Cygankiewicz I, et al. Inflammation and arrhythmias: potential mechanisms and clinical implications[J]. Expert Review of Cardiovascular Therapy, 2014, 12(9):1 577
6 Wu N, Xu B, Xiang Y, et al. Association of inflammatory factors with occurrence and recurrence of atrial fibrillation: A meta-analysis[J]. International Journal of Cardiology, 2013, 169(1):62
7 Rizzo S, Basso C, Troost D, et al. T-cell-mediated inflammatory activity in the stellate ganglia of patients with ion-channel disease and severe ventricular arrhythmias[J]. Circulation Arrhythmia & Electrophysiology, 2014, 7(2):224
8 Wang M, Li S, Zhou X, et al. Increased inflammation promotes ventricular arrhythmia through aggravating left stellate ganglion remodeling in a canine ischemia model[J]. International Journal of Cardiology, 2017,248(1):286
9 Allison DJ, Aysha T,Kayleigh B, et al. Targeting inflammation as a treatment modality for neuropathic pain in spinal cord injury: a randomized clinical trial[J]. Journal of Neuroinflammation,2016,13(1):152
10 Skaper SD, Facci L, Zusso M, et al. Neuroinflammation, mast cells, and glia: dangerous liaisons[J]. Neuroscientist, 2017:107 385 841 668 724
11 Swanson LW, Sawchenko PE. Hypothalamic integration: organization of the paraventricular and supraoptic nuclei[J]. Annual Review of Neuroscience, 1983, 6(6):269
12 Wang S, Zhou X, Huang B, et al. Noninvasive low-frequency electromagnetic stimulation of the left stellate ganglion reduces myocardial infarction-induced ventricular arrhythmia[J]. Scientific Reports, 2016, 6:30 783
13 Yalta T, Yalta K. Systemic inflammation and arrhythmogenesis: a review of mechanistic and clinical perspectives[J]. Angiology, 2017(1):000 331 971 770 938
14 Tsai SJ. Effects of interleukin-1beta polymorphisms on brain function and behavior in healthy and psychiatric disease conditions[J]. Cytokine & Growth Factor Reviews, 2017,37:89
15 Kang YM, He RL, Yang LM, et al. Brain tumour necrosis factor-α modulates neurotransmitters in hypothalamic paraventricular nucleus in heart failure[J]. Cardiovascular Research, 2009, 83(4):737
16 Chiu IM, von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology[J]. Nature Neuroscience, 2012, 15(8):1 063

