犬高频起搏诱发心房颤动模型心房电活动及神经重构机制研究*
胡嘉禄 唐敏娜 张峰 敖登 雷芾华
心房的电重构、神经重构和结构重构在触发和维持心房颤动(atrial fibrillation,AF)中发挥着重要的作用[1-3]。目前国内外制作自主神经介导AF的模型,均是用400~500次/分(bpm)频率起搏心房,并同步刺激心脏自主神经[4-5]。以此方法制作的自主神经介导AF的动物模型,同时有心房肌的神经重构和电重构,因此无法单独解释神经重构介导的AF发生机制。已有基础和临床研究研究报道,以1 200 bpm频率起搏右房,因起搏频率短于心房不应期而不能夺获心房,故而可以单独刺激心房内神经丛,制作心脏自主神经单因素诱导的AF模型[6]。笔者通过比较500 bpm和1 000 bpm频率起搏高位右房、刺激右位迷走神经干(RVNT)对AF的诱发和维持,以及对心房肌电重构及神经重构的影响,阐明1 000 bpm频率起搏高位右房在制作心脏自主神经介导AF模型中的作用,以及指导临床干预自主神经治疗AF的潜在价值。
1 材料与方法
1.1实验动物和麻醉 动物中心提供健康成年比格犬48条,雌雄不限,体重15~20 kg,随机平均分为6组,每组8只。A组:对照组,以105%基础心率频率起搏高位右房(夺获心房);B组:以500 bpm频率起搏高位右房;C组:以1 000 bpm频率起搏高位右房;D组:刺激RVNT;E组:以500 bpm频率起搏高位右房+刺激RVNT,F组:以1 000 bpm频率起搏高位右房+刺激RVNT。术前采用超声心动图,排除瓣膜型心脏病和先天性心肌病等器质性心脏病。研究方案经过动物伦理审查(IACUC-20170325009)。术前12 h禁食,6 h禁饮,氯胺酮(20 mg/kg)基础麻醉,3%戊巴比妥钠泵维持麻醉。备皮、固定、气管插管和辅助呼吸,氧流量4~6 L /min、潮气量10 ml /kg。Lead7000电生理仪(四川锦江电子科技有限公司)Ⅱ导联记录和监测体表心电图,监测生命体征。
1.2高位右房起搏和心电活动记录 分离右侧颈外静脉,经右侧颈外静脉置4极电极导管于高位右房,记录高位右房内心电图。取卧位,沿左侧第四肋间开胸,切开心包暴露心脏。分别将4极导管缝在左上肺静脉、左下肺静脉和左心耳,记录清晰的局部的心内膜电位,关闭胸腔。使用 DF-3A 型电生理刺激仪(苏州中国东方电子仪器厂),以105%基础心率、500 bpm和1 000 bpm的刺激频率,2倍舒张期阈值电压,2 ms脉宽,S1S1模式持续起搏高位右房12 h,并记录体表心电图。
1.3AF诱发率和AF持续时间测定 AF诱发方法:起搏后每2 h,使用电生理刺激仪,以300 ms Burst刺激高位右房30 s,重复刺激诱发5次,记录AF的诱发次数和持续时间。AF定义为心房无序的电活动,心电图表现为P波消失,代之以大小不等、间隔不均、形态不一的f波,频率450~600次/分,RR间期不等,持续5 s以上,自发或诱发出的AF持续时间≥5 min为持续性AF。AF诱发率=成功诱发次数/总诱发次数,AF持续时间=总AF持续时间/AF诱发次数。
1.4心内电生理指标测定 ①有效不应期(ERP)测定:高位右房起搏后,每2 h测定右房的ERP。ERP测定:S1S2以300 ms/280 ms开始,以步长5 ms递减,直至不能夺获心房的最长S1S2间期,测量3次ERP取其均值。
②ERP离散度(ERPd)计算:本研究取各时间点左右心房的ERP最大值减去最小值代表ERPd。
1.5心率变异性(HRV)测定 电生理仪监测体表心电图(ECG),每次待心电信号稳定后,使用LabChart7软件,记录起搏后每2 h的ECG。每次分析0.5 h内的HRV的高频(HF)与低频(LF)成分之比(HF/LF)。
1.6神经刺激及神经信号记录 右侧颈部切开皮肤,分离犬RVNT并置入双极针状电极,并用自制神经信号记录电极采集迷走神经干信号,固定电极并缝合皮肤。锁骨上窝切开皮肤,逐层分离暴露星状神经节(SG),并固定自制神经信号记录电极于SG,缝合皮肤。连接双极针状电极于Grass刺激仪上(赞德仪器有限公司) ,以1~8 V电压, 20 Hz频率, 0.05~0.1ms脉宽,刺激RVNT至心率显著降低50%基础心率。神经信号记录电极连接Powerlab电生理记录仪(AD Instruments公司), 采集并记录神经放电信号。采用LabChart Pro专业版数据采集分析软件,分析起搏前后每2 h的SG和RVNT的放电信号幅度、信号面积和放电时程,每小时任取300 s神经信号图形做分析。
1.7统计学方法 采用SPSS 17.0统计软件进行常规统计,计量资料采用均数±标准差表示,计数资料采用构成比表示,组间比较采用重复测量的方差分析,两两之间比较采用独立样本t检验,以P<0.05为差异有显著性。
2 结果
2.1AF诱发率及AF持续时间 48条犬均完成实验。高位右房起搏2~6 h,各组AF诱发率,随着起搏时间的延长而显著增加(P<0.05),起搏8 h后,AF的诱发率将不再显著增加(P>0.05)。与A组比较,B、D组各时间点AF诱发率显著增加。与B组比较,C、E组AF诱发率显著增加。与C组比较,F 组的AF诱发率显著降低(表1)。
各组AF维持时间,随着起搏时间的延长而显著增加(P<0.05)。与A组相应时间点比较,B组的AF维持时间增加,但没有达到统计学意义(P>0.05)。与A和B组相应时间点比较,C组的AF维持时间显著增加(P>0.05)。与A组相应时间点比较,D组的AF维持时间显著增加(P>0.05)。与B组相应时间点比较,E组的AF维持时间显著增加(P>0.05)。与C组相应时间点比较,F组的AF维持时间显著减少(P>0.05)(表2)。500 bpm起搏高位右房,右房心内电激动表现为颤动传导,而左房心内膜电激动表现为规整的心房传导。1 000 bpm起搏高位右房,左右心房的心内电激动均为激动颤动传导(图1)。
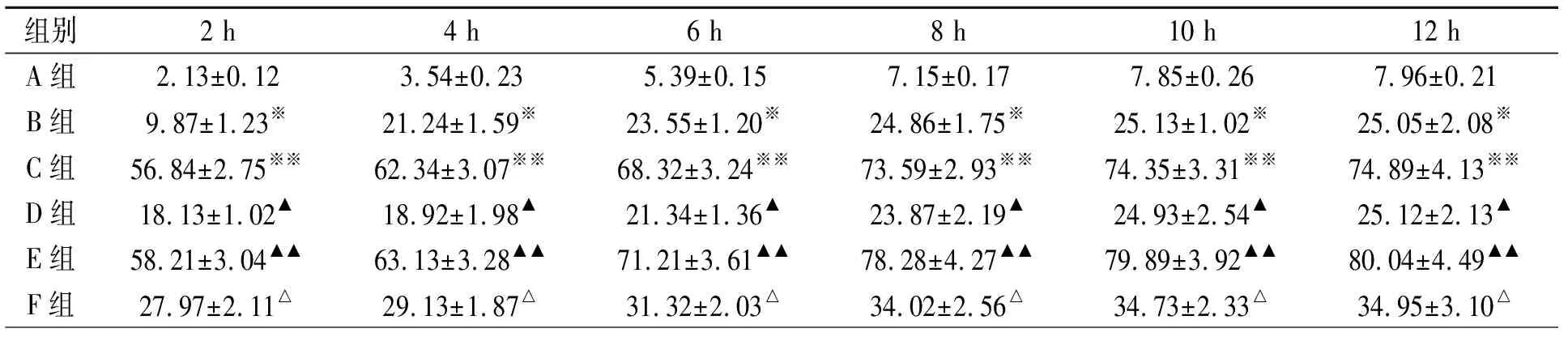
表1 起搏不同时间右房AF诱发率/%(n=40)
注:与A组相应时间点比较,*和▲P<0.05。与B组相应时间点比较,※※和▲▲P<0.05。与C组相应时间点比较,△P<0.05

表2 起搏不同时间右房AF维持时间/min(n=40)
注:与B组相应时间点比较,*和▲P<0.05。与A组相应时间点比较,※※P<0.05。与C组相应时间点比较,△P<0.05
2.2心房肌ERP及ERPd改变 高位右房起搏2~6 h后,各组的AERP均显著缩短,8 h缩短达到高峰(P<0.05)。与A组相应时间点比较,B组的ERP缩短程度显著增加P<0.001。与A组相应时间点比较,C组的ERP缩短程度显著增加,但与B组相应时间点比较,ERP缩短程度显著显小。与A组相应时间点比较,D组的ERP缩短程度显著增加P<0.05。与B组相应时间点比较,E组的ERP缩短程度显著增加P<0.001(表3)。
高位右房起搏,右心房ERPd均出现显著变化,与A组相应时间点比较,B、C、D、E和F和的ERPd显著增加,但B组和E组的ERPd显著大于其它各组(P<0.001)(表4)。
2.3神经信号变化 各组在各观察时间点,均有神经信号的动态变化。A组的RVNT神经放电幅值大于SG。B组的RVNT和SG神经放电幅值同等,与基础对照,没有显著增加。C组的SG神经放电幅值显著增加,RVNT神经放电幅值显著减小。D组的RVNT和SG放电时程等同减少,RVNT神经放电幅值强于SG放电幅值。与B组比较,E组的RVNT和SG神经放电幅值等同减少,但放电时程显著增加。与C组比较,F组的SG放电幅值显著减小,RVNT神经放电幅值增加(图2)。
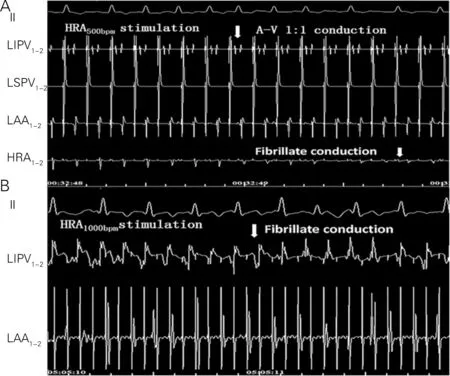
A图:500 bpm高右房起搏诱发AF,高右房1,2电极(HRA1-2)显示心房颤动传导,左心耳1,2电极(LAA1-2)和左下肺静脉1,2电极(LIPV1-2)显示心房规则的房性心动过速传导和房-室(A-V)1∶1传导。B图:1 000 bpm右房起搏诱发AF,LAA1-2和LIPV1-2,显示心房颤动传导
2.4HRV的HF/LF变化 起搏12 h后,与A组相应时间点比较,B组的HF/LF值无显著变化。与A、B组比较,相应时间点比较,C组的HF/LF值显著减小(P<0.05)。与A组相应时间点比较,D组的HF/LF值显著增加(P<0.05)。与B组相应时间点比较,E组的HF/LF值显著增加(P<0.05)。与C组相应时间点比较,F组的HF/LF值增加(P>0.05)(表5)。
3 讨论
为探究AF发生发展的电重构和神经重构机制,建立符合临床AF病因与发病机制的模型至关重要[1],AF模型的临床疾病代表性是目前关注的重点。
快速起搏心房制作动物AF模型已有近50年的历史,400~600 bpm频率起搏是当今多数研究中心采用的制作心房肌“电重构”改变为主的AF模型的方法。起搏心房并同步电刺激RVNT、心脏神经丛、SG和肾交感神经等,或施以干预自主神经的药物如阿托品和去甲肾上腺素等,能够将AF模型的诱发率从20%提高到89%,也是当前国内外制作自主神经介导AF模型共识的方法[6-8],然而该模型因同步起搏心房和电刺激神经,产生了心房肌的神经和电重构共存改变,无法解释神经重构单一因素介导AF的发生机制。

表3 起搏不同时间右房ERP缩短程度/%(n=8)
注:与A组相应时间点比较,*P<0.05;※※P<0.05。与A组相应时间点比较,▲P<0.05。与B组相应时间点比较,▲▲P<0.001
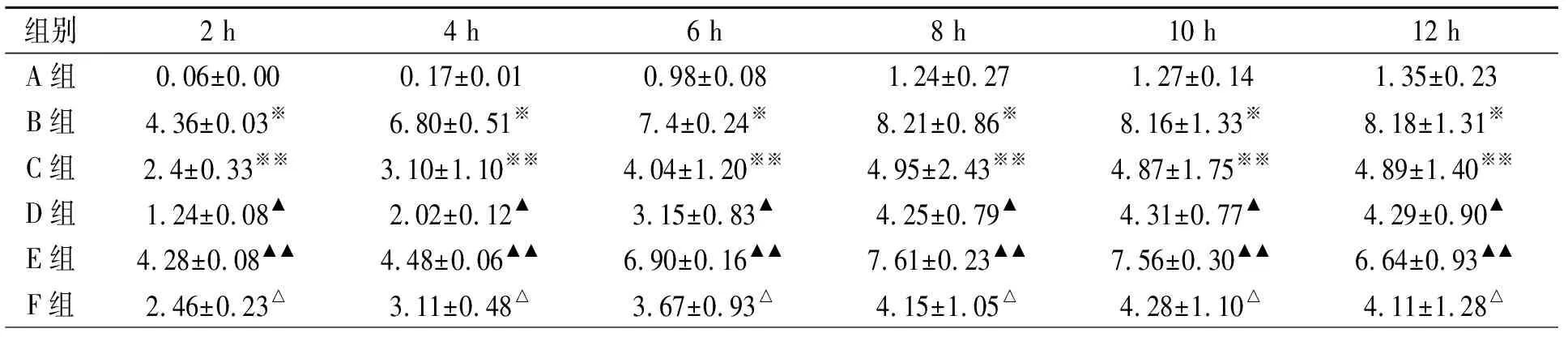
表4 起搏不同时间右房ERPd变化/ms(n=8)
注:与A组相应时间点比较,※P<0.001;※※P<0.05;▲P<0.05;▲▲P<0.001;△P<0.05
本研究观察了犬500 bpm和1 000 bpm起搏高位右房、刺激RVNT、500 bpm起搏高位右房+刺激RVNT和1 000 bpm起搏高位右房+刺激RVNT,干预12 h,右房的AF诱发率和维持时间、AERP、AERPd、HF/LF、RVNT和SG的神经信号变化。笔者发现:500 bpm起搏高位右房,主要产生心房肌的电重构改变。1 000 bpm起搏高位右房,心房肌产生以交感神经重构为主的改变。RVNT产生迷走神经重构为主的改变。500 bpm起搏高位右房+刺激RVNT,产生迷走神经重构合并电重构为主的改变。

A组:RVNT(蓝色)神经放电幅值大于SG(红色)。与A组比较,B组的SG和RVNT神经放电幅值没有显著增加;C组的SG神经放电幅值显著增加,RVNT神经放电幅值显著减小;D组的RVNT神经放电幅值显著增加,SG放电幅值显著减小;E组的RVNT和SG放电幅值等同减少,RVNT放电幅值大于SG放电幅值,但放电时程显著增加。与C组比较,F组SG放电幅值显著减小,RVNT神经放电幅值增加
笔者提出以500 bpm起搏高位右房,1 000 bpm起搏高位右房,刺激RVNT或500 bpm起搏高位右房+刺激RVNT,分别可以制作出心房电重构、交感神经重构、迷走神经重构以及迷走神经重构合并心房电重构的AF模型。
3.1500 bpm起搏高位右房诱发AF 本研究发现,500 bpm起搏高位右房,右房出现了不规则的颤动传导,而左房仍然是规律的激动传导,这种左右房间的电激动的传导差异,造成了心房AERPd显著增大。Allessie等[9]的研究发现,400 bpm起搏左房诱发AF,左右心房的AERP缩短不显著,但AERPd显著增大,认为决定AF易感性的因素是AERPd,而非AERP缩短。笔者的研究还发现,500 bpm起搏高位右房诱发AF,HF/LF比值和SG及RVNT神经活动变化不显著,提示500 bpm起搏高位右房诱发AF时,心房肌出现AERPd显著增大的电重构改变,而无显著的神经重构。 因此笔者认为,500 bpm起搏犬高位右房,可以制作电重构AF模型,用以研究AF的电重构机制,也提示在临床心房肌平均颤动频率较低的AF患者,难以从增加干预心脏自主神经治疗策略获益。
3.2刺激RVNT诱发AF 本研究发现,单纯刺激RVNT,能够诱发18%~25%的AF发生,500 bpm起搏高位右房+刺激RVNT,AF的诱发率显著增加到58%~80%。刺激RVNT诱发AF时,心房肌的ERP和ERPd的电重构改变不显著。500 bpm起搏高位右房+刺激RVNT诱发AF时,心房肌出现显著的ERP缩短和ERPd增大的电重构改变。1955年Hoff等[10]用起搏心房并刺激胆碱能神经纤维或心脏灌流乙酰胆碱,制作了“迷走神经介导的AF”模型。认为刺激迷走神经,增加了心房AERP的缩短、AERPd 增加和电传导异常。本研究进一步观察到,刺激RVNT和500 bpm起搏高位右房+刺激RVNT,HF/LF比值显著增大,RVNT的神经活动显著增加,提示出现了显著的迷走神经重构的改变。笔者认为,刺激RVNT,可以制作“迷走神经触发AF”的动物模型,用于研究“迷走神经重构AF”的机制。500 bpm起搏高位右房+刺激RVNT,可以制作“迷走神经介导AF”模型,用于研究“迷走神经重构并心房肌电重构AF”机制研究。提示临床上“迷走神经触发AF”,干预迷走神经,可以获得最佳治疗效益。“迷走神经介导AF”,肺静脉电隔离消融术+迷走神经消融策略,有可能获益更多。

表5 起搏不同时间HRV(HF/LF)比值变化(n=8)
注:与A组相应时间点比较,※、▲、△P均<0.05
3.31 000 bpm起搏高位右房诱发AF Schauerte等[11]研究表明:高频电刺激肺静脉神经节丛,可以引发肺静脉局部电活动增强,从而有利于AF诱发。Scherlag等[12]研究显示:刺激含有神经节丛的心外膜脂肪垫,能在房性早搏刺激的基础上诱发AF。近来有研究报道,以1 200 bpm短于心房肌不应期的快频率起搏右房,因刺激不能夺获心房肌,可以获得刺激心房内的自主神经的效应,易化AF的诱发,可以制作心房肌重构AF模型[6,13],然而对其制作AF模型的可靠性、确切的神经电生理机制,尚无研究报道。
本研究发现,1 000 bpm起搏高位右房,AF的诱发率在57%~79%,AF的维持时间在5~30 min,显著高于500 bpm起搏高位右房。1 000 bpm起搏高位右房,心房肌的ERP和ERPd变化不显著,但HF/LF比值显著降低,SG神经活动信号明显增强。1 000 bpm起搏高位右房+刺激RVNT,显著降低1 000 bpm起搏高位右房的AF诱发率和维持时间,显著逆转了1 000 bpm起搏高位右房HF/LF比值的降低和SG神经活动信号的增强。提示1 000 bpm起搏高位右房诱发AF时,心脏交感神经发生了显著的重构,增加刺激RVNT,抵消了交感活动的增加。本研究表明,1 000 bpm起搏高位右房,可以制作“交感神经张力异常AF”的模型,用于AF交感神经重构机制的研究。提示在临床心房肌颤动频率较高的AF患者,可以获益于干预心脏交感神经治疗。
1 Chen PS, Chen LS, Fishbein MC, et al. Role of the autonomic nervous system in atrial fibrillation: pathophysiology and therapy[J]. Circ Res, 2014,114(9):1 500
2 Ardell JL, Armour JA. Neurocardiology: Structure-Based Function[J]. Compr Physiol, 2016,6(4):1 635
3 Gaspo R, Bosch RF, Talajic M, et al. Functional mechanisms underlying tachycardia-induced sustained atrial fibrillation in a chronic dog model[J]. Circulation,1997, 96:4 027
4 Yuan Y, Jiang Z, He Y, et al. Continuous vagal nerve stimulation affects atrial neural remodeling and reduces atrial fibrillation inducibility in rabbits[J]. Cardiovasc Pathol, 2015,24(6):395
5 Hou Y, Zhou Q, Po SS. Neuromodulation for cardiac arrhythmia[J]. Heart Rhythm, 2016, 13(2):584
6 Yu L, Scherlag BJ, Li S, et al. Low-level transcutaneous electrical stimulation of the auricular branch of the vagus nerve a non-invasive approach to treat the initial phase of atrial fibrillation[J]. Heart Rhythm, 2013,10(3):428
7 Lewis T, Feil HS, Stroud WD. Observation upon flutter fibrillation II:The nature of auriciular flutter[J]. Heart,1920, 7: 191
8 Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation. A study in awake chronically instrumented goats[J]. Circulation, 1995, 92(7): 1 954
9 Allessie MA, Lammwers WJEP, Bonke FM, et al. Total Mapping of atrial excitation during acetylcholine-induced atrial flutter and fibrillation in isolated canine heart[J]. Am J Cardiol, 1982, 44
10 Hoff HE, Geddes LA. Cholinergic factor in auricular fibrillation[J]. J Appl Physiol, 1955, 8:177
11 Schauerte P, Scherlag BJ, Patterson E, et al. Focal atrial fibrillation: experimental evidence for a pathophysiologic role of the autonomic nervous system[J]. Cardiovasc Electrophysiol, 2001, 12(5):592
12 Scherlag BJ, Yamanashi WS, Patel U, et al. Autonomically induced conversion of pulmonary vein focal firing into atrial fibrillation[J]. Am Coll Cardiol, 2005,45(11):1 878
13 Schauerte P.Time for change: cardiac neurophysiology meets cardiac electrophysiology[J]. Heart Rhythm,2013,10(5):758

