血必净注射液对急性百草枯中毒大鼠肺组织中炎性因子表达影响研究
赵艳霞,付 贇,王 鑫
(河北省邯郸市中心医院,河北 邯郸 056001)
百草枯(PQ)合成于上世纪50年代,是联吡啶类非接触型除草剂,其打到草上很快起效,但是遇到土壤就钝化、立刻失效,对植物的根部没有伤害,也不会在土壤中残留,对环境几乎没有影响,因此在农业生产中广泛使用[1]。但是百草枯中毒事件近年来频有发生,其大量口服可引起急性中毒,患者常常在24 h内出现急性肺水肿、动脉血氧分压降低、肝衰竭、肾衰竭等多脏器功能障碍,病死率极高;而小量口服者早期症状不明显,或有轻度胸闷,往往因忽视其严重性而错过最佳治疗时机。由于百草枯排泄缓慢,在肺和肌肉内蓄积,作用持久,肺部逐渐出现炎性渗出,一部分患者发展为进行性呼吸困难、呼吸衰竭而死亡,即使存活的患者也会最终出现肺纤维化,影响生活质量。目前百草枯中毒后出现肺损伤的机制尚未完全阐明,也无特效治疗药物[2]。近年来血必净注射液尝试用于百草枯中毒的治疗,有一定效果,但作用机制不明。本研究观察了血必净注射液对百草枯中毒大鼠肺组织中氧自由基超氧化物歧化酶(SOD)活力、丙二醛(MDA)含量及细胞因子白细胞介素-6(IL-6)、转化生长因子-β1(TGF-β1)表达的影响,旨在探讨血必净注射液治疗百草枯中毒的机制,为其临床应用提供理论基础。
1 实验资料
1.1动物 健康成年Wistar大鼠108只,雌雄不拘,体质量220~270 g,购自河北医科大学实验动物中心,动物合格证号:SCXK(冀)2015-0003。为适应环境,按实验动物标准,饲养于无菌动物室内,保持温度21~24 ℃、湿度40%~50%,自由饮水分笼喂养,垫料、饮用水、饲料每天更换。1周后,精神、饮食活动正常的动物纳入实验。
1.2材料及试剂 20%百草枯原液,山东大成农药股份有限公司生产;血必净注射液,天津红日药业股份有限公司生产,国药准字Z20040033。MDA检测试剂盒及SOD检测试剂盒均购自北京博奥森生物技术有限公司。兔抗鼠IL-6、TGF-β1多克隆抗体、DAB显色试剂盒、SABC二抗试剂盒由福州迈新生物制品有限公司生产。电热恒温水浴箱、台式低速离心机(0412-1)、大鼠代谢笼、DHP-9082型恒温干燥箱均由上海一恒科学仪器有限公司生产,日本OLYPUS公司BX51光学显微镜和-80 ℃冰箱购自日本Sanyo株式会社。德国EG1150H组织包埋机由LEICA公司生产。
1.3动物分组及模型制备 将108只Wistar大鼠随机分成对照组、染毒组、干预组,每组36只。20%百草枯原液用生理盐水溶解,染毒组及干预组按25 mg/kg剂量一次性腹腔注射,对照组给予等体积生理盐水腹腔注射。然后干预组给予血必净注射液4 mL/kg腹腔注射,对照组及染毒组给予等量生理盐水腹腔注射,均每天1次。
1.4取材 每组分别在干预后1,3,7,14,21,28 d各取6只大鼠,取标本前禁食水4 h,使用乙醚进行麻醉,剃光胸部皮肤,乙醇消毒,使用干烧灭菌的组织剪逐层开胸,在左、右支气管处分离,取出肺组织,从肺尖部切取标本,剪掉周围的包膜及结缔组织,用冰盐水清洗血渍,滤纸擦干。标本一部分制备匀浆,一部分制备切片。
1.5SOD活力及MDA含量测定 取肺组织标本称质量,量取9倍于组织块质量的冰盐水,与组织标本一起倒入玻璃匀浆器中,制备10%的组织匀浆,然后以3 000~4 000 r/min速度离心30 min,取上清液,采用黄嘌呤氧化酶法测定SOD活力,采用硫代巴比妥酸(TBA)法检测MDA含量。
1.6HE染色光镜检查及IL-6、TGF-β1表达检测 将肺组织标本放入10%中性甲醛固定,石蜡包埋、切片,厚约5 μm,应用PBS液(pH 7.14)二甲苯脱蜡3次(3 min/次),溶度乙醇(100%→95%→80%→70%)进行水化,切片蒸馏水冲洗后,放入3% H2O2溶液室温孵育30 min以灭活内源性过氧化物酶。随后PBS液冲洗3次(5 min/次),在沸腾的0.01 mol/L枸橼酸缓冲液中放入切片以修复抗原,为减少非正常染色,用10%正常山羊免疫血清封闭游离结合位点,室温放置10 min,滴加一抗工作液(1∶100稀释),兔抗鼠IL-6、TGF-β1多克隆抗体,在4 ℃的冰箱内孵育过夜。之后,用PBS缓冲液代替一抗作阴性对照。PBS缓冲液冲洗3次(5 min/次);滴加生物素标记的二抗工作液,孵育30 min,切片应用PBS液洗刷(5 min×3次);之后再加入辣根过氧化物酶标记的链霉素-卵白素工作液,常温下孵育30 min,PBS液冲洗(5 min×3次);显色剂DAB加入切片中,在显微镜监视下显色2~3 min,显色满意后蒸馏水冲洗切片,终止显色。盐酸乙醇分化,苏木精复染5 min,伊红染色,蒸馏水沖洗返蓝,依次应用梯度乙醇脱水,中性树胶封固,二甲苯Ⅰ、Ⅱ透明。每组任意取5张切片,400倍光学显微镜拍照、观察、保存,每张切片上随机的、相互不重叠10个高倍视野作为观察对象。以细胞结构清晰,在胞浆和/或胞核中出现棕黄色或褐色颗粒状免疫复合物为阳性细胞。Image-Pro Plus(IPP)6.0免疫组化图像软件计算IL-6、TGF-β1的平均吸光值,同时检测背景值,前者减去后者作为该标本的最后结果。
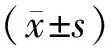
2 结 果
2.1各组大鼠肺组织病理表现 对照组肺表面包膜光滑有弹性,质软呈淡红色,无淤点及水肿;光镜下可见肺泡壁薄,结构完整、清晰,排列整齐,肺泡腔内未见渗出,肺间质无增宽及充血,有少许纤维组织。染毒组肺表面呈暗红色,体积显著膨胀,水肿明显,包膜张力高,表面大片淤斑,在肺边缘外侧有散在的出血点,肺切面有淤血渗出;光镜下可见肺泡壁充血肿胀,结构塌陷,部分肺泡架构破坏,肺泡腔内有纤维素及红细胞聚集,形成粉红色渗出液,其周围组织出血明显,肺间质增厚,气管周围大量炎细胞浸润,血管水肿,主要为淋巴细胞、中性粒细胞、单核巨噬细胞;染毒7 d时肺泡及肺间质水肿达到顶峰,伴散在的肺出血,有多个肺泡形成炎症,表面有透明膜,见图1;染毒21 d时肺间质内炎症较前减轻,有大量成纤维细胞增生;染毒28 d时肺泡膈相互融合,肺间质胶原纤维增厚。干预组肺泡及肺间质病变有不同程度改善,病理学改变介于染毒组与对照组之间,见图2。

图1 染毒组染毒7 d光镜下肺组织病理表现(HE,×400)

图2 干预组干预7 d光镜下肺组织病理表现(HE,×400)
2.2各组大鼠肺组织中SOD活力及MDA含量染毒后,染毒组大鼠肺组织中SOD活力显著降低,此后逐渐上升,但各时间点均明显低于对照组(P均<0.05);干预组各时间点SOD活力均明显高于染毒组(P<0.05),但染毒1~14 d仍明显低于对照组(P均<0.05),染毒21 d、28 d与对照组比较差异均无统计学意义(P均>0.05)。染毒后,染毒组大鼠肺组织中MDA含量迅速升高,3 d达到最高峰,以后呈逐渐下降趋势,但各时间点均明显高于对照组(P均<0.05);干预组染毒1~21 d MDA含量均明显低于染毒组(P均<0.05),但染毒1~14 d仍明显高于对照组(P均<0.05),染毒21 d、28 d与对照组比较差异均无统计学意义(P均>0.05)。见表1。
2.3各组大鼠肺组织IL-6、TGF-β1表达免疫组化染色表现 对照组肺组织中IL-6、TGF-β1表达很少,干预3 d时染色表现见图3及图4;染毒组肺组织中IL-6、TGF-β1大量表达,染毒3 d时达到最高峰,见图5及图6;干预组肺组织中IL-6、TGF-β1表达情况介于对照组和染毒组,干预3 d时染色表现见图7及图8。
2.4各组大鼠肺组织中IL-6、TGF-β1表达情况染毒组各时间点肺组织中IL-6、TGF-β1表达量均明显高于对照组(P均<0.05)。干预组各时间点肺组织中IL-6、TGF-β1表达量均明显低于染毒组(P均<0.05),但仍明显高于对照组(P均<0.05)。见表2。
3 讨 论

表1 各组大鼠肺组织中SOD活力及MDA含量比较
注:①与对照组比较,P<0.05;②与染毒组比较,P<0.05。

图3 对照组干预3 d时IL-6表达情况(×400)

图4 对照组干预3 d时TGF-β1表达情况(×400)

图5 染毒组染毒3 d时IL-6表达情况(×400)

图6 染毒组染毒3 d时TGF-β1表达情况(×400)

图7 干预组干预3 d时IL-6表达情况(×400)

图8 干预组干预3 d时TGF-β1表达情况(×400)

指标组别1d3d7d14d21d28d对照组8.64±0.957.36±0.766.82±0.797.07±0.957.55±0.817.49±0.72IL-6染毒组39.15±2.50①41.18±3.39①38.08±3.40①36.00±3.37①25.51±2.60①20.29±2.28①干预组29.25±2.98①②32.95±3.22①②27.86±3.19①②22.15±2.45①②19.35±2.06①②15.39±1.75①②对照组8.41±1.148.40±1.037.60±0.988.27±1.107.53±1.158.17±1.06TGF-β1染毒组45.80±2.57①51.58±2.86①45.51±2.51①37.19±1.61①31.17±1.45①25.15±1.33①干预组38.76±1.66①②41.14±1.80①②36.98±1.84①②29.51±1.66①②22.38±1.41①②17.21±1.37①②
注:①与对照组比较,P<0.05;②与染毒组比较,P<0.05。
目前研究证明,在哺乳类动物的肺泡上皮细胞中存在多胺类物质摄取系统,多胺类物质在细胞内和百草枯摄取存在竞争性抑制,百草枯进入体内后,被肺上皮细胞主动摄取并转运,在肺组织内大量蓄积;同时由于百草枯在体内代谢缓慢,因此肺成了中毒早期被重点攻击的靶器官[3]。百草枯中毒诱导的肺损伤一般经过肺组织炎症、间质增生及肺纤维化等阶段,早期为炎性渗出期,在肺泡及肺间质内有大量中性粒细胞、淋巴细胞、巨噬细胞浸润,释放炎性因子,导致肺泡上皮细胞的弥漫性水肿及坏死、脱落,之后逐渐进入纤维增生期,肺泡塌陷,成纤维细胞增生,间质增厚,纤维化形成[4]。本实验观察发现,染毒组大鼠肺脏体积明显变大,肿胀明显,呈暗红色,表面散在出血点;光镜下可见气管及血管周围炎性细胞浸润、水肿,肺泡壁结构塌陷,肺泡腔内有水肿液及纤维素渗出,肺间质增厚。以上病理变化均提示百草枯可导致肺损伤,与文献报道一致。但肺损伤确切的发病机制还不十分清楚,目前认为氧自由基、钙超载、缺血/再灌注损伤及毒物本身等在器官损伤中起关键作用,其中氧自由基导致的细胞脂质过氧化反应引人关注[5]。基础实验和临床研究证实,百草枯进入细胞后,其分子作为电子受体,在NADPHⅡ作用下转化为PQ+,再经单电子传递而还原,之后与分子氧作用形成超氧阴离子(O2-)及联吡啶阳离子,百草枯分子通过一系列反应,高活性氧自由基激增,从而引起细胞氧化损伤、脂质过氧化反应以及机体内大量炎症因子的释放[6]。但是高活性的氧自由基不容易测定,因此本实验选择SOD、MDA作为观察指标。SOD是机体内重要的自由基清除酶,能够催化超氧化物进行歧化反应生成氧气和过氧化氢,其作用底物是超氧阴离子自由基, SOD通过调节、清除O2-、OH-等活性氧自由基,抑制过氧化反应,使过氧化物分解为无毒的醇。当氧自由基增多时,SOD被消耗,含量减少,机体清除自由基、抗脂质过氧化损伤的能力下降。MDA是细胞内多聚不饱和脂肪酸发生过氧化反应产生的终末代谢产物,检测其含量可间接反映细胞脂质过氧化损伤的程度。本研究结果显示,肺组织中SOD活力在染毒后即刻下降,在以后时间段里虽有恢复,但仍低于对照组,提示百草枯进入细胞后产生大量有活性的自由基,机体处于氧化应激状态,消耗了细胞内的自由基清除酶;与此同时,染毒大鼠肺组织中MDA含量显著升高,说明细胞脂质过氧化损伤程度严重。上述结果提示百草枯导致脂质过氧化反应增强,诱发肺损伤。
百草枯中毒的分子细胞学研究发现,细胞内炎性因子的产生和释放可能是百草枯中毒导致肺损伤的重要原因[7-8]。IL-6由肺泡巨噬细胞、单核细胞以及T/B淋巴细胞产生,它可以调节应激及免疫反应,诱导淋巴细胞分化成熟及免疫球蛋白的产生,调节单核/巨筮细胞功能,形成免疫复合物;它能激活多个传导通路,如Ras/ERK、JAK/STAT、PI3-K/Akt等,在宿主的炎症调控和防御系统中起至关重要的作用[9]。Xu等[10]和李闯等[11]研究均证实百草枯中毒后IL-6含量即刻升高,于 3~6 d达到较高水平,提示IL-6是百草枯中毒后早期释放的促炎因子,在百草枯导致的肺损伤中起至关重要的作用,它的升高预示组织损伤程度加重。TGF-β1可促进巨噬细胞、单核细胞分裂趋化,促进成纤维细胞向肌成纤维细胞转化,促进细胞外基质积聚,使胶原沉积增加;另外TGF-β1早期可促进脂质过氧化,导致肺水肿加重,晚期可导致肺纤维化,在肺损伤中扮演重要角色[12]。本实验结果发现,染毒第1天,染毒大鼠肺组织中IL-6和TGF-β1即明显升高,第3天达到高峰,此后虽有下降,但仍维持在高水平,推测它们可能参与了肺组织的损伤过程,二者不仅是百草枯中毒早期释放的促炎因子,而且还是中晚期导致肺纤维化的关键因素,在百草枯诱导的肺损伤中发挥了重要作用。
目前,对百草枯中毒无特效解毒药物,许多治疗方法仍处于探索阶段。血必净注射液为国家二类新药,具有疏通经络、活血化瘀的功能,主要由川芎、当归、红花、鱼腥草、丹参、赤芍等组成,其有效成分为丹参素、原儿茶醛、川芎嗪、阿魏酸、红花黄色素,它们具有增加组织耐缺氧能力,清除氧自由基,提高自由基清除酶系的活性,降低毛细血管通透性,减少渗出,改善局部血液循环,降低内毒素水平,对抗单核/巨噬细胞系统释放内源性炎性递质,调节免疫功能作用[13]。赵薇等[14]研究表明,血必净注射液可保护SIRS及MODS等危重症患者的脏器功能,提高救治率。本实验结果显示,干预组大鼠肺泡腔内的渗出、毛细血管扩张、充血以及炎性细胞浸润等病理改变显著好转,说明血必净注射液可抑制病情发展,阻止百草枯对肺的损伤;大鼠肺组织中SOD活性明显高于染毒组,而MDA含量明显低于染毒组,提示血必净注射液具有显著抗氧化作用;大鼠肺组织中IL-6和TGF-β1蛋白表达量明显低于染毒组,说明血必净注射液可抑制百草枯导致炎症因子的过度产生和释放。
综上所述,氧自由基和细胞因子IL-6、TGF-β1均参与了百草枯所致肺损伤,而血必净注射液能够通过调节这些指标表达而减轻染毒大鼠肺组织损伤,为百草枯中毒的治疗提供了一个新途径。
[参考文献]
[1] 中国医师协会急诊医师分会. 急性百草枯中毒诊治专家共识(2013)[J]. 中国急救医学,2013,33(6):484-489
[2] 黄伟. 百草枯急性中毒机制及其治疗研究进展[J]. 临床合理用药杂志,2016,9 (36):188-190
[3] 董建光,邱泽武. 百草枯中毒致肺纤维化的治疗现状[J]. 中国医刊,2017,52(2):23-26
[4] 李书文,沈彦萍. 急性百草枯中毒发病机制与治疗研究进展[J]. 世界最新医学信息文摘,2015,15(97):49-50
[5] 孙百胜,何跃忠. 百草枯中毒机制及临床治疗进展[J]. 中华危重病急救医学,2017,29(11):1043-1046
[6] 廖泳,吴晓飞,王芳莉,等. 百草枯中毒急性肺损伤的作用机制及丙酮酸乙酯干预研究[J]. 安徽医药,2017,21(4):630-634
[7] Jiang YS,Ma YY,Wang ZQ,et al. Therapeutic effects of smeeta or smectite powder on rats with paraquat toxieation[J]. World J Emerg Med,2013,4(2):144-150
[8] 陈寿权,冷巧云,何爱文,等. 急性百草枯中毒大鼠肺泡灌洗液及血清炎性因子变化及姜黄素的干预效果[J/CD]. 灾害医学与救援:电子版,2015,4(4):207-211
[9] 林丽艳,张慧云,何韶衡. IL-6及其受体与炎症性疾病关系的新进展[J]. 中国热带医学,2008,8(4):680-682
[10] Xu LJ,Xu J,Wang Z. Molecular mechanisms of paraquat-induced acute lung injury:a current review[J]. Drug Chem Toxicol,2014,37(2):130-134
[11] 李闯,郝同琴,刘建萍,等. 百草枯中毒患者血清肿瘤坏死因子-α白细胞介素-6及百草枯浓度变化的分析[J]. 中国急救医学,2010,30(8):739-741
[12] Hua XF,Li XH, Li MM,et al. Doxycycline attenuates paraquat-induced pulmonary fibrosis by downregulating the TGF-β signaling pathway[J]. J Thorac Dis,2017,9(11):4376-4386
[13] 王靓,郑云辉. 血必净注射液药理研究进展[J]. 临床医药实践,2016,25(7):542-544
[14] 赵薇,施贤清. 血必净注射液治疗全身炎症反应综合征患者的临床研究[J]. 重庆医学,2015,44(20):2790-2792

