黄芩素对结肠癌细胞PTEN、Akt及p-Akt蛋白表达的影响
宋红群 王宁 李超彦
结肠癌(colorectal cancer,CRC)是世界范围内许多国家恶性肿瘤高死亡率的原因之一[1],在发达国家每年影响人数超过100万人[2],严重威胁着人类健康。在我国恶性肿瘤患者中,结肠癌的发病率和死亡率均较高,发病率居恶性肿瘤发病率的第三位,仅次于肺癌和胃癌,死亡率居第五位[3]。结肠癌易复发和转移,故其病死率较高,预后较差。尽管随着治疗手段的不断改进,结直肠癌的治疗效果得到明显改善,但在2008年的统计中,其病死率仍达8.8%。结肠癌的肿瘤发生及复发转移是多因素参与的复杂过程,除肿瘤细胞微环境的改变外,调节细胞周期、生长及凋亡的相关癌基因和抑癌基因表达异常在其发生过程中起着非常重要的作用[4-6]。
黄芩素属黄酮类物质,主要来源于黄芩的根部。黄芩素具有明显的抗炎活性,且与NF-kappaB的激活关系密切[7]。有研究表明,黄芩素能在人卵巢癌等肿瘤细胞中表现出明显的抗肿瘤作用[8-10]。我们的前期研究显示,黄芩素能够影响结肠癌细胞的增生及凋亡,但其作用机制尚不清楚。本研究以人结肠癌细胞系SW620为对象,观察不同浓度黄芩素对其细胞生长及肿瘤抑制基因PTEN(phosphatase and tensin homologue,PTEN)和Akt蛋白表达的影响,探讨黄芩素的抗肿瘤作用及机制。
1 材料与方法
1.1 实验药物 黄芩素,分子量270.24,黄色粉末,规格100 mg,购自sigma公司(465119),纯度≥98%,易溶于乙醇、甲醇。取黄芩素粉末10 mg,溶于甲醇中,制备成200 μmol/L的溶液备用。使用前用DMEM培养基稀释成所需浓度加入培养细胞中。
1.2 细胞 人结肠癌细胞SW620为51岁白人来源的结肠腺癌发生转移后的淋巴结转移组织,购置于上海生物研究所。
1.3 其他材料 试剂低糖DMEM细胞培养基及胎牛血清购自Gibco公司(11885092,10099-141),MTT购自sigma公司(M2128);EdU检测试剂盒购自Invitrogen公司(C10646);蛋白提取试剂盒购自Calbiochem公司(539790);DMEM培养基及胎牛血清购自Gibco公司(11885092);Transwell小室购自美国BD公司(353093);兔抗人多克隆PTEN、Akt及p-Akt S473抗 体 购 自 ABCam公 司 (ab32199,ab126811,ab66138);山羊抗兔二抗购自北京中杉金桥公司(ZB-5301)。
1.4 方法
1.4.1 细胞培养 复苏冻存的SW620细胞,于含10%胎牛血清的DMEM培养基中进行传代培养,并放置在37℃、5%CO2恒温培养环境中。
1.4.2 EdU染色和MTT法测定细胞增生抑制率SW620细胞常规传代培养,收集对数期生长细胞,消化并制作成细胞悬液,调整浓度为5×104/mL,以100 μL/孔接种于96孔板,5%CO2、37 ℃培养24 h。分别加入相应的黄芩素溶液并使其最终浓度分别为0、25、50、75 μmol/L,继续培养24 h,48 h,每空加入100 μL含有浓度为50 μmol/L的EdU培养基孵育2 h,弃培养基,PBS清洗2次。每孔加入50 μL含4%多聚甲醛的固定液进行固定,室温放置30 min。按照EdU检测试剂盒的说明书进行EdU染色。随后用Hoechst 33342进行细胞核复染。荧光显微镜下观察并记录。实验重复3次。
收集对数生长期的SW620细胞,调整浓度为5×104/mL的细胞悬液,以100 μL/孔接种于96孔板,5%CO2、37℃培养24 h。分别加入相应的黄芩素溶液并使其最终浓度分别为0、25、50、75 μmol/L。继续培养12 h,24 h,36 h,48 h后,每孔加浓度为5 mg/mL的MTT溶液10 μL,孵育4 h后终止后,振荡15 min,选择490 nm波长,在酶联免疫检测仪上测定各孔吸光度OD值,绘制生长曲线。实验重复3次。
1.4.3 Transwell实验检测细胞侵袭能力 将Matrigel稀释浓度为10 μg/μL后,包被Transwell小室,分隔成上下小室。将经不同浓度黄芩素处理48 h后的SW620细胞调整浓度为1×105/mL,取200 μL加入上室,下室加入600 μL的完全培养基,5%CO2、37 ℃环境下培养10 h。取出Transwell小室,并用PBS湿润,然后用棉球擦去上室表面粘附的细胞,PBS洗涤2次。将Transwell小室用4%甲醛溶液固定15 min,乙醇脱水,结晶紫染色,显微镜下观察并计数上室迁移至微孔膜下层的细胞。实验重复3次。
1.4.4 免疫印迹Western blot检测PTEN、Akt及p-Akt S473蛋白的表达 将浓度为5×104/mL的SW620细胞悬液以2 mL/孔的量接种于6孔培养板中,终浓度分别为0、25、50、75 μmol/L的黄芩素处理48 h后,弃去上清液,按照蛋白提取试剂盒的说明进行蛋白提取,并测定其浓度。50 μg/孔总蛋白上样,10%SDS聚丙烯酰胺凝胶电泳分离蛋白,转膜,封闭,洗涤,PTEN、Akt、p-Akt S473,β-actin一抗孵育(1∶1 000),4 ℃过夜,TBS洗涤3次,加入二抗(1∶5 000)孵育,洗涤,ECL显色液显色检测蛋白的表达。实验重复3次。
1.5 统计学分析 本研究中每种检测实验均重复3次,所有数据采用()表示,各实验重复3次,数据均采用SPSS 19.0软件进行统计学分析。统计差异通过t检验或单因素方差分析来进行比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 黄芩素能够抑制人结肠癌细胞的增生 为观察黄芩素对SW620细胞的影响,本研究通过MTT和EdU实验检测了经黄芩素作用后的肿瘤细胞的生长及增生情况(图1~2)。EdU结果显示,各组经0、25、50、75 μmol/L黄芩素处理24 h后处于S期的SW620细胞所所占比例分别为(58.11±5.77)%、(51.62±7.84)%、(48.75±5.44)%、(46.59±3.59)%,与0 μmol/L黄芩素处理组相比,75 μmol/L黄芩素处理组处于S期的细胞比例显著降低(P<0.05);各组经0、25、50、75 μmol/L黄芩素处理48 h后处于S期的结肠癌细胞所占的比例分别为(52.16%±5.05)%、(46.40%±6.75)%、(42.21%±5.21)%、(35.37%±4.12)%,与0 μmol/L黄芩素处理组相比,75 μmol/L黄芩素处理组处于S期的细胞比例显著降低(P<0.01)。MTT结果显示,黄芩素对SW620细胞具有直接抑制作用,并呈现剂量、时间依赖性。
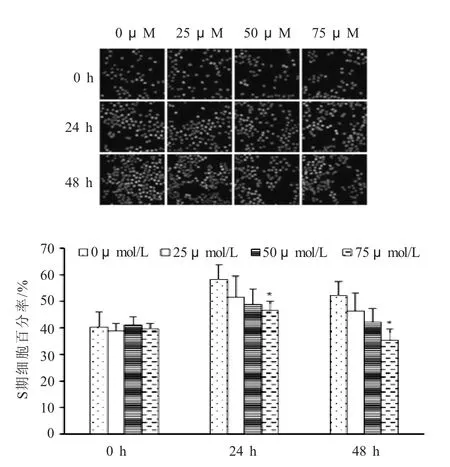
图1 黄芩素对SW620细胞生长的影响

图2 不同处理组SW620肿瘤细胞的生长曲线
2.2 黄芩素能够抑制人结肠癌细胞的侵袭能力通过Transwell小室侵袭实验分析经黄芩素处理48 h后肿瘤细胞的侵袭力变化(图3)。结果显示,相对于0 μmol/L黄芩素处理组,50、75 μmol/L黄芩素处理组细胞迁移数量分别下降18.32%(P<0.05)、40.72%(P<0.01),差异具有统计学意义。

图3 黄芩素对SW620细胞侵袭能力的影响
2.3 黄芩素对PTEN、Akt及p-Akt蛋白表达的影响与0 μmol/L黄芩素处理组相比较,50、75 μmol/L黄芩素处理组PTEN蛋白表达明显高于对照组,p-Akt低于对照组(P<0.05,图4)。

图4 黄芩素对SW620细胞PTEN、Akt及p-Akt表达的影响
3 讨论
来源于传统中药的黄酮类化合物黄芩素在多种肿瘤细胞中显示出明显的抗肿瘤活性。黄芩素能通过表皮生长因子受体通路抑制子宫颈癌细胞的增生[11],通过降低12-LOX mRNA的途径抑制肝癌细胞的增生并诱导细胞的凋亡[12],食管癌细胞体外研究中,黄芩素还可作用于PI3K/Akt信号通路进一步影响肿瘤细胞的增生与凋亡[13]。除影响肿瘤细胞的增生与凋亡外,黄芩素还能够通过影响人胰腺癌肿瘤细胞伪足形成,导致细胞的侵袭力下降[14],通过降低MMP-2、整合素α2表达,抑制MG63细胞的侵袭转移能力[15]。
前期研究表明[16],黄芩素能够显著抑制结肠癌细胞的增生与凋亡,改变凋亡相关基因的表达。本研究通过EdU及MTT实验进一步验证了黄芩素对结肠癌SW620细胞生长的影响。EdU结果表明,较高浓度的黄芩素(50、75 μmol/L)能够显著抑制人结肠癌细胞的DNA复制活性,细胞生长受到影响。MTT结果显示,经黄芩素处理后,肿瘤细胞增生受到抑制,而且和药物剂量及作用时间呈正相关。侵袭及转移能力是恶性肿瘤的重要特征,Transwell小室实验结果表明,黄芩素能够降低结肠癌细胞的侵袭能力。
PTEN是一种人第10号染色体缺失的磷酸酶及张力蛋白同源的基因,通过p53信号传导通路发挥作用[17-18]。PTEN能够使磷脂酰肌醇磷酸酯类3位脱磷酸,其主要作用底物为PIP3,后者可以介导Akt的磷酸化使后者发生活化,其中,p-Akt(ser473)是其主要的活化形式之一。PTEN可以将PIP3脱磷酸为PIP2,抑制Akt的激活,下调PI3K/Akt传导通路,在细胞周期、细胞生长与分化的调控过程中起着重要的作用[19-20]。研究表明,在多种肿瘤的发生中,均存在PTEN基因的表达异常,多种mir-RNA均可通过PTEN/Akt途径影响细胞的增生、侵袭与凋亡[21-24]。本研究WB结果显示,黄芩素能够增加SW620细胞中PTEN蛋白的表达,降低Akt的活化(p-Akt ser473),影响PTEN/Akt调节通路,提示黄芩素对结肠癌肿瘤细胞的影响可能是通过PTEN/Akt途径来实现的。
综上所述,本研究进一步揭示了结肠癌细胞中黄芩素所表现出的抗肿瘤活性及其可能机制,为其临床辅助抗肿瘤应用提供了理论支持,但PTEN/Akt途径是否为最主要的抗肿瘤机制以及其发挥抗肿瘤活性是否存在其他的作用机制尚需进一步的研究。
[1]Ferlay J,Steliarova-Foucher E,Lortet-Tieulent J,et al.Cancer incidence and mortality patterns in Europe:estimates for 40 countries in 2012[J].Eur J Cancer,2013,49(6):1374-1403.
[2]DesantisCE,Lin CC,MariottoAB,etal.Cancertreatment and survivorship statistics,2014[J].CA Cancer J Clin,2014,64(4):252-271.
[3]陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤,2013,22(1):2-12.
[4]Hongchao Z,Taotao D,Houmin Z,et al.miR-320a suppresses colorectalcancerprogression by targeting Rac1[J].Carcinogenesis,2014,35(4):886-895.
[5]Manpreet Kaur,Saini,Sankar Nath,et al.Cell cycle regulation and apoptotic cell death in experimental colon carcinogenesis:intervening with cyclooxygenase-2 inhibitors[J].Nutrition&Cancer,2015,67(4):620-636.
[6]Grasso S,Martínez-Lacaci I,Barberá VM,et al.HGUE-C-1 is an atypical and novel colon carcinoma cell line[J].Bmc Cancer,2015,15(1):1-16.
[7]Hsieh CJ,Hall K,Ha T,et al.Baicalein inhibits IL-1betaand TNF-alpha-induced inflammatory cytokine production from human mast cells via regulation of the NF-kappaB pathway[J].Clinical&Molecular Allergy Cma,2007,5(5):5-14.
[8]Kyo R,Nakahata N,Sakakibara I,et al.Baicalin and baicalein,constituents of an important medicinal plant,inhibit intracellular Ca2+elevation by reducing phospholipase C activity in C6 rat glioma cells[J].J Pharm Pharmacol,1998,50(10):1179-1182.
[9]Chen J,Li Z,Chen AY,et al.Inhibitory effect of baicalin and baicalein on ovarian cancercells[J].IntJMolSci,2013,14(3):6012-6025.
[10]Ma Z,Otsuyama K,Liu S,et al.Baicalein,a component of Scutellaria radix from Huang-Lian-Jie-Du-Tang(HLJDT),leads to suppression of proliferation and induction of apoptosisin human myeloma cells[J].Blood,2005,105(8):3312-3318.
[11]邹颖,迟宏罡,李涛,等.黄芩素对子宫颈癌Hela细胞表皮生长因子受体表达的影响[J].中药新药与临床药理,2014,25(2):121-124.
[12]向淼,徐细明,邓君健,等.黄芩素诱导人肝癌细胞株SMMC-7721凋亡作用的研究[J].现代肿瘤医学,2014,20(6):1098-1103.
[13]Zhang HB,Lu P,Guo QY,et al.Baicalein induces apoptosis in esophagealsquamous cellcarcinoma cells through modulation of thePI3KAktpathway[J].Oncology Letters,2013,5(2):722-728.
[14]任学群,李宜雄.黄芩素对人胰腺癌PANC-1细胞增殖和运动能力的影响[J].河南大学学报(医学版),2010,29(3):180-185.
[15]廖于,陈富,宴铮剑,等.黄芩素对MG63细胞侵袭浸润能力的影响[J].中药药理与临床,2011,27(2):32-34.
[16]王宁,畅灵丽,程琦,等.黄芩素对结肠癌细胞增殖与凋亡的影响[J].中国现代医学杂志,2015,25(35):22-26.
[17]N Jones,F Bonnet,S Sfar,et al.Comprehensive analysis of PTEN status in breast carcinomas[J].International Journal of CancerJournalInternationalDu Cancer,2013,133(2):323-334.
[18]Lindsey D Mayo,David B Donner.The PTEN,Mdm2,p53 tumor suppressor-oncoprotein network[J].Trends in Biochemical Sciences,2002,27(9):462-467.
[19]NiZ,Kai-Ting Y,Jennifer-Ann B,etal.PTEN controls β-cell regeneration in aged mice by regulating cell cycle inhibitor p16(ink4a)[J].Aging Cell,2013,12(6):1000-1011.
[20]Chu EC,Tarnawski AS.PTEN regulatory functions in tumor suppression and cell biology[J].Medical Science Monitor International Medical Journal of Experimental& Clinical Research,2004,10(10):R-A235.
[21]Li X,Li Z,Li N,et al.MAGI2 enhances the sensitivity of BEL-7404 human hepatocellularcarcinoma cells to staurosporine-induced apoptosis by increasing PTEN stability[J].InternationalJournalof MolecularMedicine,2013,32(2):439-447.
[22]Yang TS,YangXH,Wang XD,etal.MiR-214 regulate gastric cancercellproliferation,migration and invasion by targeting PTEN[J].Cancer Cell International,2013,13(1):1-10.
[23]Fan W,Huang J,Xiao H,et al.MicroRNA-22 is downregulated in clear cell renal cell carcinoma,and inhibits cell growth,migration and invasion by targeting PTEN[J].Molecular medicine reports,2016,13(6):4800-4806.
[24]Li B,Lu Y,Wang H,et al.miR-221/222 enhance the tumorigenicity of human breast cancer stem cells via modulation of PTEN/Akt pathway[J].Biomedicine&Pharmacotherapy,2016,79(4):93-101.

