慢病毒敲减质粒pLKO.1-hSRF 的构建及鉴定
蔡艺煌,邓小玲,黄文霞,黄洁,纪晴, *,许铭炎,*
(1.厦门医学院口腔系,厦门医学院附属口腔医院,福建厦门361002;2.厦门大学医学院基础部,福建厦门361002)
当今世界,癌症已成为严重威胁人类健康的重大疾病之一。在所有恶性肿瘤中,口腔恶性肿瘤占比约为3%,其中口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)则占90%[1],并且其发病率在年轻群体中(小于40岁)呈现增加趋势[2]。在中国台湾地区,口腔癌位列男性癌症死亡第4位,而咀嚼槟榔是引发口腔癌的重要因素之一,其中每年每10万人就有6人死于口腔癌[3]。此外,现代人长期高脂高蛋白及低纤维的饮食习惯容易造成消化系统的功能紊乱,进而能引起口腔内有害菌群生长,提高了口腔癌的发病率[4]。
血清应答因子(serum response factor,SRF)是一个在生物体内广泛表达的转录因子,其在多种细胞和肿瘤基质中能与c-Fos/JunB、MRTFs、E-/VE-钙黏着素/β-联蛋白、RhoA和肌动蛋白协同作用,在平滑肌的生理调控、胚胎干细胞早期基因激活、细胞增殖、分化、迁移以及干细胞的定向和血管生成等过程中发挥重要作用[5-12]。而目前,SRF在口腔恶性肿瘤中的研究较少,本研究通过构建pLKO.1-hSRF慢病毒敲减质粒,并成功感染口腔鳞癌细胞SAS,验证了其能在SAS细胞中敲减SRF mRNA 和 蛋白的表达水平,获得SRF低表达口腔鳞癌细胞株,为后续口腔恶性肿瘤的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 细胞与载体慢病毒敲减质粒pLKO.1-TRC cloning vector及293T细胞由厦门大学生命科学学院李博安教授惠赠。SAS细胞购自日本细胞库。
1.1.2 主要试剂和仪器限制性内切酶、DNA分子量Marker、cDNA反转录试剂盒(TaKaRa公司);胶回收试剂盒(Omega公司);shRNA由厦门铂瑞生物技术有限公司合成;DNA提取试剂盒、Super Real荧光定量预混试剂、T4DNA连接酶(TransGEN Biotech公司);RNA提取试剂盒(东盛生物);Turbofect转染试剂(赛默飞世尔,USA);嘌呤霉素(Sigma,USA)。实时荧光定量PCR仪为赛默飞世尔公司7500型实时荧光定量PCR系统。
1.2 方法
1.2.1 shRNA片段设计目的shRNA片段通过Thermo Fisher公 司 RNAi网 站 https://rnaidesigner.thermofisher.com/rnaiexpress/design.do进行设计,获取的核心片段序列为GCACTGATTCAGACCTGCCTCAACT,将该片段序列反向互补,以CTCGAG为loop环连接,并在头尾两端加上酶切位点,最终获得如下引物序列:正向 5 ´-CCGG G CACTGATTCAGACCTGCCTCAACTC TCGAGAG TTGAGGCAGGTCTGAATCAGTGCTTTTTG-3´,反向5´-AATTCAAAAA G CACTGATTCAGACCTGCCTCAACTC TCGAGA GTTGAGGCAGGTCTGAATCAGTGC-3´(核心序列及其互补序列下划线表示)。通过铂瑞生物公司合成后,将获得的片段溶解并进行退火。本研究中以CTCGAG为loop环,由于使用pLKO.1-TRC质粒系统,则以 EcoRⅠ和 A geⅠ作为插入片段的酶切位点。
1.2.2 克隆将公司合成的正反单链DNA片段溶解后(100μmol/L)各取2μL,加入到46μL的退火缓冲液[50 mmol/L HEPES(pH7.4), 100mmol/L NaCl]中 进 行 退火。退火程序95℃、5min,85℃、5min,75℃、5 min,70℃、10min,37℃、20min,4℃低温保存获取目的片段。然后用 EcoRⅠ和 A geⅠ对2μg pLKO.1载体进行酶切,胶回收纯化,然后将退火得到的目的片段稀释200倍后用T4连接酶对酶切载体和目的片段进行连接,22℃连接40min。再将连接产物加入到stbl3感受态细胞中进行转化,涂布到含氨苄霉素的LB固体培养基中37℃培养16~18h。挑取单菌落加入到LB液体培养基中37℃摇动培养16~18h。最后将培养好的菌液用质粒提取试剂盒进行质粒提取,并通过双酶切进行鉴定。酶切鉴定正确的质粒送往测序公司进行测序,以对克隆质粒的序列进行判定。获得的阳性质粒命名为pLKO.1-hSRF。
1.2.3 病毒包装本研究中使用三质粒包装系统,pVSV-G、pHR和新构建质粒pLKO.1-hSRF,以pLKO.1-Scramble作为阴性对照。将293T细胞接种到6 cm培养皿中培养16h左右,待细胞汇合度达80%~90%时,使用Turbofect转染试剂将上述质粒pVSV-G、pHR、 pLKO.1-hSRF或 pLKO.1-Scramble转 染 到 细 胞中。转染16~18h后换液,转染40~48h后病毒即包装并释放到培养基中,收取培养基,用0.45μL滤器过滤后即获得病毒溶液,将病毒分装到1.5mL EP管中,每管1mL,液氮速冻后置于-80℃冰箱待用。
1.2.4 病毒感染与稳定转染细胞株的筛选将SAS细胞接种到培养皿中,待其汇合度约为40%~50%左右时,加入Polybrane及适量病毒液,3.5cm培养皿加1 mL培养基和1mL病毒液。培养24h左右换液,培养40 h左右进行传代并加入嘌呤霉素进行筛选,SAS的嘌呤霉素筛选终浓度约为0.2μg/mL,每隔2d换一次液,以未感染病毒的细胞为对照组, 1周后无感染病毒的对照组全死亡,而感染了病毒的实验组尚有大量细胞存活,表明SRF稳定敲减的细胞株筛选成功。对获得的稳定转染细胞株进行扩增和后续鉴定。
1.2.5 实时定量PCR检验目的基因mRNA敲减效率将感染pLKO.1-Scramble和pLKO.1-hSRF的SAS细胞接种到直径为3.5cm培养皿中,待细胞长满后用RL溶液(东盛生物,RNA提取试剂盒)将细胞吹散下来加到EP管中,随后按照说明书提取出细胞RNA,然后利用反转录试剂盒将RNA进行反转获得cDNA,用SuperReal荧光定量预混试剂按照说明书与cDNA、引物及水按比例混匀后,使用ABI7500Real-time PCR仪进行扩增检测。以 G APDH作为内参相对定量。所用引物为: S RF上游5´-CGAGATGGAGATCGGTATGGT-3´, 下 游5´-G GGTCTTCTTACCCGGCTTG-3´;GAPDH上游5´-CATCACCATCTTCCAGGAG-3´, 下 游5´-AGGC TGTTGTCATACTTCTC-3´。
1.2.6 Western blot检验目的基因蛋白敲减效率将感染pLKO.1-Scramble和pLKO.1-hSRF的SAS细胞接种到6cm盘中,待细胞长满后用细胞刮将目的细胞收集到EP管中,RIPA裂解液将细胞重悬裂解并超声破碎,离心后去上清获得目的细胞蛋白溶液,并用BCA蛋白测定试剂盒测定浓度。制备10%聚丙烯酰胺凝胶,蛋白上样量为40μg,电压60V电泳40min后改为120V电泳90min,随后利用湿转法将凝胶上的蛋白转移到PVDF膜上。用含10%脱脂牛奶的TBST对PVDF膜封闭1 h。将膜加入到一抗稀释液中,4℃摇床孵育过夜。回收一抗,TBST漂洗3次,每次10min。加入二抗室温摇床孵育1h。弃去二抗,TBST漂洗3次,每次10min。在暗房中利用ECL发光液系统压片,显影。
1.3 统计学分析
实验所得数据以x±s表示,感染pLKO.1-hSRF的实验组和感染pLKO.1-Scramble对照组的mRNA表达水平采用非配对Student’s t检验进行组间差异性检验,使用GraphPad Prism5统计软件分析, α =0.05为检验水准。
2 结果
2.1 克隆质粒的获得
空载质粒pLKO.1-TRC全长8901bp,用EcoRⅠ和AgeⅠ双酶切后可得到7026bp和1875bp两个片段。如图1所示。将目的片段(7026bp)切胶回收后与退火片段用T4连接酶进行连接,涂平板,然后挑取单克隆进行后续酶切鉴定及测序。

图1 空载质粒酶切产物琼脂糖凝胶电泳结果
2.2 重组质粒鉴定
设计的敲减片段中,loop环CTCGAG序列为 X hoⅠ的酶切位点,同时,选取pLKO.1质粒1189bp处 K pnⅠ作为双酶切鉴定位点,理论上可得到大小分别约为7 800bp和1200bp的片段。本实验挑取5个阳性克隆到培养瓶中摇菌并提取质粒后,用 X hoⅠ和 K pnⅠ对提取的质粒进行酶切鉴定。电泳结果(图2)显示1、2、3、5质粒被酶切出两条片段,且酶切片段大小与预期结果一致。选取酶切正确的重组质粒进行DNA测序,测序结果与所设计片段序列一致,表明慢病毒敲减质粒pLKO.1-hSRF构建成功(图3)。

图2 酶切鉴定结果
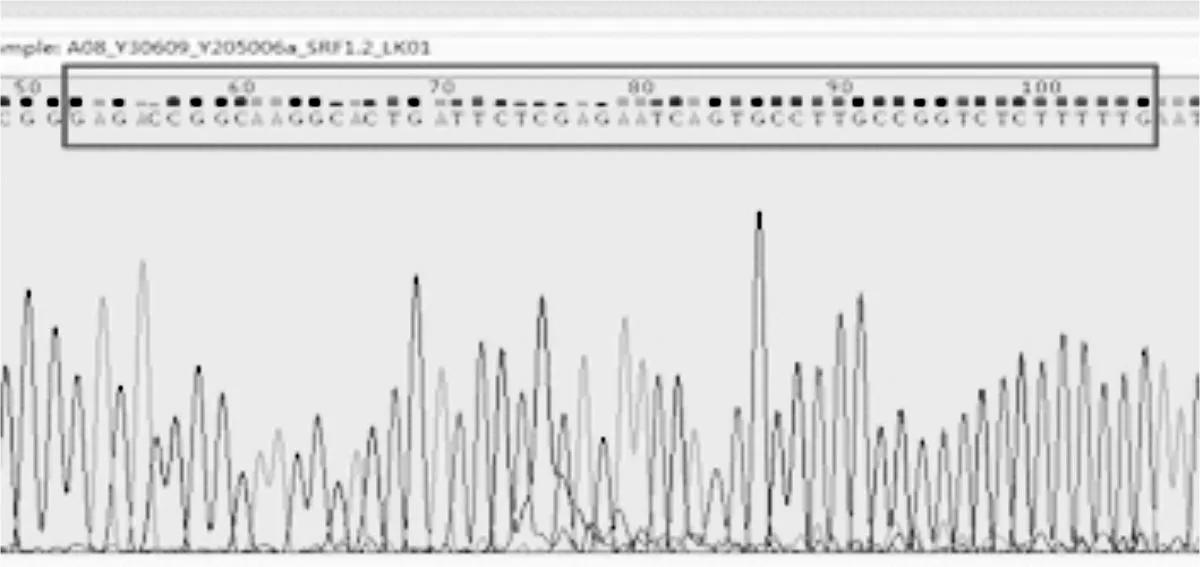
图3 阳性克隆质粒测序图
2.3 重组质粒敲减效率的验证
2.3.1 实时定量PCR验证结果以 G APDH为内参,检测感染pLKO.1-Scramble和pLKO.1-hSRF的SAS细胞mRNA表达水平。如图4所示,与Scramble对照组相比,感染pLKO.1-shSRF病毒的SAS细胞中SRF mRNA的表达量明显降低(P<0.01)。
2.3.2 Western blot验证结果以GAPDH为内参,检测感染pLKO.1-Scramble和pLKO.1-hSRF的SAS细胞蛋白表达水平变化,如图5所示,在感染pLKO.1-hSRF病毒的SAS细胞中,SRF蛋白的表达量明显低于对照组(P<0.01)。
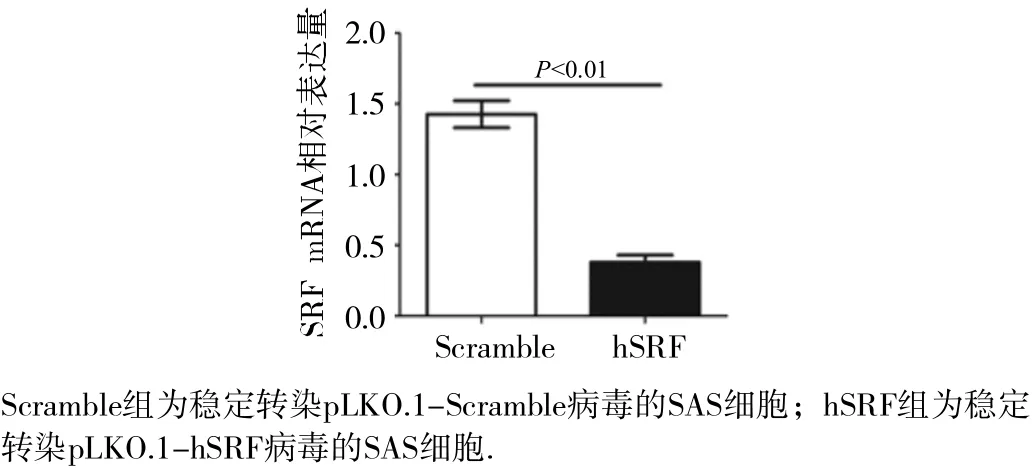
图4 SAS 细 胞稳定转染细胞株S RF mRNA 的表达情况
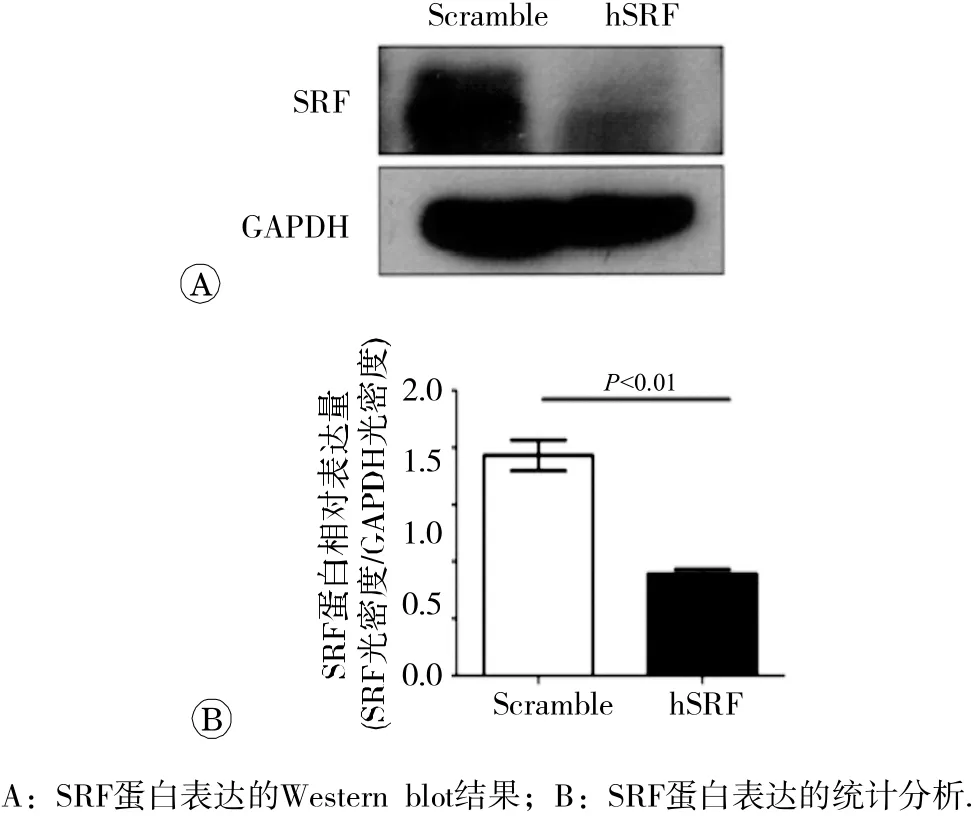
图5 SAS 细 胞稳定转染细胞株 S RF 蛋白的表达情况
3 讨论
血清反应因子(SRF)是MADS-box家族中一类古老且进化保守的转录因子,在其N端带有MADS结构域,该结构域能促进其蛋白二聚化并具有DNA结合能力,而MADS结构域的C端则具有与相关调控辅因子结合的结构域[13]。SRF的C端带有一个转录激活结构域,该结构域能被血清激活并磷酸化[14]。SRF参与调节细胞生长、迁移、细胞骨架组织、能量代谢等有关的多种基因。理论上,SRF能通过识别被称之为CArG-boxes的序列,进而调控所有肌动蛋白编码基因和部分肌肉肌球蛋白重轻链以及对引起肌动蛋白踏车现象的相关蛋白的调控[11]。有文献报道,SRF在器官纤维化相关基因的调控中发挥重要作用,如ACTA2[15]和CTG[16]。且越来越多的研究[17-18]表明,心肌素相关转录因子/血清反应因子(MRTF/SRF)途径有望将预防纤维化的靶点治疗作为靶标,在器官纤维化病变治疗过程中具有较好的前景。此外,在多种肿瘤的发生发展过程中,SRF作为重要的调控因子参与其中。如前列腺癌[19]、乳腺癌[20]、胃癌[21]等。在多种癌症中,SRF呈现出高表达且在肿瘤的转移、侵袭以及上皮-间充质转分化(epithelialmesenchymal transition,EMT)中充当重要的角色[22-23]。
然而,当前SRF在口腔癌中的作用并未有详细的研究论述。我们前期研究发现,SRF对口腔鳞癌细胞中整合素的表达具有重要的调控作用,并在口腔鳞癌细胞的迁移及侵袭能力中表现出了一定的影响。整合素是主要的细胞表面受体家族,能协调细胞与细胞外基质的黏附,促进许多动态细胞 黏 附过程,如迁移、扩散和存活,进而介导几乎所有细胞的生命过程[24]。我们猜测SRF能通过整合素介导EMT过程,进而影响口腔癌的发展。在本研究中,我们成功构建了pLKO.1-hSRF,验证了其能够在SAS细胞中敲减SRFmRNA和蛋白的表达水平,获得了稳定低表达SRF的口腔鳞状癌细胞SAS。这对后续我们进一步研究 SR F基因在口腔鳞状细胞癌中的功能作用奠定了重要的物质基础。
[1]POVEDARODA R,BAG NJV,JIM NEZSORIANOY,et al.Changes in smoking habit among patients with a history of oral squamous cell carcinoma(OSCC)[J].Med Oral Patol Oral Cir Bucal,2010,15(5):e721-726.
[2]SHIBOSKI C H,SCHMIDTB L,JORDAN R C.Tongue and tonsil carcinoma:increasing trends in the U.S.population ages 20-44years[J].Cancer,2005,103(9):1843.
[3]HOY T,YANGJS,LI TC,et al.Berberine suppresses in vitro migration and invasion of human SCC-4tongue squamous cancer cells through the inhibitions of FAK,IKK,NF-kappaB,u-PA andMMP-2and-9[J].Cancer Lett,2009,279(2):155.
[4]MICHAUD DS,IZARDJ,RUBIN Z,et al.Lifestyle,dietary factors,and antibody levels to oral bacteria in cancerfree participants of a European cohort study[J].Cancer Causes Control,2013,24(11):1901.
[5]CONNELLYJT,GAUTROTJ E,TRAPPMANN B,et al.Actin anDSerum response factor transduce physical cues from the microenvironment to regulate epidermal stem cell fate decisions[J].Nat Cell Biol,2010,12(7):711-718.
[6]VARTIAINENM K,GUETTLER S,LARIJANI B,et al.Nuclear actin regulates dynamic subcellular localization and activity of the SRF cofactorMAL[J].Science, 2007, 316(5832):1749.
[7]CAMORETTI-MERCADO B,LIU H W,HALAYKO AJ,et al.Physiological control of smooth muscle-specific gene expression through regulated nuclear translocation of serum response factor[J].J Biol Chem,2000,275(39):30387.
[8]DING W,GAO S,SCOTTR E.Senescencerepresses the nuclear localization of the serum response factor and differentiation regulates its nuclear localization with lineage specificity[J].J Cell Sci,2001,114(5):1011-1018.
[9]SCHRATTG,WEINHOLD B,LUNDBERG A S,et al.Serum response factor is required for immediate-early gene activation yet is dispensable for proliferation of embryonic stem cells[J].Mol Cell Biol,2001,21(8):2933-2943.
[10]TREISMAN R.Identification of a protein-binding site that mediates transcriptional response of the c-fos gene to serum factors[J].Cell,1986,46(4):567.
[11]MIANOJM,LONG X,FUJIWARA K.Serum response factor:master regulator of the actin cytoskeleton and contractile apparatus[J].AmJPhysiol Cell Physiol,2007,292(1):70.
[12]BUSCHE S,KREMMER E,POSERN G.E-cadherin regulatesMAL-SRF-mediated transcription in epithelial cells[J].J Cell Sci,2010,123(16):2803-2809.
[13]MESSENGUY F,DUBOIS E.Role ofMADS box proteins and their cofactors in combinatorial control of gene expression and cell development[J].Gene,2003,316(1):1-21.
[14]MISRA R P,RIVERA VM,WANGJM,et al.The serum response factor is extensively modified by phosphorylation following its synthesis in serum-stimulated fibroblasts[J].Mol Cell Biol,1991,11(9):4545.
[15]ESNAULTC,STEWARTA,GUALDRINI F,et al.Rhoactin signaling to theMRTF coactivators dominates the immediate transcriptional response to serum in fibroblasts[J].Genes Dev,2014,28(9):943.
[16]TOUVRONM,ESCOUBETB,MERICSKAYM,et al.Locally expressed IGF1propeptide improves mouse heart function in induced dilated cardiomyopathy by blocking myocardial fibrosis anDSRF-dependent CTGF induction[J].DisModelMech,2012,5(4):481-491.
[17]YUWAIMAN C,SPENCERDENE B,LEE RM,et al.Local delivery of novelMRTF/SRF inhibitors prevents scar tissue formation in a preclinical model of fibrosis[J].Sci Rep,2017,7(1):518.
[18]YU-WAI-MAN C,TREISMAN R,BAILLYM,et al.Therole of theMRTF-A/SRF pathway in ocular fibrosis [J].Invest Ophth Vis Sci,2014,55(7):4560.
[19]PRENCIPEM,O'NEILL A,O'HURLEY G,et al.Relationship between serum response factor and androgen receptor in prostate cancer[J].Prostate,2015,75(15):1704-1717.
[20]LIU CY,CHAN S W,GUO F,et al.MRTF/SRF dependent transcriptional regulation of TAZ in breast cancer cells[J].Oncotarget,2016,7(12):13706.
[21]ZHAOX,HE L,LI T,et al.SRF expedites metastasis and modulates the epithelial to mesenchymal transition by regulating miR-199a-5pexpression in human gastric cancer[J].Cell Death Differ,2014,21(12):1900-1913.
[22]PARKMY,KIM K R,PARK H S,et al.Expression of the serum response factor in hepatocellular carcinoma:implications for epithelial-mesenchymal transition[J].IntJOncol,2007,31(6):1309.
[23]CHOI H N,KIM K R,LEEJH,et al.Serum response factor enhances liver metastasis of colorectal carcinoma via alteration of the E-cadherin/beta-catenin complex[J].Oncol Rep,2009,21(1):57-63.
[24]LIUJ,MITALI D,YANGJ,et al.Structural mechanism of integrin inactivation by filamin [J].Nat StructMol, 2015,22(5):383-389.

