红景天提取物对顺铂致肾细胞毒性的保护作用
韩何丹,王海,李艾琳,韩照玉,高丽萍*
(北京联合大学健康与环境学院,生物活性物质与功能食品北京市重点实验室,北京100191)
顺铂[cis-dichlorodiamineplatinum(II),DDP]是以二价铂为中心与2个氯原子和2个氨基结合而成的一类铂类药物[1],是临床最常用的抗肿瘤药物之一[2]。DDP在临床治疗过程中常伴有一定毒副作用[3-4],如肾毒性、耳毒性、神经毒性、生殖毒性、心脏毒性和致吐性等,且随着DDP使用剂量的增加其引起的毒副作用也会越来越明显[5]。其中肾毒性是临床DDP使用量受限制的主要原因[6-7]。因此,在临床治疗中减轻DDP的肾毒性显得尤为重要。
有学者提出,在使用DDP的同时加入辅助保护剂以降低DDP引起的肾毒性[2]。众多研究表明,许多中药单体化合物对防治DDP引起的肾毒性有很好的缓解作用。如姜黄素[8]能激活抗氧化反应体系防止细胞凋亡,还能改善线粒体脂质过氧化反应、清除线粒体内自由基,从而降低DDP引起的细胞氧化损伤。五味子乙素[9]能够增强细胞抗氧化能力,改善线粒体膜的通透性以降低DDP引起的细胞损伤。低聚葡萄籽原花青素[10]和芸香苷[11]都能降低DDP诱导细胞产生的活性氧族(reaction oxygen species,ROS)和丙二醛(malondialdehyde,MDA)。
现代医学研究指出,红景天提取物(Rhodiola extract,RE)具有抗癌、抗缺氧、抗病毒、抗辐射、抗疲劳、对中枢神经的双向调节、延缓衰老等广泛的生理活性[12-13]。据报道,红景天提取物可提高超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性,可降低脂质过氧化物(lipid peroxide,LPO)的含量,在微粒体模型中具有较好的抗氧化活性[14-15]。有研究表明红景天苷类似物对缺氧所致的血管内皮细胞损伤具有显著的保护作用[16]。然而,红景天提取物对抗DDP诱导人胚肾细胞氧化损伤的影响尚未见报道。本课题通过研究RE对DDP所致HEK293细胞毒性的保护作用,探讨RE拮抗DDP所致肾细胞氧化损伤作用的机制,以期为临床化疗过程中减轻DDP细胞毒性提供理论基础及实验参考。
1 材料与方法
1.1 材料与试剂
人胚肾细胞(HEK293)来自中国医学科学院基础医学研究所北京协和医学院基础学院细胞中心;DDP注射用粉剂购自齐鲁制药公司(无菌生理盐水溶解);红景天提取物购自上海诺德生物实业有限公司,含3%红景天苷,用前需用二甲基亚砜(DMSO)适当稀释,过滤除菌后避光保存;胎牛血清购自美国Hyclone公司;DMEM/H培养基、0.25%胰酶、双抗(100μg/mL链霉素,100U/mL青霉素)均购自北京鼎国昌盛生物技术有限公司;CCK-8毒性检测试剂盒购自美国Sigma公司;BCA蛋白浓度测定试剂盒、丙二醛(MDA)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)测定试剂盒均购自南京建成生物工程研究所;其他试剂均为市售分析纯。
1.2 细胞培养
HEK293细胞常规培养于含有15%新生胎牛血清和双抗的DMEM高糖培养基中,培养箱环境为37℃、CO2体积分数5%、饱和湿度。待细胞汇合度至80%~90%时,用胰酶消化,按1∶3进行传代,每隔1天换1次培养基,每2~3d传代1次,取对数生长期细胞用于实验。
1.3 CCK-8法检测细胞活力
1.3.1 DDP对HEK293细胞的毒性作用将100μL(浓度为1×105/mL)的HEK293细胞接种到96孔板中,待细胞生长到汇合状态,加入终浓度分别为0、0.5、1、2、4、8、16、32、64、128mg/L的DDP,每组设6个复孔,培养箱孵育24h,然后每孔加入100μL含10%CCK-8的培养基,继续孵育4h,450nm处检测吸光度D(450)值,按下式计算细胞存活率。
细胞存活率=D( 4 50 )实验组/D(450)对照组×100%
并计算DDP对HEK293细胞的半数抑制浓度(I C50),由此确定DDP诱导HEK293细胞损伤模型的最佳使用浓度。
1.3.2 红景天提取物作用后HEK293细胞的存活率处理和计算方法同上,红景天提取物终浓度依次为:0、0.25、0.5、1、2、4、8、16、32、64mg/L。
1.3.3 联合作用后对HEK293细胞毒性作用的影响将100μL(浓度为1×105个/mL)处于对数生长期的细胞接种到96孔板中,待细胞生长至汇合状态时,加药处理。试验分4组:即正常对照组(正常细胞,不做其他处 理 )、 DDP组 (加 入 20mg/L DDP)、 红 景 天 提 取 物+DDP[在加DDP前2h分别加入不同浓度(2、4、6、8、10、12、14、16mg/L)红景天提取物孵育细胞]、阴性对照组(在加药时加入等体积PBS)。每组设6个复孔,在37℃、CO2体积分数为5%的孵育培养箱中培养24h后按1.3.1所述检测细胞存活率。
1.4 HEK293细胞蛋白浓度测定及细胞内GSH、SOD、MDA的测定
细胞分为4组即正常对照组(正常细胞,不做其他处理)、红景天提取物保护组(加入12mg/L红景天提取物)、DDP模型组(加入20mg/L DDP)、红景天提取物和DDP联合处理组(加入12mg/L红景天提取物和20mg/L DDP)。将2mL(浓度为1×105个/mL)处于对数生长期的细胞接种到6孔板中,待细胞生长至融合状态时,按照实验分组加药处理。继续培养24h后除去培养液,PBS洗1遍,每孔加入300μL PBS,用细胞刮收集细胞后,将装有细胞悬液的离心管放在冰水浴中,用细胞破碎仪破碎1min;然后12000r/min离心10min,收集上清液,按照试剂盒说明书进行细胞蛋白浓度和MDA、GSH含量以及SOD活力测定。
1.5 统计学方法
使用SPSS22.0进行数据统计分析,结果以x±s表示,多组间数据比较采用单因素方差分析,以 α=0.01为检验水准。用Origin9.1软件作图。
2 结果
2.1 DDP对HEK293细胞的毒性作用
见图1。不同浓度DDP作用于HEK293细胞24h后,对细胞生长有不同程度的抑制作用。随着DDP浓度的增加,细胞存活率逐渐降低,与对照组比较,1~128mg/L DDP处理组细胞存活率均显著降低(P均<0.01),且呈现剂量-效应关系(r=0.85, P=0.002)。经统计分析得出,DDP对HEK293的IC50为19.78mg/L,其中,20mg/L是与IC50最为接近的整数浓度,为提高后续试验的效率,选择将其作为后续建立DDP损伤模型的浓度。

图1 不同浓度DDP 对 H EK293 细 胞生长存活率的影响(n=6)
2.2 红景天提取物对HEK293细胞存活率的影响
见图2。不同浓度的红景天提取物作用于HEK293细胞24h后,对细胞存活率有不同程度的影响。在0.5~16mg/L范围内细胞存活率随红景天提取物浓度的增加逐渐升高,且与正常对照组相比,差异均有统计学意义(P<0.01)。红景天提取物浓度为16mg/L时,细胞存活率最高,当浓度大于16mg/L时,细胞存活率逐渐下降,当红景天提取物浓度为64mg/L时,可显著抑制HEK293细胞的生长,与正常对照组比较,差异具有统计学意义(P<0.01)。由此说明,红景天提取物对HEK293细胞的影响具有“低浓度促进,高浓度抑制”的特点。
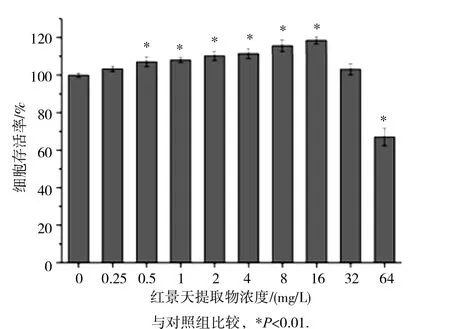
图2 不同浓度 R E对 HEK293细胞存活率的影响(n =6)
2.3 红景天提取物对DDP所致HEK293细胞毒性的影响
见图3。用终浓度为20mg/L的DDP作用HEK293细胞24h建立细胞损伤模型。和DDP组相比,6~16 mg/L红景天提取物预处理后,细胞存活率均明显升高(P<0.01),当红景天提取物浓度为12mg/L,细胞存活率最高,当浓度高于12mg/L,红景天提取物的减毒作用逐渐减小,提示在一定浓度范围内红景天提取物对DDP诱发的HEK293细胞毒性有显著的保护作用。
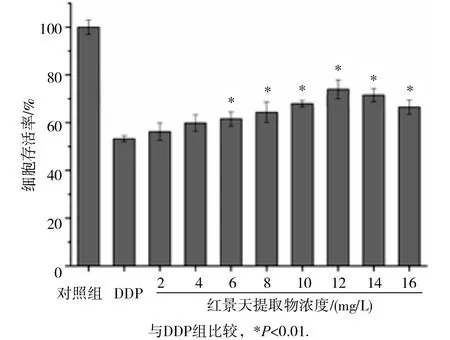
图3 不同浓度 R E对 D DP 的 H EK293 细 胞毒性的影响(n=6)
2.4 红景天提取物对DDP作用后的HEK293细胞内GSH、MDA含量和SOD活力的影响
见表1。与对照组相比,DDP作用下的HEK293细胞中GSH含量和SOD活性显著降低(P<0.01),MDA含量显著升高(P<0.01);而RE作用 细 胞后,GSH、SOD和MDA水平均无显著变化(P均>0.05)。经RE干预后,DDP处理24h(即RE+DDP组),细胞GSH含量较DDP组显著升高(P<0.01),SOD活力也有与GSH类似的变化。DDP造成细胞内MDA含量明显高于对照组,而RE+DDP组细胞内MDA含量较对照组显著升高 (P<0.01),但较DDP组却显著降低(P<0.01)。结果表明,RE对DDP造成的细胞氧化损伤有一定的保护作用。

表1 RE对顺铂作用后的HEK293细胞抗氧化指标的影响(n=3)
3 讨论
DDP作为一种广谱抗癌药物,是当前临床医学上最常用和最有效的抗癌药物之一[17-18],但同时引起的严重不良反应限制了其用药剂量和化疗应用进程。DDP进入机体后主要经肾脏排泄,因此其肾毒性最为明显[4]。大量研究结果表明,DDP对体外培养的正常细胞具有毒性作用。Lieberthal等[19]研究证实顺铂引起原代培养的肾小管上皮细胞死亡(包括凋亡和坏死),死亡的形式取决于顺铂的浓度。闫长会[20]通过对人肾小管上皮细胞(HK-2)进行体外肾毒性研究发现 , DDP 对HK-2细胞具有明显的毒性作用。在本实验中,DDP 明显降低了HEK293细胞存活率,且呈现剂量依赖性。因此,减轻DDP肾毒性改善患者生活质量很有必要。
红景天提取物(RE)作为一种天然活性物质,含有多种生物活性成分,主要为黄酮类物质和苯烷基苷类化合物,可消除机体内脂质过氧化所产生的自由基,是一种很好的自由基清除剂[21],具有较强的抗氧化作用[22]。此外,RE可增强中枢胆碱能系统的功能活动,促进细胞代谢,增强细胞活力,从而阻抑细胞退化、变性和凋亡。文镜等[23]通过体外实验研究发现 R E可清除体内超氧自由基(O2-.)和羟自由基(·OH)。我们前期研究显示 R E能有效抑制DDP诱导小鼠睾丸支持细胞TM4的细胞损伤[24]。在本实验中,一定浓度范围(0.5~16mg/L)内RE明显提高了HEK293细胞 的 存活率,一定终浓度RE与DDP共同孵育可提高HEK293细胞存活率,表明RE对DDP所致HEK293细胞生长具有保护作用。
氧化应激是DDP肾毒性的主要原因。GSH是细胞防御有毒化合物或氧化应激化学反应最重要的分子之一。SOD是一种金属蛋白,能够清除机体内产生的氧自由基,从而保护细胞免受超氧化物自由基的损伤,与GSH有相似的功能。因此,检测SOD和GSH含量可以反映细胞的抗氧化能力。有研究表明DDP可通过结合GSH而引起机体内GSH含量的严重损失,同时还能抑制谷胱甘肽过氧化物(GSH-Px)、SOD等的活性,从而降低机体的抗氧化能力[25]。Shah等[26]将体外血浆和细胞组分中的GSH进行不同浓度DDP处理,结果发现GSH浓度呈明显下降趋势。可推断,DDP治疗很可能引起血液中GSH水平降低,进而导致机体的抗氧化能力下降。Naziroglu等[27]研究表明DDP对肾脏中SOD、GSH-Px和过氧化氢酶(CAT)等抗氧化酶系统具有抑制作用。本研究结果表明,DDP组GSH和SOD的含量明显低于对照组,DDP诱发产生的自由基明显超出了HEK293细胞的自身清除能力,最终引起机体肾脏的氧化损伤。MDA是脂质过氧化反应的一种重要代谢产物,MDA的含量可以直接反映细胞内脂质过氧化程度,从而间接反映了细胞受自由基攻击的严重程度。本研究结果表明,DDP组MDA的含量远高于对照组,提示细胞内的GSH被DDP耗竭,降低了机体清除自由基的能力,从而引发氧化应激反应。该结果与许晗等[28]的研究结果一致。经12mg/L的RE干预后,相对于DDP模型组,HEK293细胞存活率、细胞SOD活力和GSH含量明显提高(P<0.01),MDA含量显著降低(P<0.01),提示红景天提取物能够清除超氧化物阴离子等自由基,减少脂质过氧化反应,减轻DDP引起的氧化应激,从而拮抗DDP肾毒性。
综上,红景天提取物能在一定浓度范围内提高细胞存活率,可拮抗顺铂导致的HEK293细胞氧化损伤,提示红景天提取物对顺铂致肾细胞毒性具有明显的保护作用。
[1]郭培培,高丽萍,冷洪涛,等.枸杞多糖对顺铂诱导人胚肾细胞凋亡的影响[J].食品科学,2013,34(7):284-288.
[2]刘磊,卞卡.顺铂耐药的分子机制及中药干预的研究进展[J].中国中药杂志,2014,39(17):3216-3220.
[3]PABLA N,DONG Z.Curtailing side effects in chemotherapy:a tale of PKCδin cisplatin treatment[J].Oncotarget,2012,3(1):107-111.
[4]WELKOBORSKY HJ, BLEIER R, WISSEN-SIEGER I.Antineoplastic effectiveness and unwanteDSide effects of polychemotherapy of extensive oro-and hypopharyngeal cancers--results of a prospective therapy study with5-FU/cisplatin versus5-FU/carboplatin[J].Laryngorhinootologie,1992,71(5):261-266.
[5]BACJUN C,MANABU N,EISUKE S,et al.l-Carnitine inhibits cisplatin-induced injury of the kidney anDSmall intestine[J].Arch Biochem Biophys,2002,405(1):55-64.
[6]万婷,李连宏.顺铂肾毒性机制及其防护的研究进展[J].中华临床医师杂志(电子版),2013,7(14):6623-6625.
[7]赵艳萌,高丽萍,郭卓雨.顺铂诱发肾毒性机制的研究进展[J].广东医学,2013,34(23):3679-3681.
[8]李昱辰,仲来福.姜黄素对顺铂所致大鼠肾毒性的防护作用及其可能机制[J].毒理学杂志,2005,19(3):270.
[9]田妮,谭小月,张大宁,等.五味子乙素对顺铂损伤HK-2细胞P21和Caspase-3表达的影响[J].中草药,2017,48(5):951-956.
[10]连燕娜,高丽萍,郭豫,等.低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J].食品科学,2016,37(7):182-186.
[11]张洋.芸香苷对顺铂诱导人肾小球系膜细胞毒性的保护作用及机制研究[D].长春:吉林大学,2017.
[12]范桂强,齐善厚,庞红霞,等.红景天提取物与红景天苷体外抗氧化作用研究[J].中国药房,2016,27(13):1797-1800.[13]何承辉.蔷薇红景天化学成分及抗氧化作用的研究[D].乌鲁木齐:新疆医科大学,2006.
[14]李鹏.红景天提取物对大鼠血液中氧自由基代谢的影响[D].太原:山西大学,2012.
[15]周志成,樊海宁,邓勇.红景天对氧化应激反应影响的研究进展[J].现代医药卫生,2012,28(12):1857-1859.
[16]董培.红景天苷类似物对缺氧所致EAhy926内皮细胞损伤的保护作用及机制研究[D].石家庄:河北医科大学,2016.
[17]LV X,SONG DM,NIUY H,et al.Inhibition of heme oxygenase-1enhances the chemo sensitivity of laryngeal squamous cell cancer Hep-2cells to cisplatin[J].Apoptosis,2016,21(4):489-501.
[18]SONG ZM,LIU Z F,YIN C H,et al.Assessment of the feasibility of TACE combined with intratumoral injection of cisplatin in hepatocellular carcinoma[J].OpenMed,2015,10(1):434-439.
[19]LIEBERTHAL W,TRIACA V,LERINEJ,et al.Mechanism of death induced by cisplatin in proximal tubular epithelial cells:apoptosis vs necrosis[J].AmJPhysiol Renal Physiol,1996,270:700-708.
[20]闫长会.铂类抗肿瘤药体外肾毒性的比较研究[D].北京:中国人民解放军军事医学科学院,2004.
[21]肖辉,张月明,冷爱枝.红景天提取物的抗肿瘤实验[J].中国临床康复,2006,10(43):142-144,229.
[22].王福海.红景天中黄酮类化合物的提取及抗氧化性研究[J].广州化工,2016,44(17):109-111,191.
[23]文镜,贺素华,张博成,等.红景天提取物清除 O-2和·OH的体外实验研究[J].食品科学,2005, 2 6(2):219-223.
[24]郭卓雨,高丽萍,李文文.红景天提取物对顺铂诱导小鼠睾丸支持细胞损伤的保护作用[J].中华男科学杂志,2013,19(11):1027-1033.
[25]李贞,高丽萍.氧化应激在顺铂肾毒性中的作用[J].广东医学,2010,31(19) :2600-2602.
[26]SHAH K,KHANM F,BADSHAH A,et al.Effect of cisplatin on glutathioneredox status in isolated plasma and cytosolic fraction[J].AfrJPharm Pharmacol,2013,7(2):37-45.
[27]NAZIROGLUM,KARAOGLU A,AKSOY A O.Selenium and high dose Vitamin Eadministration protects cisplatin-induced oxidative damage to renal,liver and lens tissues in rats[J].Toxicology,2004,195(2/3):221-230.
[28]许晗,尹伟伟,丁鼎.高山红景天总甙抗衰老作用机理的实验研究[J],浙江中医药大学学报,2011,35(2):249-252.
——题《圣山系-金巅》

