不同基因型菊芋耐盐生理及其生态适应性研究
朱菊华,孙星,许斌,梁婷,刘明,缪建,赵耕毛*
(1.南京农业大学资源与环境科学学院,江苏 南京 210095;2.滁州学院生物与食品工程学院,安徽 滁州 239000;3.南通穗邦农业科技发展有限公司,江苏 海安 226633)
菊芋(Helianthustuberosus)又名鬼子姜、洋姜、地姜或番姜等,属菊科(Compositae)向日葵属(Helianthus)多年生草本植物[1]。菊芋原产北美,经欧洲传入我国,由于适应性强在我国各地均有分布,甘肃、宁夏、青海、西藏等畜牧业发达地区栽培面积较大。菊芋的茎叶是优良的青贮饲料,可供牛、马、羊等食草家畜食用[2]。其块茎含有丰富的氨基酸、糖、维生素等人体必须营养元素,尤其是菊糖能改善肠道功能、预防心血管疾病和提高人体免疫力。菊芋有潜力成为多用途植物,鉴于其丰富的副产品,未来具有极高的商业开发价值[3]。
我国西北地区因其天然气候条件以及丰富的草业资源,成为我国畜牧业的主要基地。近年来,我国西北牧区的生态环境不断恶化,干旱缺水、土壤盐碱化时有发生,严重影响了畜牧业的可持续发展。植物生态适应性是指植物随着环境生态因子变化而改变自身形态、结构和生理生化特性,以便与环境相适应的过程。2000年以来,菊芋作为亟待开发的盐碱地适植作物,其极强的生态适应性引起了研究者的浓厚兴趣[4-5]。研究者们对菊芋从苗期到枯黄期均进行了大量研究,为菊芋的研究提供了参考。不同浓度的海水养殖、废水灌溉对菊芋株高和地上生物量有一定的抑制作用,而对于根系和块茎生物量却有促进作用[6]。不同浓度Na2CO3胁迫同样也影响菊芋幼苗生长和光合作用,研究发现菊芋耐碱的极限浓度为50.0 mmol·L-1,高浓度37.5 mmol·L-1的胁迫显著降低了菊芋幼苗的总鲜质量、净光合速率、气孔导度、蒸腾速率、水分利用效率、叶绿素总量、类胡萝卜素含量及叶片和根的过氧化物酶(POD)活性,显著提高细胞间隙CO2浓度、叶片和根超氧化物歧化酶(SOD)活性以及丙二醛(MDA)含量[7-8]。盐胁迫条件下,不同氮素形态对菊芋幼苗PSⅡ光化学效率及抗氧化特性也有显著影响[9]。尽管大多数研究认为,菊芋具有较高的生态适应性,较广的耐盐生态幅,但不同基因型菊芋的耐盐性具有明显差异,其范围大多处于中度盐敏感与中度耐盐之间[10-12]。
本研究比较了我国中原地区广泛种植的菊芋品种和海水加压筛选获得的盐碱地适植菊芋品种的耐盐性及生态适应性,旨在阐明不同基因型菊芋品种适应盐胁迫环境的生理生态机制,为西北农牧区适种菊芋品种的筛选及生态建植提供理论依据。
1 材料与方法
1.1 供试材料
供试菊芋品种,选自河南地方品种M1(Helianthustuberosuscv. Henan)和南京农业大学选育的品种N1(Helianthustuberosuscv. Nanyu No.1),N1和M1品种分别采自江苏省大丰市金海农场和中原油田采油四厂。
1.2 试验设计
试验于2014年3月在南京农业大学牌楼温室进行。菊芋块茎用自来水及蒸馏水冲洗干净后,经0.05%杀真菌剂进行表面灭菌。选取经过灭菌的且具有芽眼的菊芋块茎切片,经1.0 g ·L-1HgCl2消毒10 min,再用无菌水洗净,播种于装有石英砂的周转箱中,于温室中培养,昼夜温度分别为(30±2)和(20±2) ℃。待块茎萌发后,选取长势一致的幼苗转移至容量5 L的塑料桶中,植株经泡沫板固定,培养液为1/2 Hoagland营养液(pH 6.0),菊芋幼苗长至4叶期时进行处理。
试验设置0,100 和 200 mmol·L-1NaCl浓度梯度,以不含NaCl的1/2 Hoagland营养液为对照。为了避免盐度冲击效应,以50 mmol·L-1等分逐步提高NaCl浓度,每两天增加一次,至设计的终浓度。试验按照完全随机区组设计(CRD),每个处理重复3次。牌楼温室昼夜温度分别为(30±2)和(20±2) ℃,光周期12 h,光子通量密度392~415 μmol·m-2·s-1,空气相对湿度65%~75%。
在盐胁迫处理的第30天,对植物进行取样(全株)。将两品种菊芋植株从泡沫支撑板上取出,用去离子水清洗根部,迅速吸干离子水并测定株高和根长以及整株植物的生物量。取相关部位置于冰盒带回实验室,立即分析各项生理指标。一部分待测生化分析的样品在洗涤干燥后,液氮保护后转移至-80 ℃的冰箱中保存待用。
1.3 测定方法
1.3.1光合色素的测定 取不同处理植株相同部位功能叶片并除去叶脉迅速擦净,准确称取1.0 g,剪成约0.5 cm宽的叶段后置于盛有25 mL 95%乙醇的容量瓶中,放入26 ℃ 恒温箱中避光保存24 h或直至叶肉组织完全变为白色后,取适量浸提液倒入1 cm光径的比色皿内,在Lambda 25紫外-可见分光光度计上分别测定663、646和470 nm处的吸光度值,根据以下公式计算叶绿素(Chl)含量:叶绿素a含量(Chla)=(12.21×A663-2.81×A646)×0.075;叶绿素b含量(Chlb)=(20.13×A646-5.03×A663)×0.075; 叶绿素总量(T-Chl)=(7.18×A663+17.32×A646)×0.075。Car=(1000A470-3.27[Chla]-104[Chlb])×0.075/227。
1.3.2抗氧化酶活性测定 丙二醛(MDA)用硫代巴比妥酸反应(TBARS)测定[13]。MDA浓度 (μmol·g-1FW)=0.645(A532-A600)-0.056A450。超氧化物歧化酶(SOD)活性通过其抑制氮蓝四唑(NBT)还原能力测定[14]。SOD活性=[(ACK-AE)·V]/(1/2·ACK·W·VT)。过氧化物酶(POD)活性根据愈创木酚法测定[15]。过氧化氢酶(CAT)活性采用紫外吸收法测定[16]。其中FW表示样品鲜重(g),V代表提取液总体积(mL),VT代表测定用提取液体积(mL)。
1.3.3激素测定 内源激素提取和测定方法参照Ge[17]和Hou[18]的方法,并根据本实验材料特点做部分调整:取两菊芋品种相同部位顶芽,采集后立即用去离子水冲洗干净,取1.0 g鲜样及100 mg BHT于研钵中,在弱光环境中液氮保护下快速研磨充分至粉末状,用15 mL预冷的80%甲醇水溶液将样品完全转移至50 mL离心管中并充分摇匀,于4 ℃下避光浸提12 h,浸提液中加入少量PVPP并充分摇匀后于4 ℃及8000 r·min-1下离心10 min,收集上清液并避光保存于4℃中,残渣用10 mL预冷的80%甲醇水溶液重复浸提两次,浸提时间在 6 h左右,合并上清液后,使用氮吹仪除去浸提液中的甲醇并用超纯水补至15 mL,然后选用SPE小柱进行纯化:将上一步获得的提取液通过纯化过的C18固相萃取小柱,弃流出液,用1 mL含0.1%甲酸的20%甲醇溶液洗柱,弃流出液,用1 mL 80%的甲醇水溶液洗脱,收集洗脱液并过0.45 nm有机滤膜后使用高效液相色谱仪检测激素含量。检测柱为安捷伦C18反相柱,检测条件为柱温35 ℃,进样量10 μL,色谱级纯甲醇和0.6%乙酸水溶液45∶55(v/v)等度洗脱,流速为1 mL·min-1,紫外检测波长为254 nm。对照标准品通过出峰时间定性,通过外标法定量。
1.3.4基本指标的测定 用刻度尺直接测量株高和根长。生物量:处理过的菊芋植株取出后用自来水洗净,再用去离子水冲洗干净并用吸水纸快速吸干水分,分别称得地上部和地下部鲜重;将不同部位分别放于烘箱中110 ℃杀青10 min后,75 ℃烘至恒重,称干重。
1.4 数据处理与分析
采用Microsoft Excel 2003和SPSS 20.0软件进行统计分析,采用Duncan新复极差法进行显著性检验(Two-way ANOVA)。数据用各处理平均值±SE表示。不同字母表示在P<0.05差异显著。
2 结果与分析
2.1 盐胁迫对不同基因型菊芋品种生长的影响
盐胁迫导致不同基因型菊芋品种的幼苗生长受到显著抑制(表1)。100和200 mmol·L-1NaCl胁迫下,N1品种株高较对照(CK)分别降低了13.0%和35.1%;M1品种分别降低了10.1%和27.0%。N1品种根长较对照分别降低了15.5%和30.3%,M1品种分别降低了9.8%和17.3%。
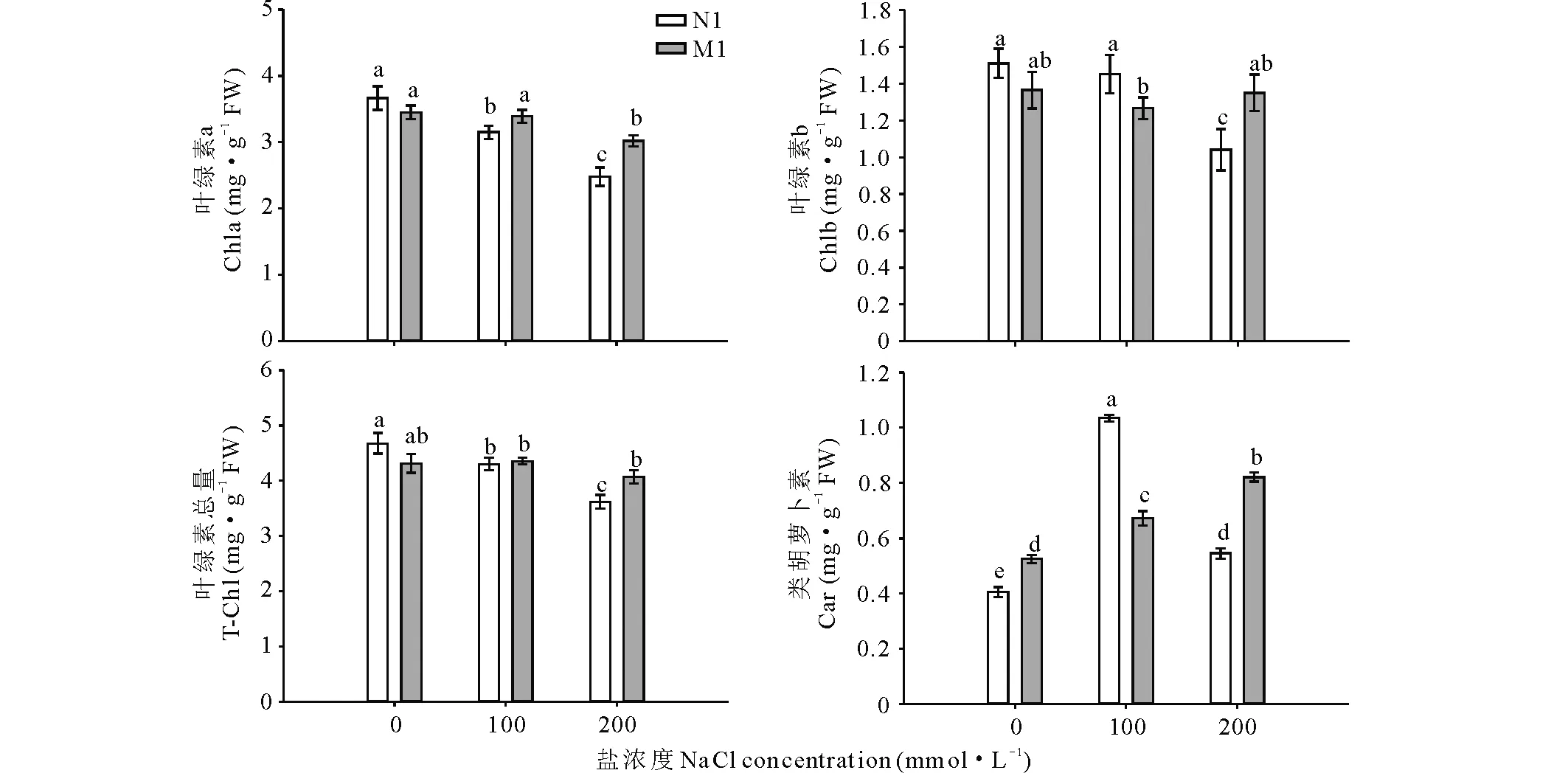
盐胁迫也显著影响了不同基因型菊芋品种的生物量积累。100 mmol·L-1NaCl胁迫下,N1品种的鲜重与干重较CK分别降低了23.6%和20.7%;M1品种的鲜重与干重分别降低了16.5%,16.7%;200 mmol·L-1NaCl胁迫下,N1品种的鲜重与干重较CK分别降低了42.9%和32.3%;M1品种的鲜重与干重分别降低了34.2%和25.5%。高盐胁迫(200 mmol·L-1NaCl)使N1品种的含水率显著降低,部分幼苗开始出现叶片变枯的状况(图1);而盐胁迫对M1品种含水率没有影响(P>0.05)。从两个不同基因型菊芋品种的表型差异分析可知,盐胁迫对菊芋生长的影响M1 表1 盐胁迫对不同基因型菊芋品种生长的影响Table 1 Effect of NaCl stress on the growth of two genotypes of H. tuberosus seedlings 注:表中数据为平均值±标准误。不同NaCl处理间的显著性差异 (P<0.05) 用不同的字母表示。 Note: Values represent means±SE. Significant differences (P<0.05) among the NaCl treatments are indicated by different letters. 图1 不同基因型菊芋品种对盐胁迫的生长响应Fig.1 The growth response of tested jerusalem artichoke varieties to salt stress 盐胁迫也致使菊芋叶片光合色素合成受阻,间接影响了植物光合功能(图2)。100和200 mmol·L-1NaCl胁迫,N1品种的Chl-a较CK分别降低了14.1%和32.3%,Chl-b则分别降低了3.9%和32.4%,T-Chl分别降低了8.5%和23.4%。但是,盐胁迫却促进了Car的合成,100 mmol·L-1NaCl 菊芋叶片Car含量较对照提高了155%,而200 mmol·L-1NaCl胁迫下Car含量也明显增加(P<0.05)。 对于M1品种而言,100 mmol·L-1NaCl胁迫下菊芋叶片Chl-a、Chl-b和T-Chl含量均无显著变化;而200 mmol·L-1NaCl胁迫下Chl-a合成受到抑制,与对照相比降低了13.2%,但Chl-b和tChla无显著变化(P>0.05)。Car的合成随着盐浓度的升高逐渐增高,100和200 mmol·L-1NaCl胁迫下的Car含量分别较对照增加28.0%和57.0%。 由此可知,盐胁迫对菊芋叶片光合色素合成的影响M1 图2 盐胁迫下不同基因型菊芋品种叶绿素a,叶绿素b,总叶绿素和类胡萝卜素含量变化Fig.2 Effects of NaCl stress on chlorophyll a, chlorophyll b, total chlorophyll and carotenoid contents in leaves of different H. tuberosus genotypes 数据以平均值±标准误表示;每组取样数n=3。相同字母表示处理间没有显著差异,采用邓肯氏复极差测验(P<0.05)。The values are presented as means±standard error (SE); n=3 for all groups. The bars represent the SE. Bars with the same letter are not significantly different, denoted by P<0.05 according to Duncan’s multiple range tests. SOD、POD、CAT等酶活性,表征植物的抗氧化能力,与植物抗性和生态适应性直接相关。图3表明,100 mmol·L-1NaCl胁迫下,N1和M1品种叶片SOD活性显著增强,较对照分别提高了31.2%和12.1%;200 mmol·L-1NaCl胁迫下,N1品种叶片的SOD活性较对照显著降低,而M1品种SOD活性无显著影响。100 mmol· L-1NaCl胁迫下,N1与M1品种的POD活性较对照分别增高了43.9%与73.2%,200 mmol·L-1NaCl胁迫N1品种POD活性降低了25.4%,而M1品种却升高了12.8%。100 mmol·L-1NaCl胁迫下,N1和M1品种CAT活性较对照提高了13.3%和12.2%,200 mmol·L-1NaCl胁迫显著抑制了CAT的活性,N1与M1较对照分别降低了35.4%与28.1%。MDA含量两菊芋品种均有所增强。因此,盐胁迫条件下菊芋品种的抗氧化能力M1>N1。 盐胁迫不同程度地影响了菊芋植株内源激素IAA、GA3和ABA合成,不同菊芋品种之间,盐胁迫对内源激素的影响也存在差异(图4)。 100 mmol·L-1NaCl胁迫对两菊芋品种IAA的含量没有明显影响;而200 mmol·L-1NaCl胁迫显著抑制了N1品种叶片中IAA的合成,较对照下降了35.2%(图4)。同样,100 mmol·L-1NaCl胁迫对M1品种GA3含量没有影响,但促进了N1品种中GA3的合成,其含量与对照相比提高了15.0%(图4); 200 mmol·L-1NaCl胁迫促进了M1品种叶片中GA3的合成,其含量增加了13.9%;但N1品种却下降41.4%(图4)。 盐胁迫下,M1品种中ABA含量没有显著变化;但促进了N1品种ABA的合成与积累,与M1相比,N1在叶片中累积了更多的ABA(图4)。N1品种ABA含量较对照分别提高了20.0%和53.2%(图4)。 图3 盐胁迫对不同基因型菊芋品种抗氧化酶活性的影响Fig.3 Effect of NaCl stress on MDA content in leaf and SOD, CAT and POD activities in leaves of different genotypes of H. tuberosus 图4 盐胁迫下不同基因型菊芋品种IAA, ABA和GA3含量的影响Fig.4 Effect of NaCl stress on IAA, ABA, and GA3 contents in leaves of different genotypes of H. tuberosus 在盐胁迫环境下,菊芋为了维持正常生长,消耗了一定的能量来调节植株体内的物质代谢,导致用于组织和器官细胞合成的基本耗能不足,产生了植物的生长受到抑制的现象,这种现象普遍存在于很多其他植物种类中,目前研究最普遍的植物种类大多为小麦(Triticumaestivum)[19]、大豆(Glycinemax)[20]、油菜(Brassicanapus)[21]和一些盐生植物[22]。 大量研究认为,植物在盐胁迫下光合作用速率下降是由光合色素含量的不足引起的[18]。有报道记载,盐胁迫造成光合作用下降的主要原因是植物体内叶绿素酶的活性增强,加速了叶片内叶绿素的降解,最终导致总叶绿素(T-Chl)含量降低[23]。NaCl浓度在100和200 mmol·L-1时,N1菊芋品种叶片中Chl-a、Chl-b和T-Chl均有显著下降趋势,但M1品种仅在高盐200 mmol·L-1时,Chl-a含量显著降低,其他情况下3种色素含量无明显变化。由此可知,对于抗盐性强的菊芋品种M1,适度的盐胁迫并未影响植物的光合作物,这与陈健妙等[24]、薛延丰等[25]的研究结果类似。菊芋正常光合作用,可以有效缓解盐胁迫过程中产生的过多活性氧自由基(ROS),从而保证了逆境植物的生长发育[26]。 植物适应盐胁迫环境与ROS诱导保护机制有关[27-29]。MDA是脂质过氧化的细胞毒素产物,可以作为ROS积累程度的标志[28]。不同基因型菊芋品种在盐胁迫条件下MDA在体内不断积累,表明盐胁迫可能通过ROS积累诱导膜脂产生过氧化反应,导致MDA含量不断增高。盐胁迫下,不同基因型菊芋品种在低盐胁迫下SOD、POD以及CAT活性较各自对照均显著升高,但高盐胁迫却抑制了各种保护酶的活性,表明高盐胁迫损害了植物体ROS的清除功能。相比而言,N1品种体内各种酶活性较M1品种减幅较大,表明N1品种的抗氧化系统遭受较大损伤。本研究中,两品种苗系的3种酶活性随盐浓度的增加表现出明显的降低,可能的原因是高浓度盐处理下植株体内产生过多的ROS,系统不能及时清除造成对细胞膜系统的损坏,从而抑制了这3种酶活性的下调。 与抗氧化机制不同的是,盐胁迫可以提高植物体内ABA水平,从而降低叶片扩张速度并降低气孔导度,减少植物水分蒸腾,减少渗透伤害以及盐离子伤害[29]。GA3可降低叶片气孔阻力,加速叶片蒸腾,提高植物体内水分的利用效率。本研究结果显示,盐胁迫显著促进了N1品种ABA含量的积累,而M1中ABA含量在不同盐处理下没有显著变化。低盐胁迫对M1品种IAA与GA3含量没有显著影响,但却刺激了N1中的积累,两品种ABA含量无明显差异,表明低盐环境下N1可通过提高IAA与GA3含量来维持植株的正常生长。高盐胁迫下,N1中IAA与GA3含量显著下降,且明显低于M1品种,而ABA含量却明显增高且高于M1品种,可见高盐环境下,M1品种的耐盐途径主要是提高IAA与GA3含量,而N1品种则是利用ABA含量高的优势抵御盐胁迫。由此可知,不同基因型菊芋品种生态适应性存在明显差异,针对低盐和高盐环境主要通过抗氧化系统和内源激素调节发挥作用,这为菊芋内陆盐碱地适植品种的筛选及种植提供了理论依据。 参考文献References: [1] Denoroy P. The crop physiology ofHelianthustuberosusL.: a model oriented view. Biomass and Bioenergy, 1996, 11(1): 11-32. [2] Wu R N, Zhu T X, Yu Y Q,etal. Study on status and exploiting potential ofHelianthustuberosus. Acta Prataculturae Sinica, 2013, 30(8): 1295-1300. 乌日娜, 朱铁霞, 于永奇, 等. 菊芋的研究现状及开发潜力. 草业科学, 2013, 30(8): 1295-1300. [3] Abdalla N, Domokos-Szabolcsy E, El-Ramady H,etal. Jerusalem artichoke (HelianthustuberosusL.): a review ofinvivoandinvitropropagation. International Journal of Horticultural Science, 2014, 20(3/4): 131-136. [4] Liu Z P, Long X H, Lu L,etal. The study of bio-energy plants development from non-tillage resource of Coastal Mudflat. Journal of natural resources, 2008, 23(1): 9-14. 刘兆普, 隆小华, 刘玲, 等. 海岸带滨海盐土资源发展能源植物资源的研究.自然资源学报, 2008, 23(1): 9-14. [5] Zhao G M, Mehta S K, Liu Z P. Use of saline aquaculture wastewater to irrigate salt-tolerant jerusalem artichoke and sunflower in semiarid coastal zones of China. Agricultural Water Management, 2010, 97: 1987-1993. [6] Zhang G M, Liu Z P, Cheng M D,etal. Effect of saline aquaculture effluent on salt tolerant jerusalem artichoke (HelianthustuberosusL.) in a semi-arid coastal area of China. Pedosphere, 2006,16: 762-769. [7] Wu C L, Yin J L, Xu Y C,etal. Effects of alkaline stress on growth, photosynthesis and antioxidation ofHelianthustuberosusseedlings. Acta Bot Boreali-Occident Sin, 2006, 26(30): 447-454. 吴成龙, 尹金来, 徐阳春. 碱胁迫对菊芋幼苗生长及其光合作用和抗氧化作用的影响. 西北植物学报, 2006, 26(3): 447-454. [8] Long X H, Liu Z P, Zhen Q S,etal. Effects of seawater with different concentrations on growth and physiological and biochemical characteristics ofHelianthustuberosusseedlings. Acta Ecologica Sinica, 2005, 25(8): 1881-1890. 隆小华, 刘兆普, 郑青松, 等. 不同浓度海水对菊芋幼苗生长及生理生化特性的影响. 生态学报, 2005, 25(8): 1881-1890. [9] Wang L, Ling X H, Hao L X,etal. Effects of nitrogen form on the photochemical efficiency of PSⅡ and antioxidant characteristics ofJerusalemartichokeseeding under salt stress. Acta Prataculturae Sinica, 2012, 21(1): 133-140. 王磊, 隆小华, 郝连香, 等. 氮素形态对盐胁迫下菊芋幼苗PSⅡ光化学效率及抗氧化特性的影响. 草业学报, 2012, 21(1): 133-140. [10] Rhoades J D, Kandiah A, Mashali A M. The use of saline waters for crop production. Rome: Food and Agriculture Organization of the United Nations, 1992. [11] Newton P J, Myers B A, West D W. Reduction in growth and yield of jerusalem artichoke caused by soil salinity. Journal of Irrigation and Drainage Engineering-asce, 1991, 12: 213-222. [12] Maas E V, Grattan S R. Crop yields as affected by salinity//Skaggs R W, van Schilfgaarde. Agriculture drainage. Agronomy Monograph. WI: ASA, CSSA, SSSA, Madison, 1999, 38: 55-108. [13] Cakmak I, Horst W J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycinemax). Physiologia Plantarum, 2006, 83(3): 463-468. [14] Giannopolitis C N, Ries S K. Superoxide dismutase: I. occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314. [15] Chance B, Maehly A C. Assay of catalases and peroxidases. Methods in Enzymology, 1955, 2(55): 764-775. [16] Bergmeyer H U, Gawehn K, Grassl M. Methods of enzymatic analysis. In: Bergmeyer H U, Ed. Verlag Chemie, Wienheim, 1974, Vol.1, 481-482. [17] Ge L, Yong J W H, Tan S N,etal. Analysis of some cytokinins in coconut (CocosnuciferaL.) water by micellar electrokinetic capillary chromatography after solid-phase extraction. Journal of Chromatography A, 2004, 1048(1): 119-126. [18] Hou S, Zhu J, Ding M,etal. Simultaneous determination of gibberellic acid, indole-3-acetic acid and abscisic acid in wheat extracts by solid-phase extraction and liquid chromatography-electrospray tandem mass spectrometry. Talanta, 2008, 76(4): 798-802. [19] Datta J K, Nag S, Banerjee A,etal. Impact of salt stress on five varieties of wheat (TriticumaestivumL.) cultivars under laboratory condition. Journal of Applied Sciences and Environmental Management, 2009, 13(3): 93-97. [20] Dolatabadian A, Sanavy S A M M, Ghanati F. Effect of salinity on growth, xylem structure and anatomical characteristics of soybean. Notulae Scientia Biologicae, 2011, 3(1): 41-45. [21] Tunçtürk M, Tunçtürk R, Yildirim B,etal. Effect of salinity stress on plant fresh weight and nutrient composition of some Canola (BrassicanapusL.) cultivars. African Journal of Biotechnology, 2013, 10(10): 1827-1832. [22] Akhzari D A, Pessarakli M. Studying the effects of salinity stress on the growth of various halophytic plant species (Agropyronelongatum,KochiaprostrataandPuccinelliadistans). World Applied Sciences Journal, 2012, 16: 998-1003. [23] Demmigadams A B, Iii W. Photoprotection and other responses of plants to high light stress. Annual Review of Plant Biology, 1992, 43(1): 599-626. [24] Chen J M, Zheng Q S, Liu Z P,etal. Growing and photosynthetic response ofJatrophacurcasL. seedlings to salt stress. Acta Ecologica Sinica, 2009, 29(3): 1356-1365. 陈健妙, 郑青松, 刘兆普, 等. 麻疯树(JatrophacurcasL.)幼苗生长和光合作用对盐胁迫的响应. 生态学报, 2009, 29(3): 1356-1365. [25] Xue Y F, Liu Z P. A Preliminary study of screening salt-resistive varieties ofHelianthustuberosusL. using chlorophyll fluorescence parameters. Chinese High Technology Letters, 2008, 18(7): 766-770. 薛延丰, 刘兆普. 利用叶绿素荧光参数筛选抗盐菊芋品种的初步研究. 高技术通讯, 2008, 18(7): 766-770. [26] Moharekar S, Lokhande S, Hara T,etal. Effect of salicylic acid on chlorophyll and carotenoid contents of wheat and moong seedlings. Photosynthetica, 2003, 41(2): 315-317. [27] Breusegem F V, Vranová E, Dat J F,etal. The role of active oxygen species in plant signal transduction. Plant Science, 2001, 161(3): 405-414. [28] Meloni D A, Oliva M A, Martinez C A,etal. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress. Environmental and Experimental Botany, 2003, 49(1): 69-76. [29] Cachorro P, Martínez R, Ortiz A,etal. Abscisic acid and osmotic relations inPhaseolusvulgarisL. shoots under salt stress. Journal of Plant Growth Regulation, 1995, 14(2): 99-104.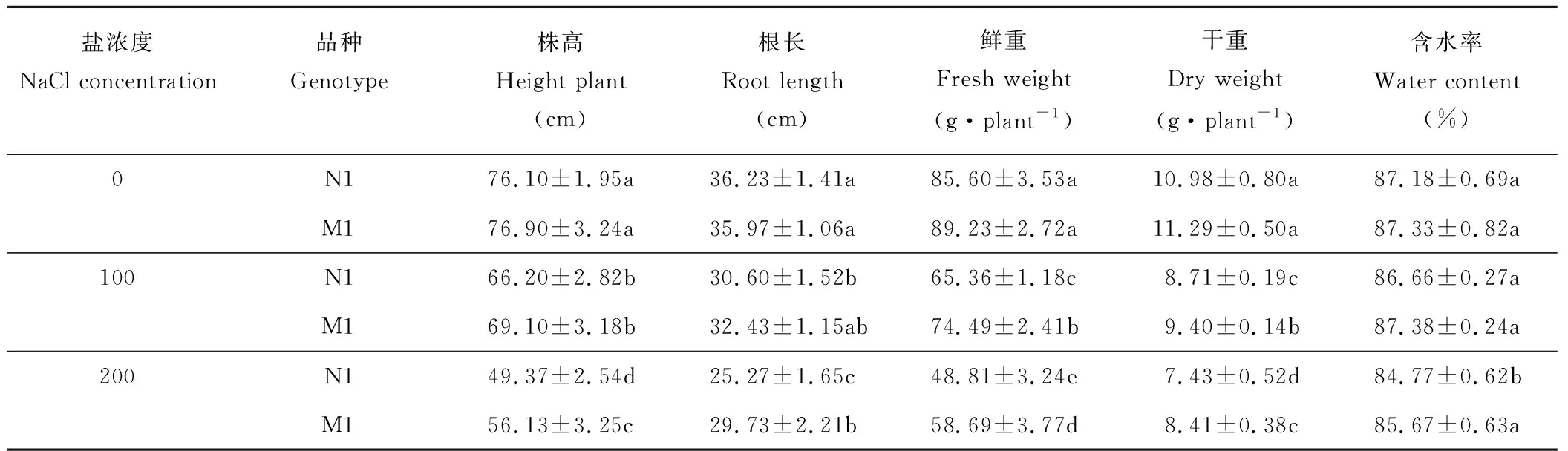

2.2 盐胁迫对不同基因型菊芋品种光合色素的影响
2.3 盐胁迫对不同基因型菊芋品种抗氧化系统的影响
2.4 盐胁迫对不同基因型菊芋品种内源激素的影响


3 讨论

