异源表达WZY2-1基因提高拟南芥植株抗旱性
强治全,杨文博,张帅 ,于正阳,史学英,王鑫,朱维宁,张林生*
(1.西北农林科技大学生命科学学院,旱区作物逆境生物学国家重点实验室, 陕西 杨凌712100;2.河南省农业科学院粮食作物研究所,河南 郑州 450002;3.西北大学生命科学学院, 陕西 西安710069)
脱水素(dehydrins,DHNs)属于胚胎发育晚期丰富蛋白(late embryogenesis abundant protein, LEA)第二家族[1]。该类蛋白具有3个保守的区域:K、Y和S片段。其中,K片段(EKKGIMDKIKEKLPG)是脱水素共有的,它可以形成兼性α-螺旋,在植物失水情况下,α-螺旋的形成能够防止细胞内蛋白变形和细胞膜损伤[2]。此外,有些脱水素K片段之间富含极性氨基酸,称作Φ片段,它可能参与了细胞质组分的相互作用[3]。S片段由一段串联的丝氨酸(SSSSS)组成,可以被蛋白激酶磷酸化,与脱水素的入核有关[4]。Y片段的保守序列为(VTDEYGNP),目前关于Y片段的功能尚不清楚。根据脱水素的K、Y和S片段组合,将脱水素分成5个亚型:YnSKm、Kn、KnS、SKn和YnKm型[5]。
近些年,在植物抗逆分子机理研究中,脱水素已成为植物耐逆程度的分子指标。目前已经从玉米(Zeamays)[6]、大麦(Hordeumvulgare)[7]、高粱(Sorghumbicolor)[8]、水稻(Oryzasativa)[9]等多种农作物中克隆和分离出脱水素基因。脱水素的亚细胞定位多种多样,但主要分布于细胞质和细胞核。通过对仙人掌(Opuntiastricta)脱水素OpsDHN1亚细胞定位,发现OpsDHN1蛋白主要定位于细胞核和细胞质[10]。Yang等[11]研究发现小麦WZY2蛋白的亚细胞定位受外界环境条件的影响,在正常情况下,小麦(Triticumaestivum)WZY2蛋白主要分布在细胞核和细胞质,但在低温处理下,一些WZY2蛋白向细胞膜聚集。许多实验证明脱水素可以作为酶的保护剂,Drira等[12]对小麦DHN5及突变体研究表明,低温胁迫下DHN5及突变体可以保护乳酸脱氢酶(lactate dehydrogenase,LDH)活性,并且认为K片段可能起重要作用。与此类似的还有WZY2[11]、WDHN1[13]等脱水素。脱水素在植物抵御各种逆境胁迫中具有重要作用,Saibi等[14]将大麦的脱水素基因DHN5转化拟南芥(Arabidopsisthaliana),获得的转基因株系具有较强的抗盐性;Liu等[1]将番茄(Lycopersiconesculentum)的脱水素基因ShDHN过表达,增强了番茄对干旱、低温、盐等多种胁迫的耐受性;相反的,Chen等[15]将辣椒(Capsicumannuum)的脱水素基因CaDHN1缺失,获得了对低温、盐和渗透胁迫敏感性植株。
小麦WZY2-1基因全长1740 bp,编码579个氨基酸,分子量约60 kDa,含有9个保守的K片段,属于典型的Kn型脱水素。研究表明,WZY2-1基因受干旱、低温和盐渍胁迫诱导[16]。本研究对WZY2-1蛋白进行了亚细胞定位,研究了温度胁迫下WZY2-1蛋白对LDH酶活性的影响,并获得了转WZY2-1基因的拟南芥植株,对转基因植株干旱耐逆性进行了分析。
1 材料与方法
1.1 植物材料
供试拟南芥(生态型 Columbia)用70%乙醇表面灭菌1 min,然后用10%的NaClO溶液消毒5 min,用无菌水冲洗3次。将无菌的拟南芥种子铺在0.5 MS固体培养基上(pH 5.8),4 ℃处理3 d,移至光照培养箱[16 h 光照, 8 h 黑暗, (22±1) ℃],生长7 d后,移栽至9 cm的栽培盆中,于培养室[16 h 光照, 8 h 黑暗, (22±1) ℃]中培养。
1.2 小麦WZY2-1基因亚细胞定位载体构建与亚细胞定位分析
通过对pBI121载体改造,转化大肠杆菌TOP10,涂板,37 ℃培养,挑单克隆,摇菌,菌液PCR检测,用Xho I和Sal I双酶切检测,阳性克隆测序(上海生工生物工程有限公司)。提取构建的亚细胞定位载体pBI121-WZY2-1-GFP(天根公司),转化农杆菌GV3301,涂板,28 ℃培养,挑单克隆,摇菌,菌液PCR检测,获得含有pBI121-WZY2-1-GFP载体的农杆菌。
将含有pBI121-WZY2-1-GFP农杆菌接种含有50 μg·mL-1卡纳抗生素和利福平的YEB培养基中,28 ℃培养至OD600到0.6,2800 r·min-1离心10 min,收集菌体,用含有200 mmol·L-1的乙酰丁香酮、10 mmol·L-1的MgCl2和0.02%的Sillwet-77的0.5 MS液体培养基悬浮,室温放置4 h,作为浸染液。取新鲜的洋葱切开鳞茎,用解剖刀挑取1 cm2的洋葱内表皮细胞,置于0.5 MS固体培养基上,28 ℃暗培养24 h。将预培养的洋葱表皮细胞在浸染液中浸泡30 min,滤干菌液,平放于0.5 MS固体培养基上,置于光照培养箱(16 h 光照, 8 h 黑暗, 25 ℃)培养2 d。取培养2 d的洋葱表皮细胞,用1 mg·mL-1的DAPI溶液染色5 min,制片,荧光显微镜观察。
1.3 LDH酶保护实验
取20 μL将乳酸脱氢酶(lactate dehydrogenase,LDH)(EC1.1.1.27, Sigma)分别与WZY2-1蛋白、BSA等体积混合,对混合样品进行不同胁迫处理。冷融胁迫:将样品用液氮速冻30 s,25 ℃水浴解冻5 min。45 ℃处理:将样品经45 ℃处理30 min。取40 μL胁迫处理的样品加入到710 μL的反应体系[10 mmol·L-1Na3PO4,pH 7.4,10 mmol·L-1丙酮酸,0.2 mmol·L-1还原性辅酶I(nicotinamide adenine dinucleotide,NADH)]中,用SpectraMax M2酶标仪测定A340吸光值的减少值。测定程序:25 ℃水浴30 s,每隔15 s测定1次,持续测定5 min。以未处理的LDH酶活性为100%,实验重复3次。LDH酶残留活性计算:LDH酶残留活性=(处理Δ340/未处理Δ340)×100%。
1.4 小麦WZY2-1基因过表达载体构建与拟南芥转化
设计含有Xba I和Sac I酶切位点的引物(TGF: 5′-GCTCTAGAATGCACGACGCCGAC-3′;TGR: 5′-CGAGCTCTTAGTTCAGTCCAGGC-3′),PCR扩增WZY2-1基因的cDNA全长序列,回收PCR产物。将PCR产物连接至pBI121载体上,转化大肠杆菌TOP10,涂板,37 ℃培养,挑单克隆,摇菌,菌液PCR检测,阳性克隆测序(上海生工生物工程有限公司)。将过表达载体pBI121-WZY2-1转化农杆菌GV3301,28 ℃培养,挑单克隆,摇菌,菌液PCR检测,获得含pBI121-WZY2-1载体的重组菌。利用花絮浸染法转化拟南芥,收取T0代种子。
1.5 转基因拟南芥筛选和RT-PCR分析阳性植株中WZY2-1基因的表达
将收取的T0代种子铺在含有30 μg·mL-1卡纳抗生素的0.5 MS培养基(pH 5.8)上培养,将绿色幼苗转移到营养土培养20 d,提取叶片基因组DNA(天根公司)。上游引物包含pBI121载体本身序列,下游引物位于WZY2-1基因序列内部,引物序列JCF: 5′-AGCTGCCTGGACTGAACT-3′; JCR: 5′-GCCTCTTCGCTATTACGCCAGGC-3′。以提取的T1代拟南芥基因组DNA为模板,进行PCR检测,收取阳性植株种子,继续培养筛选,直到获得T3代纯合转基因株系种子。
将消毒的野生型拟南芥和3个株系的T3代过表达WZY2-1的转基因纯合体种子铺种在0.5 MS培养基上,4 ℃培养3 d后,于光照培养箱培养2周。按照TRIzol试剂(Invitrogen)的操作说明, 提取野生型和T4代转基因植株幼苗总RNA。以提取的RNA为模板, 按照反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)的操作说明反转录成cDNA。以拟南芥的Actin2基因为内参,引物序列ActF: 5′-TATCGCTGACCGTATGAG-3′; ActR: 5′-CTGAGGGAAGCAAGAATG-3′,用WZY2-1基因特异性引物(WF: 5′-CGGAGTGACCGATAAGG-3′; WR: 5′-TGCCAGTTGTTTCGTTGT-3′)进行RT-PCR分析,PCR反应体系25 μL, 包括2×SYBR Premix 12.5 μL, 模板2 μL, 上、下游引物各1 μL。反应程序为95 ℃预变性30 s, 然后95 ℃ 5 s, 55 ℃ 20 s, 39个循环。
1.6 干旱胁迫下转WZY2-1基因拟南芥表型分析
取同一时间种植和收获的野生型拟南芥和T3代转WZY2-1的拟南芥3个株系种子在4 ℃放置3 d,种子消毒后,铺于0.5 MS培养基上培养,萌发后移栽至小花盆,转移到培养室培养。正常条件生长20 d后,脱水处理14 d后,观察野生型和转基因植株表型。
1.7 干旱胁迫下转WZY2-1基因拟南芥生理指标测定
将生长20 d的野生型和T3代转WZY2-1基因的拟南芥,干旱胁迫36 h,取成熟叶片,测定其生理指标。试验方法见文献[14,17-18]。采用酸性茚三酮法测定脯氨酸含量;采用分光光度法测定叶绿素和MDA的含量;相对含水量按照公式:相对含水量=[(鲜重-干重)/鲜重]×100%,实验重复3次。
2 结果与分析
2.1 小麦WZY2-1基因载体构建与亚细胞定位分析
对pBI121载体进行改造,获得pBI121-WZY2-1-GFP融合蛋白表达载体,转化至大肠杆菌感受态细胞TOP10中。对阳性克隆测序,测序结果表明,亚细胞定位载体构建成功,命名pBI121-WZY2-1-GFP(图1A)。
将pBI121-WZY2-1-GFP载体转化农杆菌GV3301,菌液PCR获得阳性重组菌。通过农杆菌浸染洋葱表皮细胞,WZY2-1蛋白在整个细胞中的亚细胞位置如图1B所示。通过对荧光信号分析,推测WZY2-1蛋白主要分布于细胞核和细胞膜。

图1 WZY2-1蛋白的亚细胞定位Fig.1 Subcellular localization of WZY2-1 protein (A) 亚细胞定位载体示意图。35S-pro代表花椰菜花叶病毒的启动子;WZY2-1代表WZY2-1蛋白编码区去掉终止子;GFP代表绿色荧光蛋白;NOS代表胭脂碱合成酶基因终止序列。(B)WZY2-1融合蛋白在洋葱表皮细胞的荧光显微观测图(Bar=100 μm)。GFP通道、DAPI通道(细胞核)和明场都进行展示。 (A) Diagram of the constructs of pBI121-WZY2-1-GFP used for subcellular localization. 35S-Pro, Cauliflower mosaic virus 35S promoter; WZY2-1, the WZY2-1 coding region without the stop codon; GFP, green fluorescent protein; NOS, nopaline synthase terminator. (B) Fluorescent microscopic images of WZY2-1-GFP fusion protein in onion epidermal cells (Bar=100 μm). The GFP channel, DAPI channel (nucleus) and bright-field images were showed.
2.2 非生物胁迫下WZY2-1蛋白保护LDH酶活性
为了研究WZY2-1蛋白对LDH酶的保护作用,将 LDH酶分别与WZY2-1蛋白、BSA等体积混合,对混合样品进行不同胁迫处理后,测定LDH酶活性(图2)。结果表明,冻融处理后,Na3PO4缓冲液LDH几乎没有保护作用,BSA和WZY2-1蛋白分别能够维持70%和75%的LDH酶活性;45 ℃处理后,Na3PO4缓冲液同样没有保护作用,BSA和WZY2-1蛋白分别能够维持71%和58%的LDH酶活性。说明WZY2-1蛋白在低温和高温下具有显著的LDH酶的保护作用。
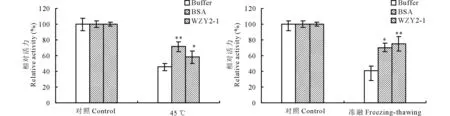
图2 冷融及45 ℃胁迫下WZY2-1蛋白对LDH酶活力的保护Fig.2 WZY2-1 protected LDH activity from freezing-thawing and 45 ℃ stresses in vitro 柱状图上星号表示Buffer和BSA、WZY2-1对LDH酶活性保护的差异显著性 (*, P<0.05; **, P<0.01)。Different asterisk on top of bars indicate the significant differences of the LDH activity between Buffer and BSA or WZY2-1 protein (*, P<0.05; **, P<0.01).
2.3 转基因拟南芥中WZY2-1基因的表达

图3 WZY2-1基因在野生型和转基因拟南芥表达量Fig.3 Relative expression level of WZY2-1 in the wild-type and the transgenic lines 柱状图上星号表示野生型(WT)和转基因(L1、L3、L6)植株WZY2-1基因表达水平的差异显著性 (*, P<0.05; **, P<0.01)。Different asterisk on top of bars indicate the significant differences of the relative expression level between wild-type (WT) and transgenic A. thaliana(L1,L3 and L6) (*, P<0.05; **, P<0.01).
为了进一步研究WZY2-1在植物中的功能,构建pBI121-WZY2-1转基因载体。通过花絮浸染法获得了T0代转基因拟南芥种子。通过卡纳抗生素筛选和基因组DNA的PCR检测,获得T1代阳性植株,收取T1代种子。继续筛选,最终获得了T3代纯合转基因株系种子。
提取3个株系T3代转基因纯合株系的RNA,通过实时荧光定量PCR分析WZY2-1基因的表达情况。结果如图3所示,表明WZY2-1基因能够在转基因株系中过表达。
2.4 干旱胁迫下转WZY2-1基因拟南芥表型分析
将正常生长20 d的拟南芥植株脱水处理14 d后,表型观测如图4所示,从图看出转基因植株叶片萎蔫面积比野生型植株少,并且转基因植株的叶片也比野生型大。说明异源过表达小麦WZY2-1基因可以提高拟南芥植株干旱胁迫的耐受性。

图4 干旱胁迫下野生型和转基因拟南芥叶片萎蔫程度Fig.4 The leaves wilting degree of wild-type and transgenic A. thaliana under dehydration stress
2.5 干旱胁迫下转WZY2-1基因拟南芥生理指标分析
实验测定胁迫处理36 h后转WZY2-1基因和野生型拟南芥的相对含水量、脯氨酸、叶绿素和MDA含量(图5)。从结果可知,正常生长情况下,转基因植株较野生型植株生理指标差异不明显,但在干旱胁迫36 h后,转基因株系L1、L3、L6的相对含水量可达71.0%~71.9%,而野生型拟南芥相对含水量只有65.6%;转基因植物脯氨酸含量比野生型拟南芥分别高33.2%、15.7%和38.5%;叶绿素含量比野生型分别高13.9%、10.3%和7.3%;相反的,转基因植株的丙二醛含量比野生型分别低33.7%、33.3%和33.5%。综上结果表明,小麦WZY2-1基因可以提高拟南芥对干旱引起的氧化胁迫抵抗能力。

图5 干旱胁迫下野生型拟南芥和转基因拟南芥的生理指标Fig.5 Analysis of physiological indexes of wild-type and transgenic A. thaliana under drought stress 柱状图上星号表示野生型(WT)和转基因(L1、 L3 和 L6)生理指标的差异显著性(*, P<0.05; **, P<0.01)。Different asterisk on top of bars indicate the significant differences of the physiological indexes between wild-type(WT)and transgenic A. thaliana(L1,L3 and L6)(*, P<0.05; **, P<0.01).
3 讨论
解析植物抗逆分子机制,有利于获得优良抗逆性状的作物,以提高作物的产量。干旱是影响作物生长发育和产量的主要因素之一。脱水素作为植物抗逆蛋白的重要成员,响应干旱、低温、高温等多种逆境胁迫[19]。脱水素具有较强的亲水性,在细胞缺水的情况下,可以充当溶剂分子,防止细胞内蛋白的聚集失活[5]。脱水素亚细胞定位多种多样,但主要定位于细胞质和细胞核,也有定位在线粒体、叶绿体和细胞膜等[10,20-21]。本研究将WZY2-1-GFP融合蛋白在洋葱表皮细胞瞬时表达,观测结果发现该融合蛋白主要定位在细胞核和细胞膜。许多研究发现脱水素入核与S片段相关,然而WZY2-1蛋白不含S片段,这与先前研究结果一致:S片段与脱水素入核相关但不是必需的[22]。
人们研究发现脱水素可以结合金属离子和其他生物大分子,像蛋白质、核苷酸以及带负电的磷脂分子等。认为在逆境环境下脱水素具有酶的保护剂、离子缓冲剂、膜的稳定剂及分子伴侣等功能[23]。脱水素作为酶的保护剂主要通过阻止逆境胁迫下的蛋白聚集,但是对于其具体机制尚不清楚。LDH酶是一种冷敏感性酶,已经被用来研究脱水素的酶保护功能参照物。本研究表明,小麦WZY2-1蛋白具有保护温度胁迫下LDH酶活性的功能。目前普遍认为,脱水素保护LDH酶活性的机制,是通过在蛋白外围形成“分子盾”保护蛋白的活性[20]。
植物遭受逆境胁迫会积累大量的超氧阴离子,引起细胞膜氧化。脯氨酸作为渗透物质,植物体内游离脯氨酸含量往往决定植物的抗旱能力[24]。对野生型和转WZY2-1基因的拟南芥植株脯氨酸含量的分析表明,干旱胁迫下转基因拟南芥植株脯氨酸含量较高。光合作用是植物积累有机物的重要过程,而植物进行光合作用需要大量叶绿素。在干旱条件下,植物不仅会引起细胞膜受损,也会影响叶绿素的合成,导致植物光合效率降低[25]。本研究表明,转小麦WZY2-1基因的拟南芥植株具有较高的叶绿素含量。丙二醛是膜脂过氧化的产物,植物体内丙二醛含量是衡量植物遭受氧化胁迫程度的重要指标[14]。本实验测定结果表明,野生型拟南芥较转基因植株具有更高的丙二醛含量。综上结果表明,异源表达小麦WZY2-1基因可以提高拟南芥的干旱胁迫耐受性。
4 结论
通过对WZY2-1蛋白的亚细胞定位发现,WZY2-1蛋白主要定位在细胞核和细胞膜。实验还分析了温度胁迫下WZY2-1蛋白对LDH酶的保护作用,发现WZY2-1蛋白可以保护LDH酶的活性,还获得了转WZY2-1基因的拟南芥植株,通过表型和生理指标研究表明,小麦WZY2-1基因可以提高拟南芥对干旱胁迫的耐受性。
参考文献References:
[1] Liu H, Yu C, Li H,etal. Overexpression of ShDHN, a dehydrin gene fromSolanumhabrochaitesenhances tolerance to multiple abiotic stresses in tomato. Plant Science, 2015, 231: 198-211.
[2] Close T J. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins. Physiologia Plantarum, 1996, 97(4): 795-803.
[3] Carpenter J F, Crowe J H. The mechanism of cryoprotection of proteins by solutes. Cryobiology, 1988, 25(3): 244-255.
[4] Jensen A B, Goday A, Figueras M,etal. Phosphorylation mediates the nuclear targeting of the maize Rab17 protein. Plant Journal, 1998, 13(5): 691-697.
[5] Hara M, Endo T, Kamiya K,etal. The role of hydrophobic amino acids of K-segments in the cryoprotection of lactate dehydrogenase by dehydrins. Journal of Plant Physiology, 2016, 210: 18-23.
[6] Koag M C, Wilkens S, Fenton R D,etal. The K-segment of maize DHN1 mediates binding to anionic phospholipid vesicles and concomitant structural changes. Plant Physiology, 2009, 150(3): 1503-1514.
[7] Qian G, Ping J J, Zhang Z,etal. Molecular cloning and protein structure prediction of barley (HordeumvulgareL.) Dhn6 gene and its expression pattern under dehydration conditions. Hereditas, 2011, 33(3): 270-277.
钱刚, 平军娇, 张珍, 等. 大麦Dhn6基因的克隆、蛋白质结构预测与干旱胁迫表达模式. 遗传, 2011, 33(3): 270-277.
[8] Halder T, Agarwal T, Ray S. Isolation, cloning, and characterization of a novelSorghumdehydrin (SbDhn2) protein. Protoplasma, 2016, 253(6): 1475-1488.
[9] Lee S C, Lee M Y, Kim S J,etal. Characterization of an abiotic stress-inducible dehydrin gene, OsDhn1, in rice (OryzasativaL.). Molecules and Cells, 2005, 19(2): 212-218.
[10] Hernandez-Sanchez I E, Maruri-Lopez I, Ferrando A,etal. Nuclear localization of the dehydrin OpsDHN1 is determined by histidine-rich motif. Frontiers in Plant Science, 2015, 6: 702.
[11] Yang W, Zhang L, Lü H,etal. The K-segments of wheat dehydrin WZY2 are essential for its protective functions under temperature stress. Frontiers in Plant Science, 2015, 6: 406.
[12] Drira M, Saibi W, Brini F,etal. The K-segments of the wheat dehydrin DHN-5 are essential for the protection of lactate dehydrogenase and beta-glucosidase activitiesinvitro. Molecular Biotechnology 2013, 54(2): 643-650.
[13] Liu H, Du Y, Li H,etal. Cloning, expression and functional analysis of WDHN1 gene from wheat (Triticumaestivum). Chinese Journal of Agricultural Biotechnology, 2016, 24(11): 1676-1687.
刘浩, 杜娅, 李核, 等. 小麦WDHN1基因的克隆、表达及功能分析. 农业生物技术学报, 2016, 24(11): 1676-1687.
[14] Saibi W, Feki K, Ben Mahmoud R,etal. Durum wheat dehydrin (DHN-5) confers salinity tolerance to transgenicArabidopsisplants through the regulation of proline metabolism and ROS scavenging system. Planta, 2015, 242(5): 1187-1194.
[15] Chen R G, Jing H, Guo W L,etal. Silencing of dehydrin CaDHN1 diminishes tolerance to multiple abiotic stresses inCapsicumannuumL. Plant Cell Reports, 2015, 34(12): 2189-2200.
[16] Qiang Z Q, Liang Y J, Yu Z Y,etal. Cloning and functional analysis of wzy2-1 gene in wheat. Acta Agronomica Sinica, 2016, 42(8): 1253-1258.
强治全, 梁雅珺, 于正阳, 等. 小麦wzy2-1基因的克隆及功能分析. 作物学报, 2016, 42(8): 1253-1258.
[17] Park S C, Kim Y H, Jeong J C,etal. Sweetpotato late embryogenesis abundant 14 (IbLEA14) gene influences lignification and increases osmotic- and salt stress-tolerance of transgenic calli. Planta, 2011, 233(3): 621-634.
[18] Li Z, Peng Y, Ma X. Different response on drought tolerance and post-drought recovery between the small-leafed and the large-leafed white clover (TrifoliumrepensL.) associated with antioxidative enzyme protection and lignin metabolism. Acta Physiologiae Plantarum, 2013, 35(1): 213-222.
[19] Jing H, Li C, Ma F,etal. Genome-wide identification, expression diversication of dehydrin gene family and characterization of CaDHN3 in pepper (CapsicumannuumL.). PloS One, 2016, 11(8): e0161073.
[20] Candat A, Paszkiewicz G, Neveu M,etal. The ubiquitous distribution of late embryogenesis abundant proteins across cell compartments inArabidopsisoffers tailored protection against abiotic stress. Plant Cell, 2014, 26(7): 3148-3166.
[21] Asghar R, Fenton R D, Demason D A,etal. Nuclear and cytoplasmic localization of maize embryo and aleurone dehydrin. Protoplasma, 1994, 177(3/4): 87-94.
[22] Wisniewski M, Webb R, Balsamo R,etal. Purification, immunolocalization, cryoprotective, and antifreeze activity of PCA60: A dehydrin from peach (Prunuspersica). Physiologia Plantarum, 1999, 105(4): 600-608.
[23] Atkinson J, Clarke M W, Warnica J M,etal. Structure of an intrinsically disordered stress protein alone and bound to a membrane surface. Biophysical Journal, 2016, 111(3): 480-491.
[24] Zong H, Liu E E, Guo Z F,etal. Effects of LaCl3and CPZ on proline accumulation of rice seedling under drought and salt stresses. Acta Agronomica Sinica, 2001, 27(2): 173-177.
宗会, 刘娥娥, 郭振飞, 等. 干旱、盐胁迫下LaCl3和CPZ对稻苗脯氨酸积累的影响. 作物学报, 2001, 27(2): 173-177.
[25] Ajigboye O O, Lu C, Murchie E H,etal. Altered gene expression by sedaxane increases PSII efficiency, photosynthesis and growth and improves tolerance to drought in wheat seedlings. Pesticide Biochemistry and Physiology, 2017, 137: 49-61.

