AtSOS基因在紫花苜蓿中的表达及其耐盐性研究
麻冬梅,秦楚
(1.宁夏大学 西北土地退化与生态恢复国家重点实验室培育基地,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
土壤盐渍化是人类面临的世界性问题,全球约100多个国家存在着不同类型的盐碱地,占陆地面积的10%左右[1],它不仅限制全球农业生产[2],还威胁生态环境、制约可持续发展。在我国,盐碱土地主要分布于华北、东北、西北内陆和滨海地区[3]。由于盐碱土中含有大量可溶性的盐离子(特别是大量的可交换性钠),从而抑制了植物的正常生长,同时由于自然和人为因素的影响,盐碱地面积仍在不断增加。因此,对盐碱土地的改良与应用具有重大的意义[4]。到目前为止,治理盐碱地主要有物理改良、化学改良和生物改良,其中物理和化学方法改良土壤不仅耗资巨大,还有可能会造成土壤次生盐碱化问题[5],而通过种植耐盐碱植物的生物改良不仅耗资少,而且效果显著[6]。因此,利用转基因技术培育耐盐转基因植物新品种成为利用盐碱地的重要途径之一。
对于多数植物,高盐度和水分亏缺严重会增加植物细胞的渗透,使细胞积累过多的活性氧以及加重损伤叶片的细胞膜脂[7],从而影响植物的生长、质量和产量。紫花苜蓿(Medicagosativa)是一种多年生的豆科牧草,主要用于牧草、干草、青贮饲料和青割[8]。它不仅在蛋白质、矿物质与维生素水平上有突出的营养价值,其自身还有固氮能力。此外,紫花苜蓿的根比大多数作物要深,这种深厚的根系能使苜蓿适应各种环境条件,从而提高其抗侵蚀能力[9]。因此,苜蓿因其多功能、高产、饲料价值高等特点,在土壤改良和土壤保护等方面具有广泛的应用前景[10]。然而环境的挑战,特别是土壤盐碱度的影响,不仅严重制约了紫花苜蓿的产量,而且还影响其根瘤的形成和共生固氮的能力[11],使紫花苜蓿产业受到了严重的威胁,因而培育耐盐碱的紫花苜蓿新品种成了研究的重点。但是传统的育种方法不仅程序繁杂而且生长周期漫长,性状难以综合,再加上紫花苜蓿异花授粉的限制,以及存在自交衰退等问题,给培育新品种带来更大的挑战。随着分子生物学和基因工程技术的发展,应用转基因技术手段为培育苜蓿新品种开辟了新途径,有效利用耐盐新品种植物进行盐碱地改良,不仅可以加快改良进程,还可以提高农业的发展,目前已开展了大量的耐盐转基因苜蓿的研究工作[12-14]。
享有“牧草之王”美称的苜蓿,不仅种植广泛、产量高、品质好,而且根系比较发达,有一定的固氮能力,因此,对土壤有一定的改良作用。阿尔冈金品种是由加拿大引进的,具有丰产、抗旱、抗寒等特点,但其耐盐性较差[15]。本研究以紫花苜蓿阿尔冈金的子叶节为受体,利用农杆菌转化法,将拟南芥(Arabidopsisthaliana)来源的基因SOS1+SOS2+SOS3导入紫花苜蓿,以期获得能够稳定表达的耐盐性植株,并对转基因植株进行了相关农艺性状和生理生化指标的检测,为进一步选育耐盐新品种创建种质资源。
1 材料与方法
1.1 材料
试验于2015年9月开始,2017年1月结束,通过分子检测共获得转基因植株12株,在进行抗性筛选前,已将实验材料通过扦插的方式保存。
1.1.1种子 材料为阿尔冈金紫花苜蓿,种子由甘肃农业大学曹致中老师馈赠。
1.1.2载体 转化的基因为AtSOS1、AtSOS2、AtSOS3,均是与植物耐盐相关的基因。载体由山东大学夏光敏实验室构建。
含有AtSOS1+AtSOS2+AtSOS3基因的表达载体pCAMBIA33O1-AtSOS1-AtSOS2-AtSOS3的结构如下:

图1 AtSOS1+2+3载体结构图Fig.1 The vector of AtSOS1+2+3
SOS1基因(3489 bp)、SOS2基因(1341 bp)、SOS3基因(669 bp)分别受启动子P35s调控。载体中还包含一个Bar(552 bp)筛选基因。
PCR引物见表1。RT-PCR引物见表2。
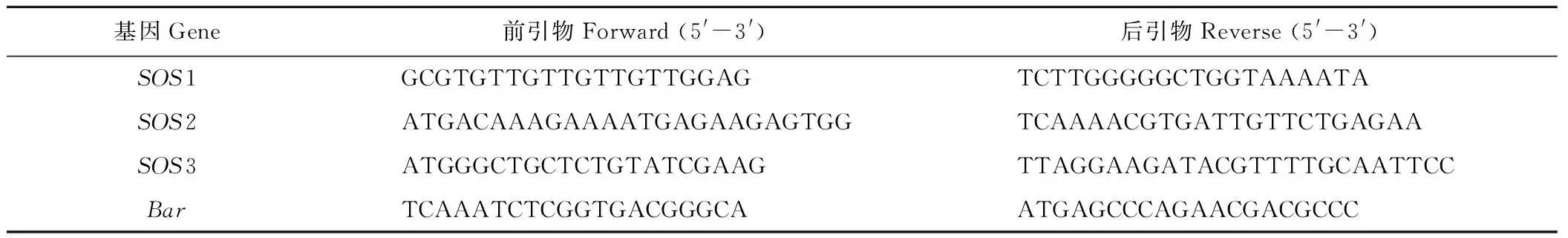
表1 AtSOS和Bar基因的PCR引物Table 1 The PCR primers of AtSOS and Bar genes
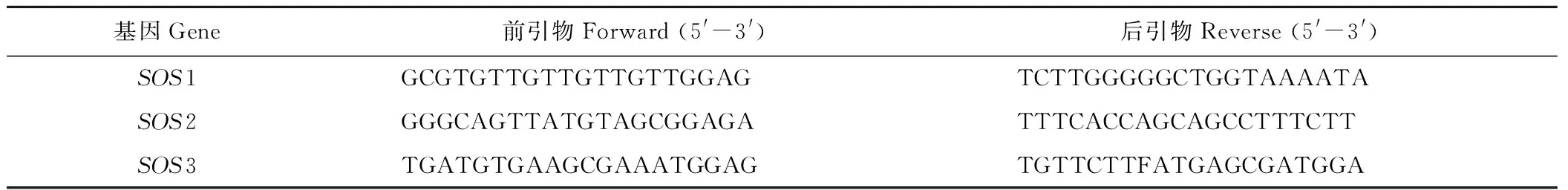
表2 AtSOS基因的RT-PCR引物Table 2 The RT-PCR primers of AtSOS genes
1.1.3培养基 接种培养基(M1)是1/2 MS;筛选培养基(M2)为MS培养基加入500 mg·L-1水解罗蛋白、5 mg·L-1PPT(草甘膦)和500 mg·L-1头孢;分化培养基(M3)为MS培养基加入1 mg·L-16-BA(6-苄基氨基嘌呤)、300 mg·L-1PPT和300 mg·L-1头孢;生根培养基(M4)为1/2 MS加入1 mg·L-1IBA(吲哚丁酸)、100 mg·L-1Glufosinate (草甘膦)和100 mg·L-1头孢。
1.2 方法
1.2.1紫花苜蓿的遗传转化 自来水冲洗紫花苜蓿种子5次后放于超净工作台中,先用75%的乙醇消毒30 s,无菌水冲洗3次,再用0.1%的HgCl2消毒8 min,无菌水冲洗5次。将处理后的种子接种于M1培养基上,25 ℃,3000 lx,12 h/12 h光照培养。将培养7 d的无菌苗,掐掉一片子叶和胚芽即子叶节,浸入农杆菌悬浮液中,轻摇15 min。侵染后的子叶节转移到含有3张无菌滤纸的培养皿中,暗培养3 d。共培养后,将被侵染的子叶节接到M2培养基中,暗培养15 d。筛选出抗PPT的子叶节,转移到M3培养基上,光照培养,直到长成小苗,转接于M4培养基中。在恒温气候室,将生根紫花苜蓿转移到土壤(营养土∶黄土∶蛭石=2∶3∶1)中生长。
1.2.2转基因植株的分子鉴定 PCR检测:提取未转基因和转基因紫花苜蓿叶片的 DNA,并以 DNA 为模板对其进行PCR扩增。分别以重组质粒和未转基因植株的DNA为阳性和阴性对照,取5 μL产物在1%琼脂糖凝胶上电泳。
PCR反应程序:
AtSOS1基因PCR反应程序为94 ℃预变性4 min;94 ℃变性30 s;56.4 ℃退火30 s;72 ℃延伸60 s,循环25圈;72 ℃延伸5 min,4 ℃保存;
AtSOS2基因PCR反应程序为94 ℃预变性4 min;94 ℃变性30 s;57.3 ℃退火30 s;72 ℃延伸90 s,循环35圈;72 ℃延伸10 min,4 ℃保存;
AtSOS3基因PCR反应程序为94 ℃预变性4 min;94 ℃变性30 s;57.6 ℃退火30 s;72 ℃延伸60 s,循环30圈;72 ℃延伸8 min,4 ℃保存;
Bar基因的PCR反应程序为94 ℃预变性4 min;94 ℃变性30 s;65.7 ℃退火30 s;72 ℃延伸60 s,循环30圈;72 ℃延伸8 min,4 ℃保存。
抗除草剂检测:选取转基因植株和野生型植株,每株植株分别选出3片长势良好、绿色健康的叶片,用手术刀在叶片表层轻轻划破2道后,用毛笔涂抹500 mg·L-1的Glufosinate,3 d后观察植株叶片表型。
RT-PCR检测:采用北京华越洋公司的植物RNA提取试剂盒3.0提取转基因与野生型植株的总RNA后,利用Takara反转录试剂盒RR06A(美国,Takara),获得cDNA,继而以cDNA为模板,进行AtSOS1、AtSOS2、AtSOS3基因的逆转录PCR(RT-PCR)。
1.2.3盐胁迫处理及耐盐性检测 在人工气候室中,选择转基因和野生型植株各9盆,共设置100、200和300 mmol·L-13种浓度梯度NaCl水溶液,每个浓度梯度处理转基因和野生型植株各3盆,共处理6 d,每天分别浇100 mL的NaCl水溶液。
盐处理期间,每隔1 d测定各处理下转基因和野生型植株的株高,记录数据。
相对株高生长率=(处理植株的株高-未处理前的株高)/未处理前的株高×100%
采用SPAD仪器每隔1 d测定各处理下转基因和野生型植株叶片的叶绿素含量,每株随机选取3片叶子,将叶片做好标记,每次测量同一叶片的叶绿素含量,记录数据。
收集处理前(0 d)和处理后(6 d)的植株叶片保存于-80 ℃冰箱中,在同一天按植物生理实验指导书进行超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、丙二醛(malondialdehyde, MDA)、脯氨酸(praline, Pro)、可溶性糖、细胞膜透性和Na+、K+离子含量的测定[16]。
2 结果与分析
2.1 分子鉴定
2.1.1再生植株的获得 以阿尔冈金的子叶节为实验材料,进行农杆菌介导的遗传转化。侵染后将农杆菌与子叶节共培养3 d(图2a)。然后,子叶节在含有5 mg·L-1的Glufosinate培养基上筛选培养15 d(图2b)。抗性子叶节在节点处长出新芽,而非转基因子叶节的胚轴处逐渐褐化,节点处也不生出新芽。将抗性子叶节接入分化培养基上(图2c),在节点处继续生出新芽,待新芽长至一定高度,转移到瓶中继续培养(图2d)。待小苗长至4 cm左右时,将小苗转移至生根培养基中,1个月后,抗性植株长出大量根系(图2e)。随后,将抗性植株转移至土壤中,放入人工气候室生长(图2f)。
2.1.2PCR检测 为了验证目的基因是否整合到阿尔冈金的基因组中,提取农杆菌质粒、转基因和野生型植株叶片的基因组DNA,以DNA为模板,设计引物进行PCR扩增,依次扩增出SOS1、SOS2、SOS3和Bar基因序列(图3a,b,c,d)。以农杆菌质粒为阳性对照,野生型植株为阴性对照,通过检测获得12株抗性植株。
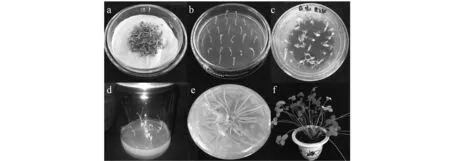
图2 紫花苜蓿的遗传转化Fig.2 Transformation of alfalfa a:共培养;b:筛选;c、d:分化培养;e:生根;f:再生植株。a:Cocultivation;b:Screening;c, d:Differentiation;e:Rooting;f:Plant regeneration.
2.1.3转基因和野生型植株的抗除草剂鉴定 经高浓度除草剂处理后,野生型植株抵抗除草剂能力较弱,3 d后,其叶片发黄、萎蔫;而转基因植株的叶片仍保持绿色(图4)。
2.1.4RT-PCR分析 通过提取转基因和野生型植株叶片的RNA,继而进行RT-PCR检测,确定了SOS1、SOS2和SOS3基因在RNA水平上的表达(图5)。
2.2 耐盐性检测
2.2.1盐胁迫下野生型和转基因紫花苜蓿的表型变化 用3种不同浓度的NaCl溶液(100,200和300 mmol·L-1)处理转基因和野生型紫花苜蓿植株,每个处理重复3次,分析两者的耐盐性。在盐胁迫下,转基因和野生型紫花苜蓿的生理状态均下降,植株随着盐浓度的增加生长逐渐减慢。6 d后,转基因和野生型植株之间有明显的表型差异。在100 mmol·L-1的NaCl溶液处理下,转基因和野生型植株生长差异并不明显,叶片均略微变黄。而在200 mmol·L-1的NaCl处理下,野生型植株与转基因植株相比,叶片明显变黄,并且出现萎蔫和枯萎迹象(图6a, b)。在300 mmol·L-1的NaCl处理下,转基因和野生型植株均逐渐枯死。
2.2.2盐胁迫下野生型和转基因紫花苜蓿的相对株高增长率变化 不同盐浓度处理下,所有植株的株高均有所增长。由图7可知,6 d后,所有植株株高的相对增长率均可达到10%以上。在100和200 mmol·L-1的NaCl溶液处理下,转基因植株的生长趋势显著,其相对增长率均高于相同时间处理时的野生型植株,6 d时,可分别高出9%和7%。而在300 mmol·L-1的NaCl溶液处理下,转基因植株与野生型植株株高的变化差异并不明显。
2.2.3盐胁迫下转基因和野生型紫花苜蓿叶绿素含量的变化 叶绿素是一类与植物光合作用有关的重要色素,其含量的多少反映了植物光合能力的强弱。由图8可知,处理前,转基因植株叶片的叶绿素含量均高于野生型植株。在NaCl胁迫2 d后,所有植株的叶绿素含量均呈上升趋势。胁迫4和6 d时,除100 mmol·L-1的NaCl溶液处理的转基因植株叶片的叶绿素含量仍增加外,其他不同胁迫各处理的叶绿素含量均大幅度下降。

图4 除草剂处理前后转基因和野生型植株表型的变化Fig.4 The changes in the phenotype of transgenic and wild-type strains under herbicide treatment a:除草剂处理前;b:除草剂处理后。WT:野生型植株;T:转基因植株。a:Before herbicide treatment;b:After herbicide treatment.WT:Wild type plant;T:Transgenic plants.下同。The same below.
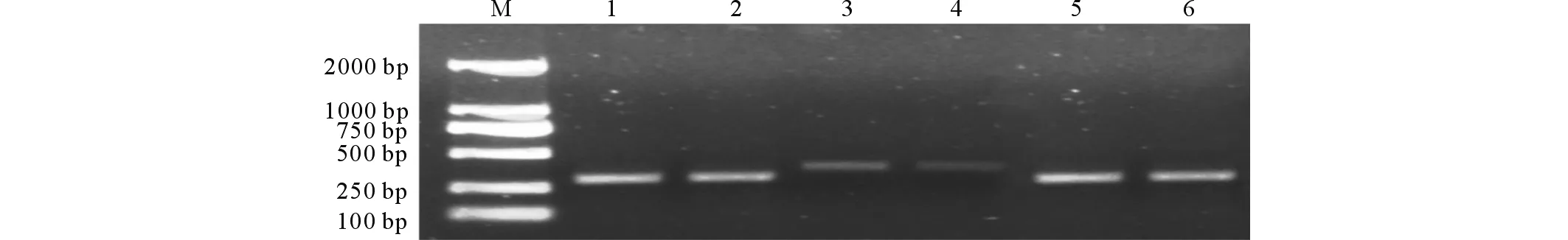
图5 RT-PCR分析结果Fig.5 The analysis of alfalfa by RT-PCT M:marker 2000;1, 2:SOS1基因的RT-PCR结果;3, 4:SOS2基因的RT-PCR结果;5, 6:SOS3基因的RT-PCR结果。M:marker 2000;1, 2:The RT-PCR of SOS1;3, 4:The RT-PCR of SOS2;5, 6:The RT-PCR of SOS3.

图6 不同盐浓度处理转基因和野生型植株6 d后的实验结果Fig.6 The experimental results of transgenic and wild type plants by dealing with different salt concentration after 6 days a:处理前转基因和野生型植株的生长情况;b:处理后转基因和野生型植株的生长情况。a:The growth of transgenic and wild plants before handling;b:The growth of transgenic and wild plants after 6 days.
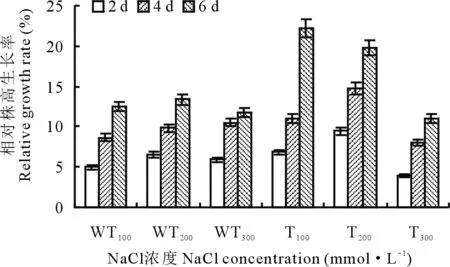
图7 盐胁迫下转基因和野生型植株的株高增长率变化Fig.7 The growth rate of plant height in transgenic and wild-type strains under salt stress

图8 盐胁迫下转基因和野生型植株叶绿素含量的变化Fig.8 The changes of cholorophyll content in transgenic and wild-type strains under salt stress
2.2.4盐胁迫下转基因和野生型紫花苜蓿叶片的细胞膜透性变化 植物的细胞膜对维持细胞的内环境以及保证细胞的生长代谢起着重要的作用。在正常的生长环境下,细胞膜具有选择通透性。当植物受到盐胁迫影响时,细胞膜遭到破坏,导致膜透性增大,从而使细胞内电解质外渗,植物叶片浸提液的电导率增大。细胞膜透性越大表示细胞受伤害越严重,通过测量细胞膜透性的变化,来判断植物的受损伤程度。由图9可以看出,即使在正常条件下,转基因植株叶片的细胞膜透性就显著低于野生型植株,均比野生型植株低10%以上,证明转基因植株的抗逆性更强。在NaCl处理下,转基因和野生型植株叶片的细胞膜透性均有所上升,在100和200 mmol·L-1的NaCl溶液处理下,野生型植株的变化与转基因相比更为明显,与未处理前相比,野生型植株的细胞膜透性提高了10%左右,而转基因植株提高不到5%。在300 mmol·L-1的NaCl溶液处理下,转基因植株与野生型植株的细胞膜透性变化差异并不明显,均增加了13%。
2.2.5盐胁迫下转基因和野生型紫花苜蓿中SOD活性的变化 植物在受到环境胁迫时,其抗氧化酶系统易被影响,当植物细胞受到盐胁迫产生离子毒性时,细胞中的活性氧会大量积累,造成氧化损伤,继而影响植物的生长发育。SOD是重要的抗氧化保护酶,其活性可以反映植物对环境胁迫的耐受程度。在NaCl处理下,转基因和野生型植株的SOD活性均有所增加,其中转基因植株中的SOD活性的增加幅度低于野生型植株,在100 mmol·L-1的NaCl处理下,野生型植株中SOD的活性增加了66 U·g-1·h-1,而转基因植株仅增加14 U·g-1·h-1。说明野生型植株在盐胁迫下SOD活性增加明显,利于其清除超氧化自由基,从而保护植物细胞膜免受损害,进而说明,该浓度下盐胁迫对转基因植株造成的损伤显著低于野生型植株。
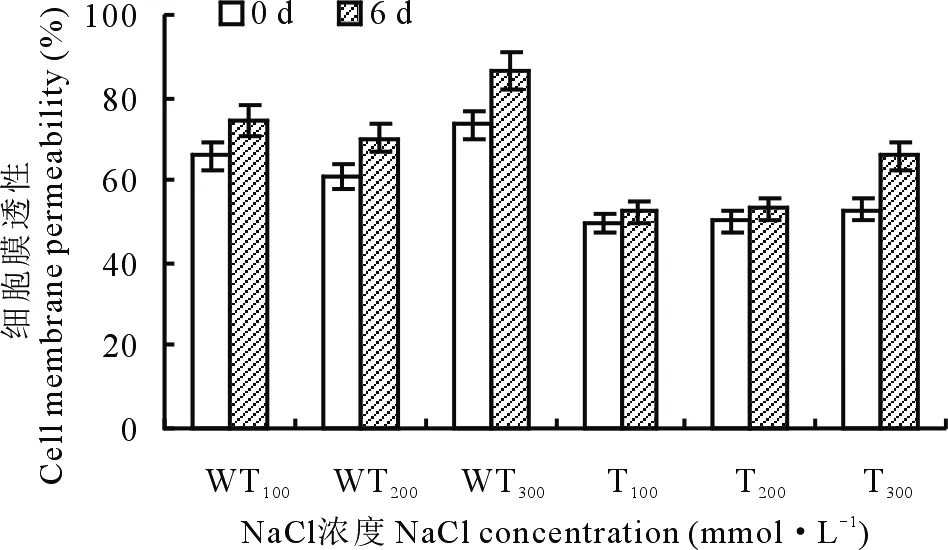
图9 盐胁迫下转基因和野生型植株细胞膜透性的变化Fig.9 The changes of cell membrane permeability in transgenic and wild-type strains under salt stress
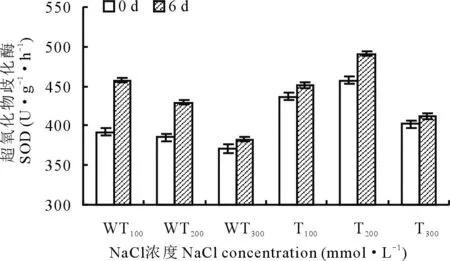
图10 盐胁迫下转基因和野生型植株SOD活性的变化Fig.10 The changes of SOD activity in transgenic and wild-type strains under salt stress
2.2.6盐胁迫下转基因和野生型紫花苜蓿中POD活性的变化 植物细胞中过氧化氢酶的主要作用是清除植物细胞内产生的H2O2。SOD作用时会产生H2O2,因此植物中POD活性的多少可用于评价植物的抗逆性。由图11可以看出,在正常生长条件下,转基因和野生型植株中POD活性差异不大。盐胁迫后,转基因和野生型植株中的POD活性均增加,转基因植株的POD活性增加量分别高出野生型植株2、9和9 U·g-1·min-1。
2.2.7盐胁迫下转基因和野生型紫花苜蓿中CAT活性的变化 由图12可以看出,在正常生长环境下,未处理前,转基因植株中的CAT活性均高于野生型植株。在盐胁迫后,转基因和野生型植株中的CAT活性均有增加,但转基因植株增加更为明显,增加量均高出野生型1倍。进而说明转基因植株清除逆境胁迫后产生的H2O2的能力和反应强度均高于野生型植株。
2.2.8盐胁迫下转基因和野生型紫花苜蓿中MDA含量变化 MDA含量的多少可代表细胞质膜受损伤的程度,由图13可以看出,在正常生长环境下,MDA含量均维持在一定水平。盐胁迫后, MDA含量在转基因和野生型植株中均下降,在100和200 mmol·L-1的NaCl溶液处理时,野生型植株的MDA含量与未处理前相比,下降了一半,说明野生型植株的细胞膜受损伤更为严重。
2.2.9盐胁迫下转基因和野生型紫花苜蓿中Pro含量变化 逆境环境,会导致植物细胞失水过多或吸水困难,此时细胞内可以通过积累大量游离的脯氨酸来提高原生质体的稳定性,以便减少逆境对植物的伤害。由图14可以看出,在正常生长环境下,转基因和野生型植株中的脯氨酸含量都很低,并且差异不大。但盐胁迫后,二者的脯氨酸含量均显著提高,其中在100和200 mmol·L-1的NaCl溶液处理时,野生型植株中脯氨酸的增加量分别是转基因植株的5和2倍。而在300 mmol·L-1的NaCl溶液处理下,转基因植株与野生型植株中脯氨酸含量变化差异并不明显。

图11 盐胁迫下转基因和野生型植株POD活性的变化Fig.11 The changes of POD activity in transgenic and wild-type strains under salt stress
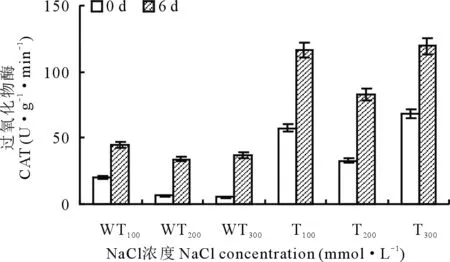
图12 盐胁迫下转基因和野生型植株CAT活性的变化Fig.12 The changes of CAT activity in transgenic and wild-type strains under salt stress

图13 盐胁迫下转基因和野生型植株MDA含量的变化Fig.13 The changes of MDA content in transgenic and wild-type strains under salt stress
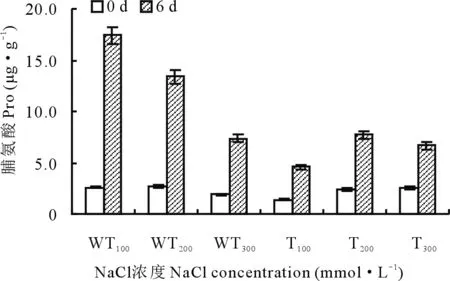
图14 盐胁迫下转基因和野生型植株Pro含量的变化Fig.14 The changes of Pro content in transgenic and wild-type strains under salt stress
2.2.10盐胁迫下转基因和野生型紫花苜蓿中可溶性

图15 盐胁迫下转基因和野生型植株可溶性糖含量的变化Fig.15 The changes of soluble sugar content in transgenic and wild-type strains under salt stress
糖含量变化 植物会因为高盐环境而造成渗透胁迫,此时为抵御盐害,调节渗透势,细胞会积累可溶性小分子有机物如可溶性糖来稳定细胞中的蛋白质结构,提高细胞的渗透压。由图15可以看出,在100和200 mmol·L-1的NaCl溶液处理下,转基因和野生型植株中可溶性糖的含量均增加,并且转基因植株的变化趋势更为明显。在100 mmol·L-1的NaCl溶液处理下,转基因植株叶片内可溶性糖含量高达26 μg·g-1,为野生型植株的3倍。而在300 mmol·L-1的NaCl溶液处理下,野生型植株中可溶性糖含量与未处理前相比降低了3 μg·g-1,可能是高盐环境对野生型植株的细胞膜造成了不可逆转的损害。
2.2.11盐胁迫下转基因和野生型紫花苜蓿根系中Na+和K+含量的变化 由图16可以看出,未用NaCl处理的转基因和野生型植株根系中的Na+含量相似,随着盐处理浓度的增加,被测植株根系中Na+含量均增加,但是野生型植株的增长趋势更为明显。在100和200 mmol·L-1的NaCl溶液处理下,同等盐浓度,野生型植株根系中的Na+含量均明显高于转基因植株,积累了更多的盐(图16a)。
未用NaCl处理时,野生型植株根系中的K+含量明显高于转基因植株。经盐胁迫后,野生型植株根系中的K+含量迅速降低,随后,随着盐处理浓度的增加呈上升趋势。同等浓度盐处理下,转基因植株根系中的K+含量均明显高于野生型植株(图16b)。
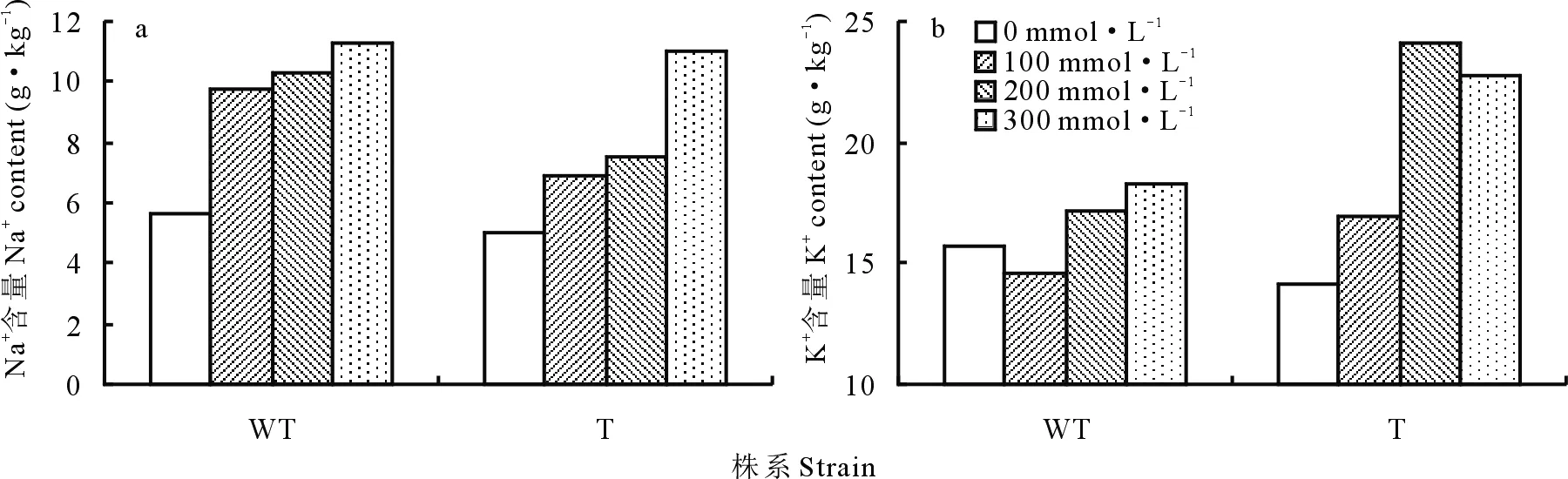
图16 盐胁迫下转基因和野生型植株根系中Na+和K+含量的变化Fig.16 The changes of Na+ and K+ content in the root of transgenic and wild-type strains under salt stress a:Na+含量;b: K+含量。a:The content of Na+;b:The content of K+.
3 讨论
本试验以紫花苜蓿“阿尔冈金”的子叶节为外植体,利用农杆菌介导法,对紫花苜蓿进行遗传转化研究,并且将多基因植物表达载体SOS1+SOS2+SOS3引入紫花苜蓿中,以期提高紫花苜蓿的耐盐性。
转基因植株主要在DNA, RNA和抗除草剂上进行分子检测。在DNA水平上,PCR检测技术最为普遍,具有对植物基因组纯度要求不高,操作简单快捷,成本低、效率高等优点,通常情况下,一般检测出外源基因的部分片段已整合到了植物基因组中时,便可确定该段基因已完全转入植物中。但转入到植物中的基因,可能会发生基因沉默现象[17],或是由于载体过大,导致T-DNA不完全整合[18-20],从而无法表达。可以通过对转基因植株进行RNA水平的检测,来进一步确定外源基因的整合效果。RT-PCR检测对植株RNA的浓度和纯度要求较高,在整个操作过程中,为了防止RNA的污染和降解,对实验技术要求较为严格。
与野生型植株相比,盐害引起的症状,如植物萎蔫、老叶变黄等,在转基因植株中影响较轻,在盐胁迫下,转基因植株的长势显著高于野生型植株。叶绿体是植物进行光合作用的主要场所,盐胁迫会使植物细胞内的叶绿体受损,降低植物光合作用的能力[21]。本研究表明,在100和200 mmol·L-1的NaCl溶液处理下,转基因植株的叶绿素含量高于野生型植株(图8),表明转基因紫花苜蓿的光合能力强于野生型紫花苜蓿。
植物受到盐害时,植物的细胞膜结构遭到破坏,从而导致细胞膜透性增加,膜透性增加越多,说明细胞受损越严重,植物抗逆性越弱[22],盐胁迫后,转基因植物的膜透性明显低于野生型植株(图9),说明转基因植株的抗逆性增强。
在治疗期间,实验组患者有1例患者出现了不良反应,不良反应发生率为2.38%,显著低于对照组的21.43%,组间比较差异具有显著性(P<0.05)。
在盐胁迫时,植物体内会诱导产生过多的活性氧,活性氧的大量积累,造成膜系统的氧化损伤[23]。在本研究中,分别测定了SOD、POD、CAT活性和MDA、Pro、可溶性糖含量的生理生化指标。野生型紫花苜蓿中,为了清除Na+产生的毒害,从而诱导SOD的活性增加,而转基因植株由于耐盐性增强,Na+对其的毒害作用减弱,使其诱导SOD的活性增加程度低于野生型植株(图10);在清除活性氧的过程中,会产生大量H2O2,POD和CAT能够将H2O2还原成H2O,从而调节植物体内的H2O2水平,与野生型植株相比,转基因植株中的POD和CAT活性有所增加(图11,12),说明其抗氧化能力增强。MDA是脂质过氧化的产物,其含量可代表细胞膜受损伤程度[24],盐胁迫下,转基因和野生型植株中的MDA含量均下降,且野生型植株中下降得更为明显(图13),说明其受到的损伤更大。由于氨基酸的积累与植物的耐盐性呈负相关[25],即脯氨酸含量积累越多,其耐盐性越差,因而转基因植株中的Pro含量明显低于野生型植株(图14)。除此之外,可溶性糖作为植物体内的渗透调节物质,可以维持细胞膨胀,抑制细胞的被动脱水,当盐胁迫造成细胞脱水时,转基因植物中的可溶性糖含量明显高于野生型植株(图15),为其抵抗盐害提供支撑。
此外,通过研究植物根系中的离子含量,进一步探究其耐盐性。盐处理下,转基因植株的根系中Na+的积累比野生型植株少,而K+的吸收多于野生型植株(图16),这是因为转基因植株中的SOS1编码的Na+/H+逆转运体可以有效地将Na+排出胞外,保护K+通道,促进K+内流[26-27]。SOS1活性受SOS3-SOS2复合体调控,促进Na+外排,减轻了离子毒性,从而提高了植株的耐盐性。
由于转基因植株T0代性状还不稳定,还需通过收集转基因植株杂交后的种子进行T1和T2代的耐盐性鉴定。
4 结论
本研究利用农杆菌介导法对紫花苜蓿进行AtSOS途径的多基因表达载体的遗传转化,结果表明,在100和200 mmol·L-1的NaCl溶液处理下,与野生型植株相比,转基因植株的农艺性状和生理生化指标变化明显,说明转基因紫花苜蓿可以在200 mmol·L-1(11.7‰) NaCl的盐环境下生存。而在300 mmol·L-1的NaCl溶液处理时,二者耐盐指标变化的差异不大。
参考文献References:
[1] Allakhverdiev S I, Sakamoto A, Nishiyama Y,etal. Ionic and osmotic effects of NaCl-induced inactivation of photosystems I and II in synechococcus sp. Plant Physiology, 2000, 123(3): 1047-1056
[3] Wang Z Q. Chinese salty soil. Beijing: Science Press, 1993.
王遵亲. 中国盐渍土. 北京: 科学出版社, 1993.
[4] Zhao X, Han J C, Wang H Y,etal. Research progress of saline soil improvement technology. Chinese agronomy bulletin, 2016, (8): 113-116.
赵宣, 韩霁昌, 王欢元, 等. 盐渍土改良技术研究进展. 中国农学通报, 2016, (8): 113-116.
[5] Yan H, Zhao W, Yin S J,etal. The physiological responses ofLeymuschinensisto different saline alkali stresses. Acta Prataculturae Sinica, 2006, (6): 49-55.
颜宏, 赵伟, 尹尚军, 等. 羊草对不同盐碱胁迫的生理响应. 草业学报, 2006, (6): 49-55.
[6] Xu Z Q, Jia J F, Hu Z D. Agrobacterium strain A-4 transformed alfalfa suspension cultures. Journal of Biomedical Engineering, 1997, (1): 55-59.
徐子勤, 贾敬芬, 胡之德. 发根农杆菌A-4菌株转化苜蓿悬浮培养物. 生物工程学报, 1997, (1): 55-59.
[7] Cords H P. Weeds and alfalfa hay quality. Weed Science, 1973, 21(5): 400-401.
[8] Chang S, Nan L, Wang X,etal. Alfalfa carbon and nitrogen sequestration patterns and effects of temperature and precipitation in three agro-pastoral ecotones of northern China. Plos One, 2012, 7(11): e50544.
[9] Zhi W, Ke Q, Kim M D,etal. Transgenic alfalfa plants expressing the sweetpotato orange gene exhibit enhanced abiotic stress tolerance. Plos One, 2015, 10(5): e0126050.
[10] Bagavathiannan M V, Begg G S, Gulden R H,etal. Modelling the dynamics of feral alfalfa populations and its management implications. Plos One, 2012, 7(6): e39440.
[11] Postnikova O A, Shao J, Nemchinov L G. Analysis of the alfalfa root transcriptome in response to salinity stress. Plant & Cell Physiology, 2013, 54(7): 1041.
[12] Xu B. Study cloning and functional analysis ofP5CSgene inPuccinelliachinampoensisand alfalfa transformation. Beijing: Chinese Academy of Agricultural Sciences, 2012.
徐博. 朝鲜碱茅P5CS基因的克隆及其转化紫花苜蓿的研究. 北京: 中国农业科学院, 2012
[13] Liu Y, Cai H, Liu J,etal. Transformation ofGsCRCKgene into Nong Jing No.1 alfalfa and its salt tolerance analysis. Acta Prataculturae Sinica, 2013, (2): 150-157.
刘莹, 才华, 刘晶, 等.GsCRCK基因转化农菁1号苜蓿及其耐盐性分析. 草业学报, 2013, (2): 150-157.
[14] Jin T C, Meng D W, Wang Y,etal. UsingAH1 gene transformation to improve the salt tolerance of alfalfa. Molecular Plant Breeding, 2016, (7): 1724-1729.
金太成, 孟大伟, 王悦, 等. 利用AH1基因的遗传转化改良紫花苜蓿耐盐性. 分子植物育种, 2016, (7): 1724-1729.
[15] Zhang L Q. Using transgenic technology to create new germplasm of alfalfa salt tolerance. Hohhot: Inner Mongolia University, 2011.
张立全. 利用转基因技术创建紫花苜蓿耐盐新种质的研究. 呼和浩特: 内蒙古大学, 2011.
[16] Zhang Z L, Qu W J. Experimental instruction of plant physiology. Beijing: Higher Education Press, 2003.
张志良, 瞿伟菁. 植物生理学实验指导. 北京: 高等教育出版社, 2003.
[17] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA. Nucleic Acids Research, 1980, 8(19): 4321-4325.
[18] Xin Z, Browse J. Eskimo1 mutants ofArabidopsisare constitutively freezing-tolerant. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(95): 7799-7804.
[19] Emani C, Sunilkumar G, Rathore K S. Transgene silencing and reactivation in sorghum. Plant Science, 2002, 162(2): 181-192.
[20] Wu G, Xia Y W. Plant transgene silencing and its countermeasure. Biotechnology, 2000, 10(2): 27-32.
吴刚, 夏英武. 植物转基因沉默及对策. 生物技术, 2000, 10(2): 27-32.
[21] Mao X H. Genetic engineering improvement of salt tolerance inMedicagosativaL. Ji’nan: Shandong University, 2009.
毛秀红. 苜蓿耐盐的基因工程改良研究. 济南: 山东大学, 2009.
[22] Wei Z W, Wang H S. Cold acclimation and cold hardiness property of various types of turfgrasses. Pratacultural Science, 1997, 15(2): 62-66.
魏臻武, 王槐三. 两种草坪草抗寒特性及其超氧化物酶的作用. 草业科学, 1997, 15(2): 62-66.
[23] Jiang M, Zhang J. Effect of abscisic acid on active oxygen species, antioxidative defence system and oxidative damage in leaves of maize seedlings. Plant & Cell Physiology, 2001, 42(11): 1265-1273.
[24] Liu Z L, Zhu Y L, Hu C M,etal. The effect of NaCl stress on the growth, antioxidant enzyme activity and active oxygen metabolism of grafted eggplant. Acta Ecology, 2007, (3): 537-541.
刘正鲁, 朱月林, 胡春梅, 等. 氯化钠胁迫对嫁接茄子生长、抗氧化酶活性和活性氧代谢的影响. 应用生态学报, 2007, (3): 537-541.
[25] Wang X Q, Zhang J W, Wei J H,etal. Preliminary study on physiological mechanism of salt tolerance in barley under salt stress. Acta Agronomica Sinica, 2007, 22(1): 17-21.
王雪青, 张俊文, 魏建华, 等. 盐胁迫下野大麦耐盐生理机制初探. 华北农学报, 2007, 22(1): 17-21.
[26] Zhu J K, Liu J, Xiong L. Genetic analysis of salt tolerance inArabidopsis: Evidence for a critical role of potassium nutrition. Plant Cell, 1998, 10(7): 1181.
[27] Qi Z, Spalding E P. Protection of plasma membrane K+transport by the salt overly sensitive1 Na+-H+antiporter during salinity stress. Plant Physiology, 2004, 136(1): 2548-2555.

