弱电解质的电离 教学设计
北京市第六十六中学 祝 晶
教学目标:
知识与技能:
(1)了解弱电解质在水中的电离情况,能描述电离平衡。
(2)知道电离平衡是一种双向、动态的平衡状态。
(3)知道影响电离平衡移动的因素。
过程与方法:
(1)能运用平衡移动的观点分析弱电解质的电离平衡。
(2)初步建立水溶液中的离子平衡的思维分析模式。
(3)利用对比的方法,提高学生的迁移能力和逻辑推理能力。
情感态度价值观:
(1)通过电离平衡的分析过程,形成辩证思维的方法,发展学生的思维深度。
(2)感受物质之间的相互联系,渗透动态观、微粒观、定量观等化学基本观念。
(3)通过讨论、交流、分享和实验,感受到合作学习的乐趣。
教学重、难点
重点:弱电解质电离平衡及影响因素。
难点:理解弱电解质的电离平衡是双向互变、动态的过程。
教学过程:
一、温故知新——引入环节
[介绍]盐酸与醋酸如同一对“兄弟”,被人们广泛应用在生活、生产中。盐酸可以除水垢、除锈,而醋酸可以用于调味、制药。
[提问]二者都有酸性,酸性是否一样呢?我们如何来验证呢?
[思考、回答]用PH试纸测相同浓度的盐酸和乙酸溶液的PH。
[实验]测0.1mol/L 盐酸和0.1mol/L 乙酸溶液的PH。
[实验]按照学案进行实验、观察、记录、分析。
[讲解]我们分享实验结果。
新课讲解
任务一:分析电解质的电离过程
[过渡]根据公式,可以把PH换算成C(H+),0.1mol/L盐酸中C(H+)为0.1mol/L,0.1mol/L乙酸中C(H+)为0.001mol/L。
[提问]为什么相同浓度的盐酸与乙酸,C(H+)差异如此之大呢?
[思考、回答]0.1mol/L盐酸中存在0.1mol/L H+和0.1mol/LCl-,0.1mol/L乙酸中存在0.001mol/L H+、0.1mol/L CH3COO-和CH3COOH。
[讲解]物质的组成决定性质,下面分析盐酸和乙酸溶液的组成。溶液是由溶质和溶剂组成的,二者溶剂是相同的,溶质不同。接下来分析盐酸和乙酸溶液中溶质的微粒存在形式。
[提问]根据溶质微粒组成的分析,盐酸和乙酸的电离有何不同?
[思考、回答]HCl在水中全部电离,CH3COOH在水中部分电离。
[小结]由此可见,相同浓度的盐酸和乙酸的酸性不同的原因是二者的电离程度不同造成的。
任务二:建立弱电解质的电离平衡
[提问]你对乙酸在水溶液中部分电离的“部分”是如何理解的?
[思考、回答]1.一部分电离,一部分不电离。2.乙酸电离的同时CH3COO-和H+可能结合成分子。
[提问]CH3COOH的电离是静态的,还是动态的呢?那么,已经电离产生的CH3COO-和H+是否可能重新结合成CH3COOH分子呢?有没有什么办法可以证明这一点呢?用什么试剂呢?
[思考、回答]实验验证,
用酸和乙酸盐进行反应测PH。
[实验]向0.1mol/L 盐酸溶液中加入乙酸铵固体,测混合溶液的PH。
[实验]按照学案进行实验、观察、记录、分析。
[提问]根据实验结果得出什么结论?
[思考、回答]PH增大,C(H+)
减小,说明CH3COO-可以与H+结合生成CH3COOH。
[讲解]由这个实验,我们对乙酸的电离有了更深一层的认识。在水溶液中,乙酸可以电离出CH3COO-和H+,CH3COO-和H+相互碰撞又结合成分子,可见该过程是可逆的、动态的。
[板书]

[讲解]科学家阿累尼乌斯早在十九世纪就发现了这个理论,这个就是我们今天要研究的弱电解质的电离平衡。
[提问]请根据前面的分析和化学平衡知识,给电离平衡下一个定义。
[板书]电离平衡的定义。
[思考、回答]在一定条件下,弱电解质分子电离成离子的速率与其离子重新结合成分子的速率相等,溶液中弱电解质的分子和离子的浓度保持不变。
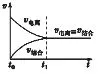
[问题]把冰醋酸加入到水中,分子电离成离子的速率和离子结合成分子的速率如何变化?能不能用v—t图象来描述一下?
[提问]根据化学平衡的特征,请你分析弱电解质电离平衡的特征?
[思考、回答]逆、等、动、定、变。
任务三:探究电离平衡的影响因素
[提问]根据弱电解质电离平衡的特征我们知道,电离平衡可以发生移动,弱电解质的电离平衡受哪些因素会影响呢?
[提问]请根据化学平衡的相关知识,采用哪些方法可以改变乙酸的电离程度?
[思考、回答]主要原因:弱电解质自身的性质,外界因素:浓度、温度。
[讲解]请大家分享自己的方法。
[思考、分析]先自己填写学案,后互相讨论、补充。
[提问]我们用什么方法来证明乙酸的电离程度改变了?
[思考、分享]实验验证
[实验]向0.1mol/L 乙酸溶液中加入乙酸铵固体,测溶液的PH。
[实验]按照学案进行实验、观察、记录、分析。
[提问]向盐酸和乙酸溶液中分别加入乙酸铵固体,均使PH增大,请你利用所学知识加以解释。
二、归纳总结
[总结]

[设置意图]通过总结,使学生思路清晰,学会分析水溶液中离子平衡的方法和思维模式。
三、实践应用
[学以致用]氨水在生活中应用广泛,可以做洗涤剂、皮肤刺激药、消毒药等。设计多种实验方案,证明NH3·H2O是弱碱。
[知识拓展]将0.06 mol/L HCl溶液与0.1 mol/L CH3COONa溶液等体积混合,充分反应。根据混合后溶液中微粒的数目填写:

