脂蛋白相关磷脂酶A2与糖尿病病人颈动脉不稳定斑块的相关性
(北京大学人民医院检验科,北京 100044)
动脉粥样硬化(AS)是一种全球性高发性疾病,已成为全世界重要的致死病因,其主要发生在大中动脉,能引起冠心病和脑卒中。因而,控制AS的发生发展具有重要意义[1]。研究显示,在AS分期的不同阶段,脂质因素及同型半胱氨酸、炎症因素、止血因素依次发挥重要作用[2]。AS早期主要涉及低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、载脂蛋白A、载脂蛋白B等脂质因素以及同型半胱氨酸[3];AS中、后期(稳定斑块期与不稳定斑块期)主要是由脂蛋白相关磷脂酶A2(Lp-PLA2)、C反应蛋白、白细胞介素-6、纤维蛋白原、细胞黏附分子-1、肿瘤坏死因子等炎症因素参与[4]。AS斑块破裂导致心血管事件发生的过程主要是血管性血友病因素及D-二聚体等止血因素发挥作用[5-7]。当前大量研究显示,AS不单纯是脂质性疾病,更是一种炎症相关性疾病[8-9],炎症反应涉及AS进展的各个阶段。有研究显示,Lp-PLA2水平不仅与粥样斑块的形成有关,而且能够反映粥样斑块病变的严重程度及其稳定性[10-12]。本实验通过研究Lp-PLA2活性与糖尿病病人颈动脉斑块的相关性,从而探讨Lp-PLA2可否成为判断不稳定斑块的炎性标志物。
1 对象与方法
1.1 研究对象
收集2014年1月—2016年6月在北京大学人民医院住院的2型糖尿病病人203例,均符合1997年ADA 2型糖尿病诊断标准。排除标准:①其他类型糖尿病、继发性糖尿病及近期发生过糖尿病急性并发症的病人;②严重肝、肾功能不全者;③心力衰竭及风湿瓣膜性心脏病病人;④感染性疾病及肿瘤病人;⑤免疫性及血液性疾病病人;⑥近期使用消炎镇痛药物等。根据斑块性质将病人分为稳定斑块组104例(A组)与不稳定斑块组99例(B组)两组。
1.2 研究方法
两组病人入院后空腹采集外周静脉血3 mL,以离心半径15 cm转速3 000 r/min离心10 min,分离血清,采用日本日立008及配套试剂盒测定血生化相关指标,包括胆固醇(CHO)、HDL、LDL、空腹血糖(GLU)、糖化血红蛋白(HbA1c)。采用贝克曼AU5800全自动生化分析仪检测Lp-PLA2的活性(德国DiaSys公司)。
1.3 统计学处理
采用SPSS 22.0软件进行统计分析。计量资料以中位数(四分位数间距)表示,两组比较采用非参数检验;二分类变量选用Logistic回归分析;采用ROC曲线分析其cutoff值,以P<0.05为差异有显著性。
2 结 果
2.1 两组基本特征比较
B组病人年龄高于A组,差异具有显著性(Z=-1.987,P<0.05);A组的糖尿病病史长于B组,差异有显著性(Z=-2.006,P<0.05);两组其他指标比较,差异无显著性(P>0.05)。见表1。
2.2 两组Lp-PLA2活性水平比较
A组病人血清Lp-PLA2的活性水平为297.63(152.00)U/L,B组为366.50(218.00)U/L,两组比较差异有显著统计学意义(Z=-2.584,P<0.05)。即Lp-PLA2活性水平在不稳定斑块中显著升高,可能是不稳定斑块的危险因素。
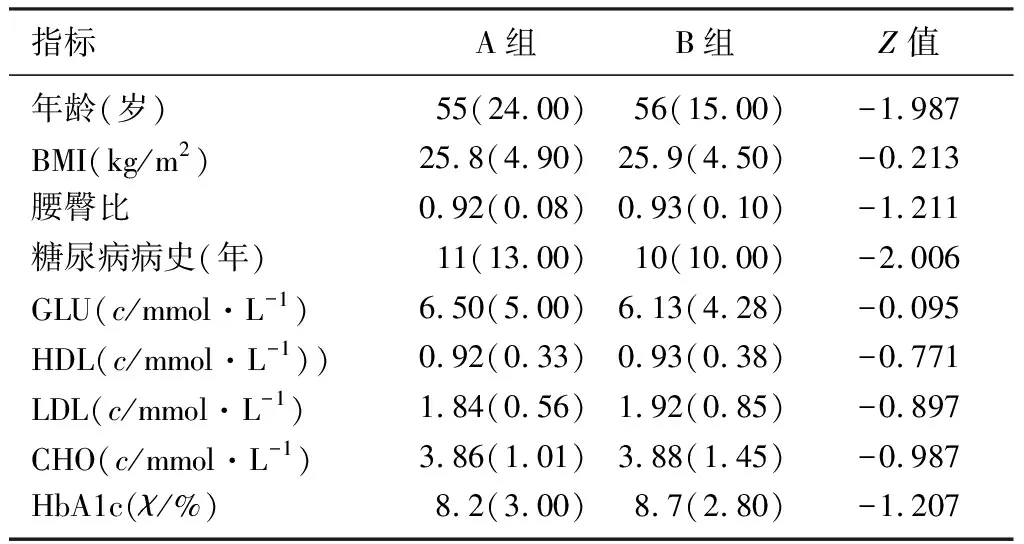
表1 研究对象的基本特征(M(IQR))
2.3 Lp-PLA2活性水平与不稳定斑块的相关性
将Lp-PLA2的活性水平按其四分位数分为不同的组(Q1、Q2、Q3、Q4),用二分类Logistic回归分析评估具有不同Lp-PLA2活性的糖尿病病人不稳定斑块的危险性。表2给出的是较高的3个四分位数与最低的四分位数相比,不稳定斑块组的OR值以及95%CI。无论是校准糖尿病病人的基本信息(年龄、糖尿病病史、腰臀比、BMI),还是校准传统影响因素(CHO、HDL、HbA1c、GLU),甚至校准与Lp-PLA2活性水平密切相关的LDL因素以后,与Lp-PLA2最低四分位数(<237 U/L)相比,Lp-PLA2最高四分位数(>402 U/L)不稳定斑块组的OR值为4.56(95%CI=1.30~15.98,P<0.05),即Lp-PLA2是糖尿病病人颈动脉不稳定斑块的独立危险因素,与其校准的其他影响因素关系不大。
2.4 Lp-PLA2诊断稳定斑块与不稳定斑块的cutoff值
进一步采用ROC曲线分析Lp-PLA2诊断稳定斑块与不稳定斑块的cutoff值。结果如图1所示,ROC曲线下的面积(AUC)为0.653(95%CI=0.543~0.763,P<0.01),而最大的youden指数为0.302,提示评估斑块是否稳定的Lp-PLA2 cutoff值为399.5 U/L时,其诊断灵敏度为40.8%,特异度为89.4%。
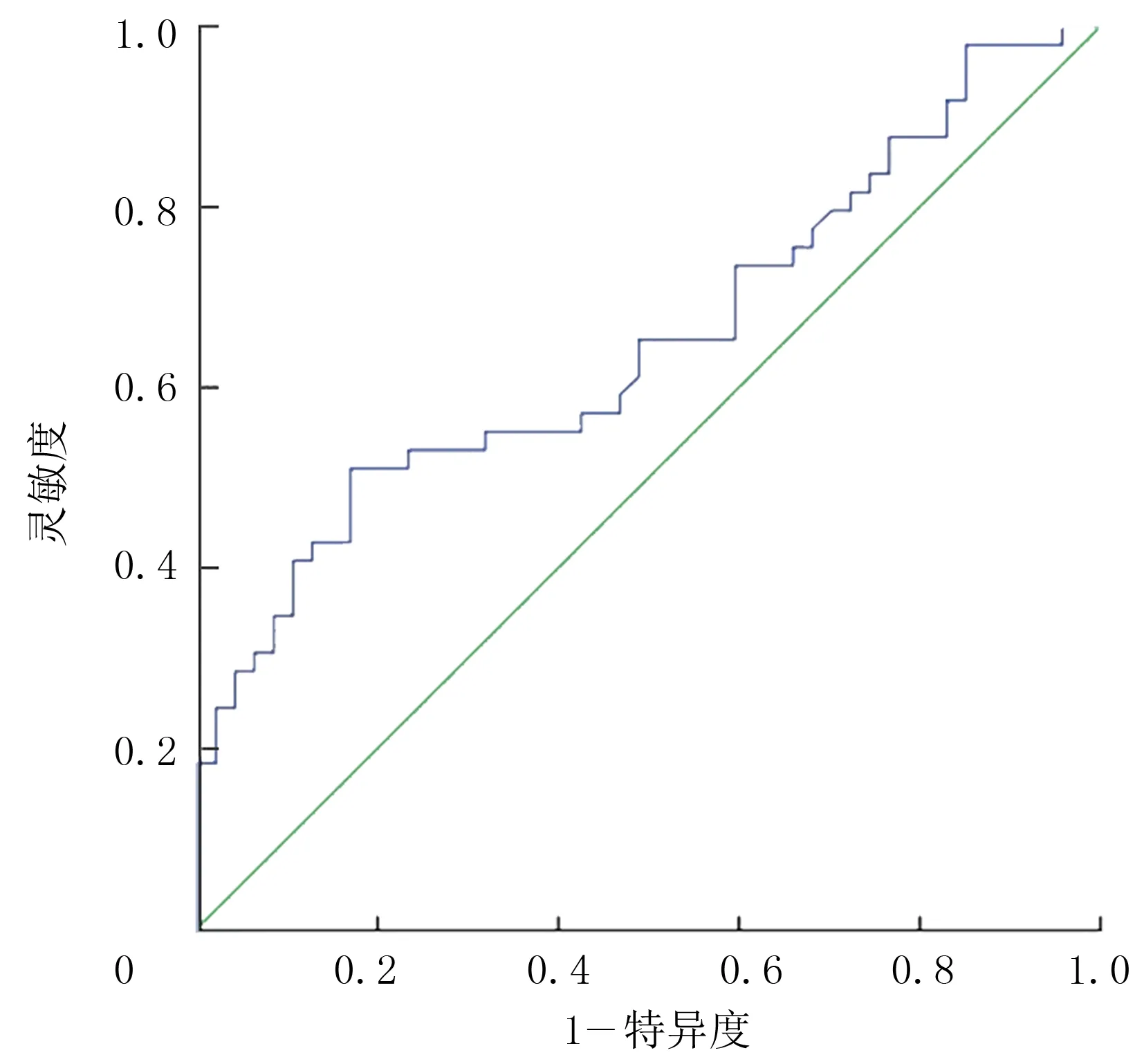
图1 两组Lp-PLA2活性水平的ROC曲线

表2 Lp-PLA2活性与斑块稳定性的Logistic回归分析
Q:四分位数;模型1:校准年龄、糖尿病病史、腰臀比、BMI;模型2:校准年龄、糖尿病病史、腰臀比、BMI、CHO、HDL、HbA1c、GLU;模型3:校准模型2中的所有变量及LDL。
3 讨 论
Lp-PLA2又称之为血小板活化因素乙酰水解酶(PAF-AH),是一类能催化脂蛋白和细胞膜上的甘油磷脂二位酰基酯键水解,形成非酯化脂肪酸和溶血磷脂的酶族[13-15]。人体血循环中的Lp-PLA2主要由T淋巴细胞和成熟的巨噬细胞合成和分泌,并受炎症递质的调节。人血浆中25%的Lp-PLA2结合于HDL,并在HDL的抗氧化及抗炎作用中起到显著的作用,70%的Lp-PLA2结合于LDL,当结合于小而密的LDL时,该酶的活性增高[13,15-16]。
本研究结果显示,和A组相比较,B组血清的Lp-PLA2活性水平显著升高,说明Lp-PLA2活性是不稳定斑块组的危险因素。评估斑块是否稳定的Lp-PLA2 cutoff值为399.5 U/L,其诊断灵敏度为40.8%,特异度为89.4%。
最新临床实验研究结果表明,Lp-PLA2水平可以反映斑块是否稳定[17-20]。LAVIS等[21]采用冠脉造影和血管内超声检查对冠状AS局部进行的探索性研究显示,血清Lp-PLA2水平在有AS的冠状动脉血管床处明显升高,当冠状动脉斑块消失时,Lp-PLA2的水平较前显著下降;同时该研究还表明,Lp-PLA2与炎性细胞的凋亡及破裂斑块坏死的核心区域有关,表明Lp-PLA2是从不稳定的斑块释放进入血循环的,这些研究都揭示了Lp-PLA2在影响斑块的稳定性以及可能在破裂过程中是一种潜在的炎症递质。美国FDA已经批准使用Lp-PLA2作为冠心病以及脑卒中长期预后风险评价指标[22]。KOLODGIE等[23]研究显示,Lp-PLA2在坏死核心、周围的巨噬细胞及破裂的斑块中高表达,在病变较弱的区域染色也相对较弱;在脂质核中心、巨噬细胞富集区和凋亡细胞及易损及破裂斑块的周围,Lp-PLA2水平增高,提示Lp-PLA2有促进斑块不稳定的潜在作用。MANNHEIM等[24]检测了167例颈AS病人的Lp-PLA2含量,结果显示有临床症状的颈AS病人中的Lp-PLA2的表达显著升高,尤以斑块坏死的脂质核心区域内明显。研究结果表明,Lp-PLA2的水平随着冠状动脉斑块的变化而变化,即斑块稳定时,Lp-PLA2水平降低[25]。SARION-BARTOLI等[26]研究显示,颈动脉狭窄和斑块不稳定病人的Lp-PLA2增加。Lp-PLA2可能用于指导无症状的颈动脉疾病病人的早期治疗。来自于国内南京医科大学的研究表明,Lp-PLA2与冠心病病人病变的薄纤维帽粥样斑块形成独立相关[27]。另有国内研究表明,血浆Lp-PLA2水平与颈动脉斑块性脑梗死有一定相关性,可以作为脑梗死鉴别以及评估颈动脉斑块稳定性的较好的指标[28-29]。然而,UESHIMA等[30]研究也指出,对于50~79岁的日本男性而言Lp-PLA2活性与颈动脉IMT及斑块稳定呈显著正相关,但是孟德尔随机化研究并不支持Lp-PLA2是亚临床AS的致病因素。因此,需要更多的临床试验研究证明Lp-PLA2的临床意义。目前分析斑块是否稳定的Lp-PLA2 cutoff值的文献较少。因临床病情变化及用药需要评估斑块是否稳定,而Lp-PLA2 cutoff值是评估斑块是否稳定的重要指标,需要大量文献与数据来进一步验证本研究的cutoff值,以尽快应用于临床。
综上所述,本试验已经证实Lp-PLA2是糖尿病病人颈动脉不稳定斑块的独立危险因素,且当Lp-PLA2 cutoff值为399.5 U/L时,其诊断斑块是否稳定的灵敏度为40.8%,特异度为89.4%。本研究结果为临床病人是否需要降低Lp-PLA2活性,是否需要进行稳定斑块的治疗提供了依据。
[参考文献]
[1] GAEDE P, LUND-ANDERSEN H, PARVING H H. Effect of a multifactorial intervention on mortality in type 2 diabetes[J]. N Engl J Med, 2008,358(6):580-591.
[2] LAM K S, XU A. Adiponectin: Protection of the endothelium[J]. Curr Diab Rep, 2005,5(4):254-259.
[3] NGUYEN M U, WALLACE M J, PEPE S, et al. Perinatal inflammation: A common factor in the early origins of cardiovascular disease[J]? Clin Sci (Lond), 2015,129(8):769-784.
[4] ZIRLIK A, LUTGENS E. An inflammatory link in atherosclerosis and obesity. Co-stimulatory molecules[J]. Hamostaseo-logie, 2015,35(3):272-278.
[5] NAMAZI M R, PARHIZKAR A R, JOWKAR F. Serum le-vels of hypersensitive-C-reactive protein in moderate and severe acne[J]. Indian Dermatol Online J, 2015,6(4):253-257.
[6] BONNEFONT-ROUSSELOT D. Lp-PLA2, a biomarker of vascular inflammation and vulnerability of atherosclerosis plaques[J]. Ann Pharm Fr, 2016,74(3):190-197.
[7] MAIOLINO G, BISOGNI V, ROSSITTO G, et al. Lipoprotein-associated phospholipase A2 prognostic role in atherosclerotic complications[J]. World J Cardiol, 2015,7(10):609-620.
[8] ROSS R. Atherosclerosis-an inflammatory disease[J]. N Engl J Med, 1999,340(2):115-126.
[9] HANSSON G K, LIBBY P. The immune response in atherosclerosis:A double-edged sword [J]. Nat Rev Immunol, 2006,6(7):508-519.
[10] CHARNIOT J C,KHANI-BITTAR R,ALBERTINI J P, et al. Interpretation of lipoprotein-associated phospholipase A2 levels is influenced by cardiac disease, comorbidities, extension of atherosclerosis and treatments[J]. Int J Cardiol, 2013,168(1):132-138.
[11] TIAN Y, JIA H, LI S, et al. The associations of stroke, transient ischemic attack, and/or stroke-related recurrent vascular events with Lipoprotein-associated phospholipase A2:A systematic review and meta-analysis[J]. Medicine (Baltimore), 2017,96(51):e9413.
[12] VAN IPEREN E P, SIVAPALARATNAM S, HOLMES M V, et al. Genetic analysis of emerging risk factors in coronary artery disease[J]. Atherosclerosis. 2016,254:35-41.
[13] DEUNIS E A. Diversity of group type, regulation, and function of phospholipase A2[J]. J Biol Chem, 1994,269(18):13057-13060.
[14] BRILAKIS E S, MECONNELL J P, LENNON R J, et al. Association of lipoprotein-associated phospholipase A2 levels with coronary artery disease risk factors, angiographic coronary artery disease, and major adverse events at follow-up[J]. Eur Heart J, 2005,26(2):137-144.
[15] SIX D A, DENNIS E A. The expanding superfamily of phospholipase A(2) enzymes: Classification and characterization[J]. Biochim Biophys Acta, 2000,1488(1-2):1-19.
[16] OEI H H, VAN DER MEER I M, HOFHIAN A, et al. Lipoprotein-associated phospholipase A2 activity is associated with risk of coronary heart disease and isehemic stroke:The Rotterdam Study[J]. Circulation, 2005,111(5):570-575.
[17] TSIMIKAS S, TSIRONIS L D, TSELEPIS A D. New insights into the role of lipoprotein(a)-associated lipoprotein-associated phospholipase A2 in atherosclerosis and cardiovascular disease[J]. Arterioscler Thromb Vasc Biol, 2007,27(10):2094-2099.
[18] LI D, WEI W, RAN X, et al. Lipoprotein-associated phospholipase A2 and risks of coronary heart disease and ischemic stroke in the general population: A systematic review and meta-analysis[J]. Cli Chim Acta, 2017,471:38-45.
[19] SOFOGIANNI A, ALKAGIET S, TZIOMALOS K. Lipoprotein-associated phospholipase A2 and coronary heart disease[J]. Curr Pharm Des, 2018,24(3):291-296.
[20] YOUNUS A, HUMAYUN C, AHMAD R, et al. Lipoprotein-associated phospholipase A2 and its relationship with markers of subclinical cardiovascular disease: A systematic review[J]. J Clin Lipidol, 2017,11(2):328-337.
[21] LAVIS, MC CONNELL J P. Local Production of Lipoprotein-associated phospholipase A2 and lysophosphatidylcholine in the coronary eirculation: Association with early coronary atherosclerosis and endothelial dysfullction inhuman [J]. Circulation, 2007,115(21):2715-2721.
[22] ALI M, MADJID M. Lipoprotein-associated phospholipase A2: A cardiovascular risk predctor and a potential therapeutic target[J]. Future Cardiol, 2009,5(2):159-173.
[23] KOLODGIE F D, BURKE A P, SKORIJA K S, et al. Lipoprotein-associated phospholipase A2 protein expression in the natural progression of human coronary atherosclerosis [J]. Arterioscler Thromb Vase Biol, 2006,26(11):2523-2529.
[24] MANNHEIM D, HEEMANN J, VERSARI D, et al. Enhanced expression of Lp-PLA2 and lysophosphatidylcholine in symptomatic carotid atherosclerotic plaques[J]. Stroke, 2008,39(5):1448-1455.
[25] DOHI T, MIYAUCHI K, OKAZAKI S, et al. Decreased circulating lipoprotein-associated phospholipase A2 levels are associated with coronary plaque regression in patients with acute coronary syndrome[J]. Atherosclerosis, 2011,219(2):907-912.
[26] SARION-BARTOLI, BOUDES A, BUFFAT C, et al. Circulating lipoprotein-associated phospholipase A2 in high-grade carotid stenosis: A new biomarker for predicting unstable plaque[J]. Eur J Vasc Endovasc Surg, 2012,43(2):154-159.
[27] 钟赟,叶飞,尤威,等. 血清炎症因子水平与冠状动脉罪犯病变纤维脂质斑块纤维帽厚度的相关性研究[J]. 中华心血管病杂志, 2017,45(7):566-571.
[28] 文关良,剌梅. 脂蛋白相关磷脂酶A2在颈动脉斑块性脑梗死中的临床意义[J]. 现代检验医学杂志, 2017,32(2):117-118.
[29] 何毅,伍建明,张猛,等. 脑梗死病人外周血与颈动脉斑块内脂蛋白相关磷脂酶A2表达的相关性[J]. 中国实用神经疾病杂志, 2016,19(23):9-11.
[30] UESHIMA H, KADOWAKI T, HISAMATSU T, et al. Li-poprotein-associated phospholipase A2 is related to risk of subclinical atherosclerosis but is not supported by Mendelian randomization analysis in a general Japanese population[J]. Atherosclerosis, 2016,246:141-147.

