腹腔镜保留脾脏的脾门区淋巴结清扫术在进展期胃中上部癌中的应用研究
鲍 峰,向荣超,鲜于剑波,王 东,邓志刚,向春华,李国强,智 星,刘 文
(绵阳市中心医院,四川 绵阳,621000)
胃癌是消化系统常见的恶性肿瘤之一,目前在世界范围内发病率居男性的第4位,女性的第5位,死亡率居男性的第3位,女性的第5位[1]。在我国,胃癌发病率居男性的第2位,女性的第3位,死亡率居因恶心肿瘤死亡的第2位[2]。其中,胃中上部癌的发病率近年在我国呈上升趋势[3]。进展期胃中上部癌容易发生脾门淋巴结(No.10淋巴结)转移,文献报道转移率为8.8%~21.0%[4-7]。根据日本胃癌处理规约,胃上部癌行D2淋巴结清扫术需包括No.10淋巴结在内的No.1~No.12组淋巴结[8]。近年随着腹腔镜技术的逐渐成熟,目前已有不少研究报道腹腔镜保留脾脏的脾门区淋巴结清扫术(laparoscopic spleen-preserving splenic hilar lymphadenectomy,LSPL)[9-11]。自2014年1月开始我院施行LSPL,效果良好,现将结果报道如下。
1 资料与方法
1.1 临床资料 回顾分析2014年1月至2017年10月我院诊断为胃中上部癌并行根治性D2淋巴结清扫术的患者资料。纳入标准:(1)术前经内镜下病检证实为胃癌;(2)术前经内镜、全腹增强CT等检查证实为局部进展期胃中上部癌;(3)术前胸部CT、全腹增强CT等检查提示无肝、肺、腹腔等远处转移;(4)术前全腹增强CT等检查无腹主动脉周围淋巴结明显肿大,无肿瘤直接侵犯胰腺、脾脏、肝脏、结肠等周围脏器;(5)行全胃切除术联合D2淋巴结清扫术,且术后病理学诊断为R0切除。排除标准:(1)T4b期肿瘤;(2)脾门淋巴结肿大并融合成团;(3)术中腹腔镜探查见肿瘤腹腔种植或远处转移;(4)临床病理资料不全。根据2009年第7版国际抗癌联盟肿瘤分期标准[12]进行TNM分期。在术前充分告知腹腔镜与开腹手术利弊的情况下,患者自愿选择行腹腔镜或开腹手术。本研究已得到绵阳市中心医院伦理委员会的批准。
1.2 手术方法 两组均采用气管插管全身麻醉,D2淋巴结清扫按日本胃癌治疗指南进行[13],均由同一组医师行开腹或腹腔镜根治性全胃切除术、D2淋巴结清扫术。开腹组:用纱布垫于脾脏后方,将脾脏托起后行保留脾脏的脾门淋巴结清扫术。腔镜组Trocar位置及常规淋巴结清扫同文献报道[14],参考文献报道[15-16]行脾门淋巴结清扫,具体方法:于胰腺上缘由腹腔干定位脾动脉,自右向左清扫No.11组淋巴结,并向脾门方向推进。离断胃网膜左血管,清扫No.4sb组淋巴结。展开脾胃韧带,沿脾脏表面离断胃短血管,清扫No.4sa组淋巴结。以胃网膜左动脉断端为起点,沿脾血管终末支表面的解剖间隙游离,游离至胰尾时,将胰尾向头侧掀起,进入胰后间隙,使脾蒂悬空,清扫胰后间隙淋巴结,直至清除No.10组淋巴结。见图1。

图1 脾门淋巴结清扫过程。A:胰腺上缘定位腹腔干,沿脾动脉清扫No.11p及No.11d组淋巴结;B:清扫脾脏后上方淋巴结;C:沿胰尾清扫脾血管周围淋巴结;D:沿脾血管定位胃网膜左血管并离断,清扫No.4sb组淋巴结;E、F:沿脾胃韧带离断胃短血管,清扫No.4sa组淋巴结;G:清扫脾动脉分支周围淋巴结;H:清扫脾蒂后方胰后间隙淋巴结;I:清扫结束效果
1.3 淋巴结获取 术中标记主要血管,术后从整块切除的标本中剪取相应区域的淋巴结及周围脂肪组织,并按日本胃癌处理规约[13]的方法进行编号,由病理科医师对淋巴结进行取材检验、诊断。
1.4 观察指标 分析总手术时间、术中出血量、淋巴结清扫数量、脾门淋巴结清扫数量、脾门淋巴结转移率、脾切除率、术后肛门排气时间、术后进流质食物时间、术后下床活动时间、术后住院时间、术后并发症发生情况等。

2 结 果
2.1 两组患者一般情况 共98例患者施行了全胃切除并D2淋巴结清扫术,排除4例[4.1%(4/98)]中转开腹患者后,最终94例患者纳入本研究。患者29~70岁,平均(56.3±8.9)岁,其中腔镜组68例,开腹组26例。两组患者年龄、性别、BMI、ASA评分、Charlson合并症指数[17]、分化程度及肿瘤最大径、部位、pT分期、pN分期等差异均无统计学意义(P>0.05)。见表1。
2.2 淋巴结清扫 腹腔镜组术中出血量显著少于开腹组,差异有统计学意义(P<0.05)。两组手术时间、淋巴结清扫数量、脾门淋巴结清扫数量、脾门淋巴结阳性率差异无统计学意义(P>0.05)。两组分别有3例(4.4%)、2例(7.7%)患者因术中损伤脾动脉干而行脾切除术,余者均成功行保脾No.10淋巴结清扫术,两组切脾率差异无统计学意义(P>0.05)。见表2。
2.3 术后恢复情况及并发症 腹腔镜组术后下床活动时间、术后住院时间优于开腹组,差异有统计学意义(P<0.05)。两组术后肛门排气时间、进流质时间差异无统计学意义(P>0.05)。两组均无死亡病例,腹腔镜组术后发生并发症7例(10.3%),其中单纯腹腔感染1例、单纯肺部感染1例、单纯菌血症2例,1例患者术后并发肺部感染与腹腔感染,1例患者术后并发肺部感染与菌血症,1例术后出血患者经再次手术并切除脾脏;开腹组术后发生并发症3例(11.5%),其中单纯腹腔感染1例,肺部感染合并切口感染1例,肺部感染合并菌血症1例。两组术后并发症发生率差异无统计学意义(P>0.05)。见表3。


组别性别(n)男女年龄(岁)BMI(kg/m2)ASA评分(n)1级2级Charlson指数(n)1分2~3分分化程度(n)G1~2G3~4腹腔镜组392955.4±9.322.1±3.2323658102840开腹组151158.8±7.122.7±2.711152061016t/χ2值0.0011.6670.8250.1710.4350.058P值0.9760.0990.4110.6790.5100.810
续表1

组别肿瘤最大径(cm)肿瘤部位(n)胃小弯胃大弯pT分期(n)T2T3T4apN分期(n)N0N1N2N3腹腔镜组4.4±1.9452316292312151328开腹组5.2±3.1179213115678t/χ2值1.5080.0053.5291.104P值0.1350.9420.1710.776
表2 两组患者手术及淋巴结清扫情况的比较
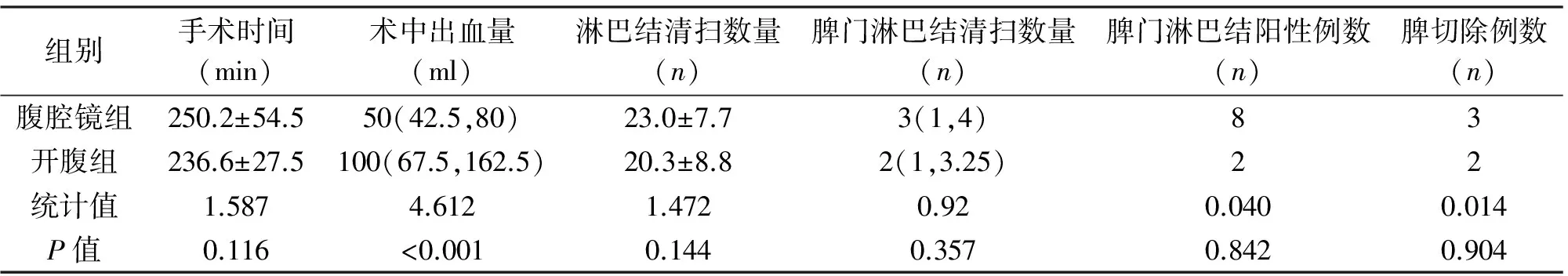
组别手术时间(min)术中出血量(ml)淋巴结清扫数量(n)脾门淋巴结清扫数量(n)脾门淋巴结阳性例数(n)脾切除例数(n)腹腔镜组250.2±54.550(42.5,80)23.0±7.73(1,4)83开腹组236.6±27.5100(67.5,162.5)20.3±8.82(1,3.25)22统计值1.5874.6121.4720.920.0400.014P值0.116<0.0010.1440.3570.8420.904


组别术后住院时间(d)术后肛门排气时间(d)术后进食流质时间(d)术后下床活动时间(d)术后并发症(n)出血腹腔感染肺部感染菌血症切口感染腹腔镜组12.3±3.63.5±1.34.3±1.53.6±1.512330开腹组14.5±4.13.9±0.74.6±1.04.4±1.701211t/χ2值2.4941.7141.1482.0760.000P值0.0140.0910.2540.0411.000
3 讨 论
研究表明[18-20],腹腔镜D2淋巴结清扫对于进展期胃癌是安全、可行的,远期生存与开腹手术亦具有可比性。研究表明,脾门淋巴结清扫对于提高胃中上部癌患者的远期生存率是十分有益的。Zhu等[21]回顾性分析为265例施行D2/D3联合脾门淋巴结清扫的中上部胃癌患者发现,对于R0切除的患者,脾门淋巴结阳性患者的预后显著差于脾门淋巴结阴性的患者,脾门淋巴结阳性是患者预后相关的独立危险因素。同时,多项研究表明[22-23],与保留脾脏的脾门淋巴结清扫相比,脾切除术并不改善患者的长期生存,反而可能导致术后并发症发生率、病死率增加。因此,目前在NCCN指南中也不推荐预防性脾脏切除[24]。同时,根据日本胃癌处理规约,对于Ⅲb期、Ⅳ期胃中上部癌及肿瘤已浸入胰腺、脾脏或已明确伴有No.10、No.11组淋巴结转移时,需考虑行联合胰体尾、脾脏切除,此外进展期胃中上部癌建议行全胃切除及D2淋巴结清扫术,包括No.10淋巴结清扫[8]。
随着腹腔镜技术的进步,LSPL已得到逐步开展。Li等[10]回顾分析108例行LSPL的进展期胃上部癌患者认为,LSPL是可行、有效的,尤其胃大弯侧的T3期肿瘤。Guan等[25]回顾分析了97例cT1~2期行全胃切除、脾门淋巴结清扫的中上部胃癌患者,结果显示,与开腹组相比,腔镜组淋巴结切除数量相近、并发症发生率相近(P>0.05),而术中失血量显著减少,术后下床活动时间、术后肛门排气时间、进食流质时间早,术后住院时间显著缩短,差异有统计学意义(P<0.05),认为对于cT1~2期的中上部胃癌,脾门淋巴结清扫是安全、可行的。Huang等[26]回顾性分析了2007~2012年前瞻性收集的548例行腹腔镜下全胃切除的胃癌患者,将其中200例行脾门淋巴结清扫的患者与348例未行脾门淋巴结清扫的患者进行倾向性评分匹配分析后发现,脾门清扫组3年无瘤生存率显著高于未清扫组(61.6% vs. 53.7%,P=0.034),尤其TNM Ⅲ期的患者,认为LSPL是安全、可行的;益于提高TNM Ⅲ期的近端胃癌患者的3年无瘤生存率。本研究也发现,与开腹组相比,腹腔镜组术中出血量显著减少,术后下床活动时间、术后住院时间显著缩短,差异有统计学意义(P<0.05),体现了LSPL的微创优势;而两组手术时间、淋巴结清扫数量、脾门淋巴结清扫数量、脾门淋巴结阳性率、切脾率、术后肛门排气时间、术后进食流质时间、术后并发症发生率差异均无统计学意义(P>0.05),表明LSPL的近期临床效果与开腹手术相当。
脾门区淋巴结清扫是腹腔镜胃癌根治术的难点之一。由于脾门区解剖复杂,血管变异多,且术中暴露较困难,因此常导致血管损伤而行脾脏切除。成功施行LSPL离不开术者高超的手术技巧、手术团队的良好配合及耐心细致的操作[9,27],术中如何避免脾血管损伤是手术成功的关键环节之一。本研究中,两组分别有3例、2例患者因术中损伤脾动脉干而行脾切除术,术后分析原因考虑术中对血管异常走向认识不全面及团队配合经验不足。Wang等[28]回顾性分析了2010~2013年312例行LSPL的中上部胃癌患者,术前行3D CT检查的患者手术时间、术中出血量显著低于未行3D CT检查的患者,认为术前3D CT对于降低手术风险是非常重要的。此外,建立标准化、规范化的手术入路与步骤,同时进行相关的腹腔镜技术培训也是重要的解决方法之一[29]。
总之,LSPL应用于胃中上部癌的脾门淋巴结清扫安全、有效,与开腹手术相比,具有微创、出血少及术后康复快等优势,临床疗效满意。相信随着腹腔镜技术的进步,LSPL会被越来越多的临床外科医师所掌握。
参考文献:
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Liu K,Yang K,Zhang W,et al.Changes of Esophagogastric Junctional Adenocarcinoma and Gastroesophageal Reflux Disease Among Surgical Patients During 1988-2012:A Single-institution,High-volume Experience in China[J].Ann Surg,2016,263(1):88-95.
[4] Li C,Kim S,Lai JF,et al.Lymph node dissection around the splenic artery and hilum in advanced middle third gastric carcinoma[J].Eur J Surg Oncol,2009,35(7):709-714.
[5] Ikeguchi M,Kaibara N.Lymph node metastasis at the splenic hilum in proximal gastric cancer[J].Am Surg,2004,70(7):645-648.
[6] Chen XL,Yang K,Zhang WH,et al.Metastasis,risk factors and prognostic significance of splenic hilar lymph nodes in gastric adenocarcinoma[J].PLoS One,2014,9(6):e99650.
[7] Sasada S,Ninomiya M,Nishizaki M,et al.Frequency of lymph node metastasis to the splenic hilus and effect of splenectomy in proximal gastric cancer[J].Anticancer Res,2009,29(8):3347-3351.
[8] Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2014 (ver. 4)[J].Gastric Cancer,2017,20(1):1-19.
[9] Huang CM,Zhang JR,Zheng CH,et al.A 346 case analysis for laparoscopic spleen-preserving no.10 lymph node dissection for proximal gastric cancer:a single center study[J].PLoS One,2014,9(9):e108480.
[10] Li P,Huang CM,Zheng CH,et al.Laparoscopic spleen-preserving splenic hilar lymphadenectomy in 108 consecutive patients with upper gastric cancer[J].World J Gastroenterol,2014,20(32):11376-11383.
[11] Yang K,Zhang WH,Chen XZ,et al.Survival benefit and safety of no. 10 lymphadenectomy for gastric cancer patients with total gastrectomy[J].Medicine (Baltimore),2014,93(25):e158.
[12] Sobin LH,Gospodarowicz MK,Wittekind C.TNM classification of malignant tumors[M].7th ed.Hoboken:John Wiley & Sons,2009:20.
[13] Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2010 (ver. 3)[S].Gastric Cancer,2011,14(2):113-123.
[14] 赵平武,鲍峰,邓志刚.肥胖胃癌患者行腹腔镜全胃切除术的临床效果[J].腹腔镜外科杂志,2014,19(11):814-817.
[15] 李国新,牟廷裕,余江,等.胰后入路保留胰脾的原位脾门淋巴结清扫在腹腔镜胃癌根治术中的应用[J].中华消化外科杂志,2012,11(1):58-60.
[16] 陈起跃,黄泽宁,黄昌明,等.“黄氏三步法”在进展期胃上部癌腹腔镜保脾脾门淋巴结清扫术中的应用[J].中华消化外科杂志,2015,14(3):187-191.
[17] Charlson M,Wells MT,Ullman R,et al.The Charlson comorbidity index can be used prospectively to identify patients who will incur high future costs[J].PLoS One,2014,9(12):e112479.
[18] Hu Y,Huang C,Sun Y,et al.Morbidity and Mortality of Laparoscopic Versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer:A Randomized Controlled Trial[J].J Clin Oncol,2016,34(12):1350-1357.
[19] Chen XZ,Wen L,Rui YY,et al.Long-term survival outcomes of laparoscopic versus open gastrectomy for gastric cancer:a systematic review and meta-analysis[J].Medicine (Baltimore),2015,94(4):e454.
[20] Qi X,Liu Y,Wang W,et al.Management of advanced gastric cancer:An overview of major findings from meta-analysis[J].Oncotarget,2016,7(47):78180-78205.
[21] Zhu GL,Sun Z,Wang ZN,et al.Splenic hilar lymph node metastasis independently predicts poor survival for patients with gastric cancers in the upper and/or the middle third of the stomach[J].J Surg Oncol,2012,105(8):786-792.
[22] Sano T,Sasako M,Mizusawa J,et al.Randomized Controlled Trial to Evaluate Splenectomy in Total Gastrectomy for Proximal Gastric Carcinoma[J].Ann Surg,2017,265(2):277-283.
[23] Bartlett EK,Roses RE,Kelz RR,et al.Morbidity and mortality after total gastrectomy for gastric malignancy using the American College of Surgeons National Surgical Quality Improvement Program database[J].Surgery,2014,156(2):298-304.
[24] Ajani JA,D'Amico TA,Almhanna K,et al.Gastric Cancer,Version 3.2016,NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw,2016,14(10):1286-1312.
[25] Guan G,Jiang W,Chen Z,et al.Early results of a modified splenic hilar lymphadenectomy in laparoscopy-assisted total gastrectomy for gastric cancer with stage cT1-2:a case-control study[J].Surg Endosc,2013,27(6):1923-1931.
[26] Huang CM,Chen T,Lin JX,et al.The effects of laparoscopic spleen-preserving splenic hilar lymphadenectomy on the surgical outcome of proximal gastric cancer:a propensity score-matched,case-control study[J].Surg Endosc,2017,31(3):1383-1392.
[27] Son T,Lee JH,Kim YM,et al.Robotic spleen-preserving total gastrectomy for gastric cancer:comparison with conventional laparoscopic procedure[J].Surg Endosc,2014,28(9):2606-2615.
[28] Wang JB,Huang CM,Zheng CH,et al.Role of 3DCT in laparoscopic total gastrectomy with spleen-preserving splenic lymph node dissection[J].World J Gastroenterol,2014,20(16):4797-4805.
[29] Choi YY,An JY,Hyung WJ,et al.Comments to young surgeons concerning laparoscopic spleen-preserving D2 lymph node dissection for advanced gastric cancer on the upper body[J].Chin J Cancer Res,2014,26(3):231-233.

