曲妥珠单抗联合紫杉醇治疗人表皮生长因子受体-2过表达转移性乳腺癌的疗效和安全性评价
常 伟,丁 敏,周建华,张明雷
(新乡市第一人民医院肿瘤科,河南 新乡 453000)
人表皮生长因子受体-2(human epidermal growth factor receptor-2,Her-2)是人表皮生长因子受体家族的第2位成员,有研究发现,其高表达与乳腺癌患者的早期转移和预后不良密切相关[1-2]。曲妥珠单抗是重组人源化抗P185 Her-2单克隆抗体,与Her-2蛋白有高度的亲和力,并可部分对抗Her-2过表达产生的促肿瘤生长作用[3]。目前,紫杉醇联合曲妥珠单抗是Her-2过表达乳腺癌的标准一线治疗方案,但对于经济相对落后地区,该方案的使用仍然受到患者经济水平和医疗条件的限制,并且关于二、三线使用紫杉醇联合曲妥珠单抗治疗Her-2阳性转移性乳腺癌患者的结果尚无一致结论,因此,本研究旨在探讨二、三线使用该联合方案治疗Her-2过表达转移性乳腺癌中的疗效和安全性。
1 资料与方法
1.1一般资料选择2012年3月至2015年3月新乡市第一人民医院收治的转移性乳腺癌患者为研究对象。病例纳入标准:经病理活组织检查确诊;免疫组织化学联合原位杂交技术检测结果为Her-2过表达且基因扩增的转移性乳腺癌;卡氏(Karnofsky,KPS)评分[4]≥60分;左心室射血分数≥55%,心电图正常;有客观可评价的病灶。排除标准:无足够的骨髓及脏器功能储备;预计生存期<3个月;对紫杉醇或曲妥珠单抗过敏或禁忌者;不愿加入本试验者。根据纳入、排除标准共纳入58例Her-2过表达的转移性乳腺癌患者,均为女性;年龄32~61岁,中位年龄40岁;既往已行一线化学治疗34例,二线化学治疗24例;既往使用过紫杉类药物26例,既往未使用过紫杉类药物32例;病理类型均为浸润性导管癌;雌激素受体和(或)孕激素受体阳性21例,阴性37例;有1个部位转移者20例,2个部位转移者21例,3个及以上部位转移者17例。所有患者均签署知情同意书,本研究经医院伦理委员会论证批准。
1.2治疗方案所有患者治疗周期的第1天使用紫杉醇(扬子江药业集团有限公司,国药准字H20058719)和曲妥珠单抗(上海罗氏制药有限公司,国药准字J20170037)。紫杉醇175 mg·m-2静脉滴注,每21 d重复1次。患者接受紫杉醇治疗前均常规给予地塞米松和5-羟色胺受体阻断剂预防不良反应。曲妥珠单抗的首次剂量为8 mg·kg-1,第2次及以后的维持剂量为6 mg·kg-1,药物溶于生理盐水500 mL 90 min滴完,不允许静脉推注或快速滴注。首次应用曲妥珠单抗时要观察至少6 h(即在输注完后4.5 h)。如果首次应用无不良事件,第2次用药的观察期可缩短至2 h(即输注完后30 min)。曲妥珠单抗的总量根据患者的实际体质量计算,如果治疗期间患者的体质量变化>10%,曲妥珠单抗的总量需重新计算,曲妥珠单抗每21 d重复1次。所有患者均治疗2个周期以上,每周期化学治疗前后检查血常规、肝肾功能和心电图、心功能,若左心室射血分数与基线比较降低10%或以上,或左心室射血分数在50%以下,则立即停止应用曲妥珠单抗。中性粒细胞低于1.0×109L-1者给予粒细胞集落刺激因子治疗。
1.3疗效评定标准采用肿瘤客观疗效判定标准[5]评价治疗效果:完全缓解(complete remission,CR):所见肿瘤病变完全消失,并至少维持4周以上;部分缓解(partial remission,PR):肿瘤病灶的最大径及最大垂直径的乘积减少50%以上,并维持4周以上,无新的病灶出现;稳定(stable disease,SD):肿瘤病灶的两径乘积缩小50%以下或增大25%以内,无新的病变出现,并至少维持4周以上;进展(progressive disease,PD):肿瘤病灶的两径乘积增大25%以上或出现新病灶;新出现胸腹水,且肿瘤细胞呈阳性,亦判定为PD。有效率=(CR例数+PR例数)/总例数×100%。毒性反应按照世界卫生组织抗癌药物毒副反应分级标准[5]评价,分为0~Ⅳ度。
1.4随访治疗后采用门诊和电话相结合形式进行随访,随访终点为2017年2月28日,患者出院后随访终点事件为肿瘤特异性死亡,记录患者3 a生存率。
1.5统计学处理应用SPSS 18.0软件进行数据分析,计数资料使用构成比或率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1治疗效果58例患者中,53例完成至少2个周期的联合化学治疗,5例因不能耐受的不良反应而退出,本研究的脱落率为8.6%(5/58)。53例患者的化学治疗周期为6~8个周期,其中CR 6例,PR 24例,SD 12例,PD 11例,治疗有效率为56.6%(30/53)。53例患者的3 a生存率为28.3%(15/53)。既往未使用过紫杉类药物患者的有效率显著高于既往使用过者(P<0.05),既往治疗情况、雌孕激素受体情况及转移部位的数量对治疗效果无明显影响(P>0.05);既往已行一线化学治疗患者的3 a生存率显著高于既往已行二线化学治疗者(P<0.05),既往是否使用过紫杉类药物、雌孕激素受体情况及转移部位的数量对患者3 a生存率无明显影响(P>0.05);见表1。
表1不同临床特征患者的疗效比较
Tab.1Comparisonofefficacyofpatientswithdifferentclinicalfeatures

临床特征n有效/例(%)χ2P3 a生存/例(%)χ2P既往治疗 一线化学治疗3322(66.6)3.6050.05813(39.4)5.3020.021 二线化学治疗208(40.0)2(10.0)既往紫杉类用药 未使用2820(71.4)5.3110.0218(28.6)0.0020.963 使用2510(40.0)7(28.0)雌孕激素受体 阳性219(42.9)2.6760.1023(14.3)3.3670.066 阴性3221(65.6)12(37.5)转移部位 1个1911(57.9)7(36.8) 2个199(47.4)1.2910.5244(21.1)1.1950.550 3个及以上1510(66.6)4(26.7)
2.2不良反应患者常见不良反应为中性粒细胞减少、贫血、血小板减少、恶心和呕吐、腹泻、皮疹、周围神经毒性、肝功能异常、心力衰竭、寒战和发热、脱发等。其中中性粒细胞减少(75.5%,40/53)、贫血(71.7%,38/53)和血小板减少(50.9%,27/53)最常见,为主要的不良反应,并且存在Ⅲ度及以上级别,见表2。不同临床特征患者中性粒细胞减少、贫血、血小板减少发生率比较差异均无统计学意义(P>0.05),见表3。
表253例患者不良反应发生情况
Tab.2Adversereactionsin53patients
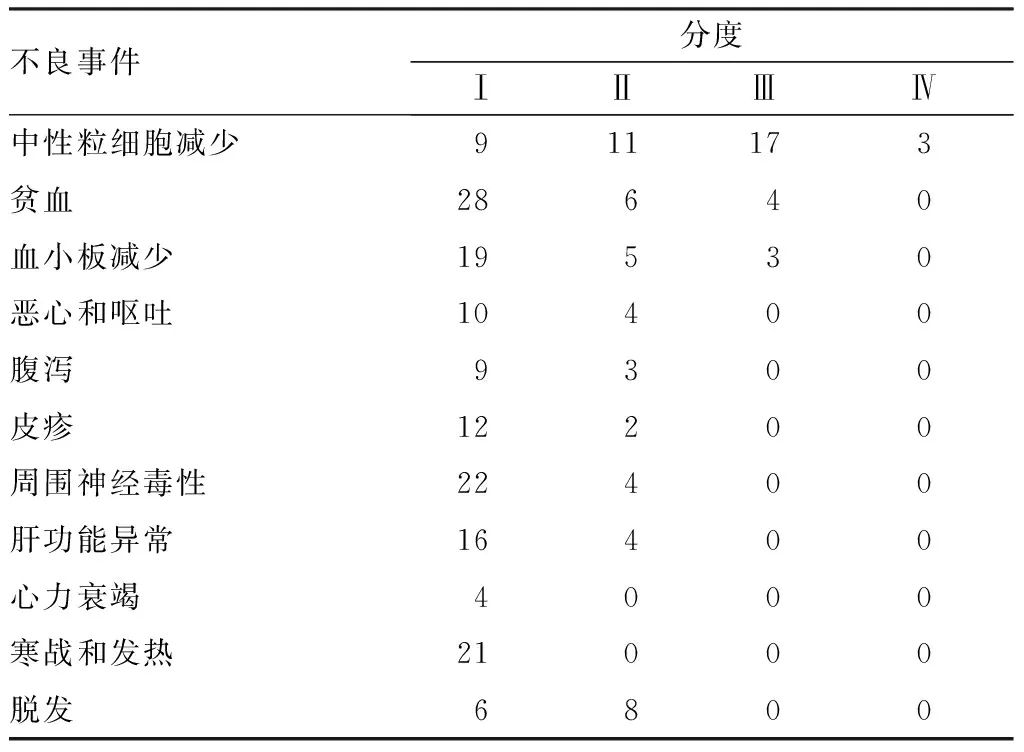
不良事件分度ⅠⅡⅢⅣ中性粒细胞减少911173贫血28640血小板减少19530恶心和呕吐10400腹泻9300皮疹12200周围神经毒性22400肝功能异常16400心力衰竭4000寒战和发热21000脱发6800
表3不同临床特征患者的主要不良反应发生情况比较
Tab.3Comparisonofthemainadversereactionsofpatientswithdifferentclinicalfeatures
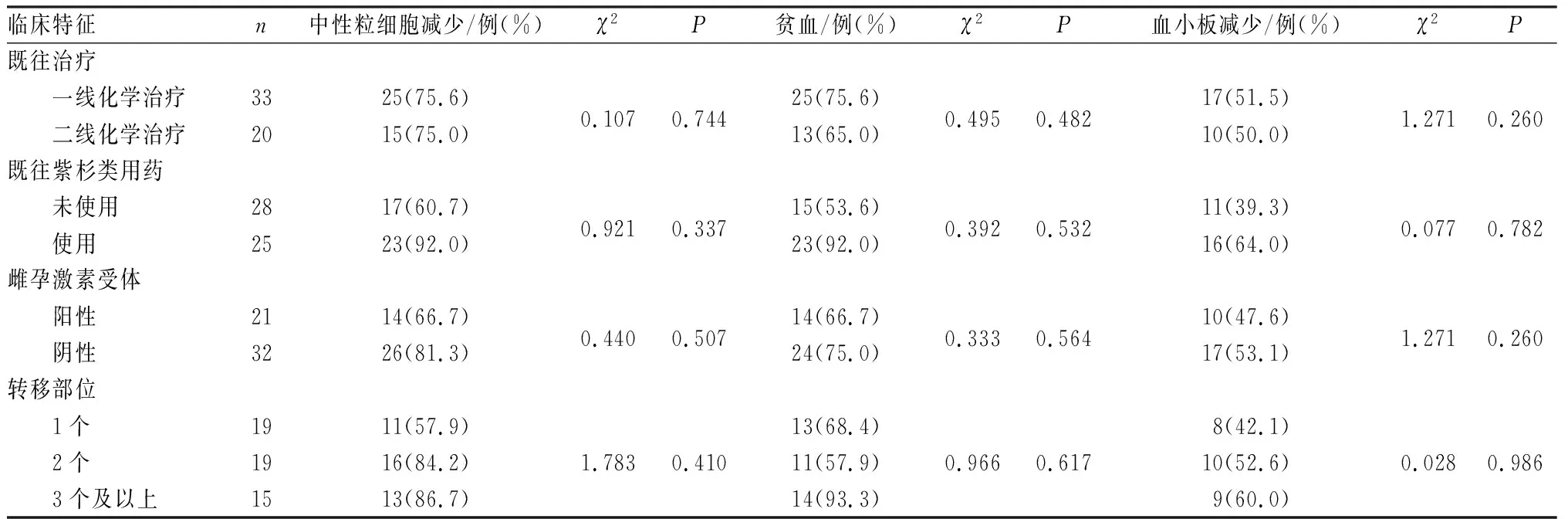
临床特征n中性粒细胞减少/例(%)χ2P贫血/例(%)χ2P血小板减少/例(%)χ2P既往治疗 一线化学治疗3325(75.6)0.1070.74425(75.6)0.4950.48217(51.5)1.2710.260 二线化学治疗2015(75.0)13(65.0)10(50.0)既往紫杉类用药 未使用2817(60.7)0.9210.33715(53.6)0.3920.53211(39.3)0.0770.782 使用2523(92.0)23(92.0)16(64.0)雌孕激素受体 阳性2114(66.7)0.4400.50714(66.7)0.3330.56410(47.6)1.2710.260 阴性3226(81.3)24(75.0)17(53.1)转移部位 1个1911(57.9)13(68.4)8(42.1) 2个1916(84.2)1.7830.41011(57.9)0.9660.61710(52.6)0.0280.986 3个及以上1513(86.7)14(93.3)9(60.0)
3 讨论
病理学研究表明,Her-2在大约25%的乳腺癌患者中呈阳性过表达,Her-2过表达可能直接影响患者的生存预后,使各种治疗包括手术、放射治疗、化学治疗的预后相对不良,而Her-2受体抑制剂曲妥珠单抗可竞争性地结合Her-2受体,从而影响Her-2受体下游的信号转导,达到抑制肿瘤生长的目的[2]。紫杉醇是一种细胞毒类抗癌药物,为微管抑制剂,可促进微管双聚体装配成微管,而后通过防止去多聚化过程而使微管稳定化,这种稳定化作用抑制微管网正常动力学重组,而微管网的重组是维持细胞生命周期和细胞分裂活动所必需的,因此,它具有抑制肿瘤细胞生长的作用[6]。有研究表明,曲妥珠单抗单药治疗转移性乳腺癌的有效率为 11%~26%,而联合紫杉类药物后有效率可明显提高到36%~88%[7]。虽然两药的联合已逐步成为一线治疗的首选方案,但对于经济欠发达地区,该联合方案作为一线首选尚不可行,因此,本研究评价了二、三线使用曲妥珠单抗联合紫杉醇对于Her-2过表达转移性乳腺癌患者的疗效和安全性,结果发现,联合用药的有效率为56.6%,3 a生存率为28.3%。本研究还发现,既往未使用紫杉类药物患者的有效率显著高于既往使用者,而既往已行一线化学治疗患者的3 a生存率显著高于既往已行二线化学治疗者,联合化学治疗的主要不良反应为骨髓抑制,不同临床特征患者中性粒细胞减少、贫血、血小板减少发生率比较差异并无统计学意义。
MONTEMURRO等[8]在23例Her-2过表达的转移性乳腺癌患者中评价了联合用药的疗效和安全性,发现其客观反应率为70%,其中1例患者达到了CR,治疗中最主要的不良反应为中性粒细胞减少。周宁宁等[9]的研究认为,二、三线使用曲妥珠单抗联合多西紫杉醇方案治疗Her-2高表达转移性乳腺癌近期疗效较高,其客观缓解率为63.64%,中位疾病进展时间5.4个月,不良反应轻,患者可以耐受。本研究的总体疗效和安全性结果与之基本一致,但本研究还发现,既往未使用紫杉类药物患者的客观有效率高于既往使用者,既往已行一线化学治疗患者的3 a生存率高于既往已行二线化学治疗者,可能是患者机体增强了对紫杉类药物的耐药性,使得既往未使用者更有效,而在本研究纳入的已行二线化学治疗的患者中也有相当一部分患者已使用了紫杉类药物,因此造成了这样的差异结果。
综上所述,本研究认为二、三线使用曲妥珠单抗联合紫杉醇治疗Her-2过表达转移性乳腺癌患者仍有较好疗效,并且安全、可耐受;且对既往未使用紫杉类药物和仅行一线化学治疗患者的疗效更优。曲妥珠单抗和紫杉类药物联合治疗Her-2过表达转移性乳腺癌患者仍具有巨大优势,以往未使用过曲妥珠单抗和紫杉类药物治疗的Her-2过表达转移性乳腺癌患者可优先考虑使用曲妥珠单抗。对于使用过紫杉醇的患者曲妥珠单抗与哪些化学治疗药物联合能取得更好疗效需要进一步临床试验探索。目前,曲妥珠单抗在河南省已纳入各种医疗保险报销目录,从经济效益比着眼,其有较好的临床应用前景。
参考文献:
[1] 麦国丰,罗荣城,马树东,等.HER2表达与乳腺癌预后的相关性研究[J].解放军医学杂志,2003,28(10):902-903.
[2] 王进,马斌林.乳腺癌 HER-2基因的表达及其临床意义[J].中国肿瘤临床与康复,2006,13(1):14-16.
[3] SLIWKOWSKI M X,LOFGREN J A,LEWIS G D,etal.Nonclinical studies addressing the mechanism of action of trastuzumab(Herceptin)[J].SeminOncol,1999,26(4 Suppl 12):60-70.
[4] 刘敏,张璐,孙丽华,等.辽宁省肿瘤化疗患者KPS评分情况分析[J].中国肿瘤,2013(8):635-637.
[5] 张京晶,孟琼,常巍,等.肿瘤临床疗效评价研究现状与进展[J].癌症,2010,29(2):250-254.
[6] 陈丽荣,郑树.紫杉醇诱发人乳癌细胞凋亡的机制研究[J].中华肿瘤杂志,1997,19(2):103-106.
[7] MARTY M,COGNETTI F,MARANINCHI D,etal.Randomized phase Ⅱ trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment:the M77001 study group[J].JClinOncol,2005,23(19):4265-4274.
[8] MONTEMURRO F,CHOA G,FAGGIUOLO R,etal.Safety and activity of docetaxel and trastuzumab in HER2 overexpressing metastatic breast cancer:a pilot phase Ⅱ study[J].AmJClinOncol,2003,26(1):95-97.
[9] 周宁宁,林归滨,刘冬耕,等.曲托珠单抗联合多西紫杉醇治疗Her-2/neu高表达转移性乳腺癌的疗效和不良反应[J].癌症,2008,27(9):947-950.

