ω-3多不饱和脂肪酸对脂多糖所致脑损伤新生大鼠海马组织中氧化应激产物和细胞凋亡的影响
石计朋,栗延伟,郭丽娟,张利利,何晓敬,王卫卫,郭洪旭,高 俊,郝 洁,黄 倩,唐成和
(1.新乡医学院第一附属医院新生儿科,河南 卫辉 453100;2.新乡医学院第三附属医院神经内科,河南 新乡 453003;3.新乡医学院第一附属医院超声科,河南 卫辉 453100;4.新乡医学院第一附属医院消化内科,河南 卫辉 453100;5.新乡医学院第一附属医院感染疾病科,河南 卫辉 453100;6.新乡医学院第一附属医院儿内科,河南 卫辉 453100)
缺氧、感染等多种致病因素均可引起早产儿脑病[1]。既往研究表明,早产儿脑病的主要危险因素为缺氧和产前感染等[2],感染后必然会发生氧化应激反应[3]。ω-6 多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)在临床中作为静脉营养脂肪乳剂使用非常广泛,但有研究表明,此类脂肪乳在感染应激状态下,可加重脂质过氧化反应,最终导致器官功能损害[4]。本课题组的前期研究结果表明,ω-3 PUFA能够降低急性肺损伤大鼠炎性因子分泌,减少细胞凋亡[5-6];也有研究发现,ω-3 PUFA可减少缺氧损伤大鼠脑组织中炎性因子表达,并降低细胞凋亡指数(apoptosis index,AI)[7-8]。因此作者推测,ω-3 PUFA可能会减轻早产儿感染所致脑损伤中的氧化应激反应,减少脑细胞凋亡,从而对脑组织具有保护作用。本研究使用3日龄新生大鼠模拟人类早产儿,通过注射脂多糖(lipopolysaccharide,LPS)制作感染所致脑损伤模型,观察ω-3 PUFA对 LPS所致脑损伤新生大鼠海马组织中氧化应激产物和细胞凋亡的影响,以期为临床治疗早产儿脑损伤提供依据。
1 材料与方法
1.1实验动物48只3日龄Sprague Dawley大鼠由新乡医学院实验动物中心提供,雌雄不限,体质量(18.2±4.3)g;新生大鼠和母鼠均置于25 ℃,湿度约60%的动物实验室内饲养,光照时间白天黑夜=12 h12 h;由母鼠喂养新生大鼠,避免过多打扰母鼠及新生大鼠;注意饲养环境的卫生,每天更换水和垫料1次;母鼠进食与孕期一致的普通饲料,保证营养均衡、卫生,以满足母鼠和新生大鼠的需求。
1.2主要试剂与仪器LPS(E.coliO111:B4)购自美国Sigma公司,超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA) 检测试剂盒购自南京建成生物工程研究所,还原型谷胱甘肽(reduced glutathion,GSH)、 氧化型谷胱甘肽(oxidized glutathione,GSSG)活性测定试剂盒购自美国 Cayman Chemical 公司,原位细胞凋亡检测试剂盒购自德国 Roche 公司;Olympus CX21FS1型普通光学显微镜购自日本 Olympus 公司,LKB-V2088型超薄切片机购自瑞典LKB公司。
1.3实验动物分组及处理方法将3日龄新生大鼠随机分为对照组、LPS组、ω-3 PUFA组和ω-6 PUFA组,每组12只;固定时间点称体质量并腹腔注射药物。对照组大鼠腹腔注射0.6 mL·kg-1生理盐水后,立即腹腔注射等容积生理盐水;LPS组、ω-3 PUFA组和ω-6 PUFA组大鼠腹腔注射0.6 mg·kg-1LPS后,分别立即腹腔注射等容积生理盐水、ω-3 PUFA和ω-6 PUFA[9]。24 h后腹腔注射水合氯醛麻醉各组大鼠,快速断头取海马组织,置于-80 ℃ 冰箱中保存备用。
1.4各组新生大鼠海马组织中SOD、MDA、GSH及GSSG水平检测取各组大鼠海马组织,用无菌生理盐水作为匀浆介质,按1 g10 mL在冰浴中充分匀浆制成 100 g·L-1组织匀浆,2 000 r·min-1离心 2 min,取上清液,采用黄嘌呤氧化酶法测定SOD水平,改良硫代巴比妥酸法检测MDA水平,分别采用GSH、GSSG活性测定试剂盒测定GSH和GSSG水平,并计算GSSG/GSH比值;具体操作严格按照说明书进行。
1.5末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(terminaldeoxynucleotidyltransferase-mediateddUTPnickendlabeling,TUNEL)法检测各组新生大鼠海马组织细胞凋亡情况取各组新生大鼠海马组织,石蜡包埋后切片,TUNEL法染色后常规进行脱蜡加水,滴加适量蛋白酶 K 工作液,37 ℃ 恒温箱孵育15 min,随后滴加标记缓冲液,37 ℃ 标记 2 h,封闭后滴加生物素化抗地高辛抗体,37 ℃恒温箱充分反应30 min,荧光显微镜下用蓝色光激发观察,蓝色荧光激发下,明亮的绿色代表TUNEL标记的阳性细胞核,提示存在细胞凋亡。在相同放大倍数(×200)、光强度下分析读片,每张切片取3个视野记录凋亡细胞数,并计算AI,AI=凋亡细胞数/细胞总数×100%。

2 结果
2.1各组新生大鼠海马组织中SOD、MDA、GSH、GSSG水平及GSSG/GSH比值比较结果见表1。与对照组比较,LPS组、ω-6 PUFA组和 ω-3 PUFA组新生大鼠海马组织中SOD和GSH水平显著降低,MDA、GSSG水平及GSSG/GSH比值显著升高,差异有统计学意义(P<0.05)。与LPS组比较,ω-6 PUFA组新生大鼠海马组织中SOD和GSH水平显著降低,MDA、GSSG水平及GSSG/GSH比值显著升高,差异有统计学意义(P<0.05);ω-3 PUFA 组新生大鼠海马组织中SOD和GSH水平显著升高,MDA、GSSG水平及GSSG/GSH比值显著降低,差异有统计学意义(P<0.05)。与ω-6 PUFA组比较,ω-3 PUFA组新生大鼠海马组织中SOD和GSH水平显著升高,MDA、GSSG水平及GSSG/GSH比值显著降低,差异有统计学意义(P<0.05)。
表1各组新生大鼠海马组织中SOD、MDA、GSH、GSSG水平及GSSG/GSH比值比较
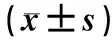
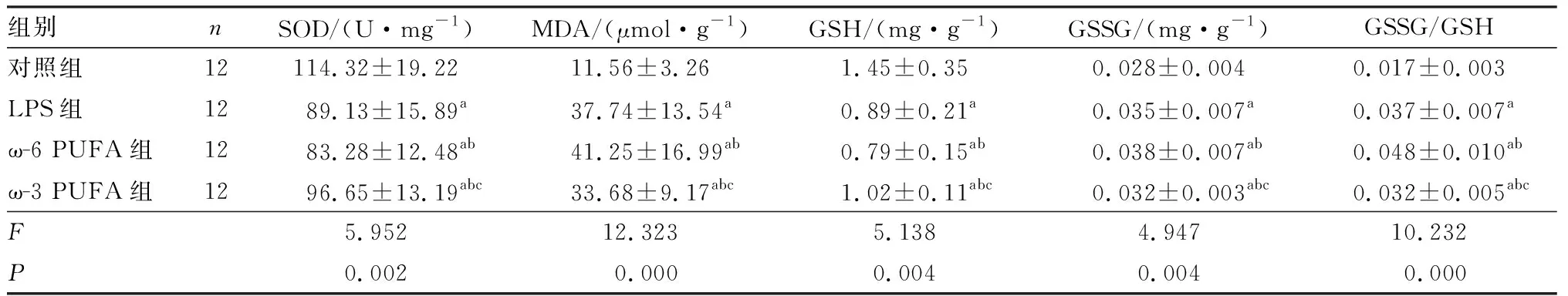
组别nSOD/(U·mg-1)MDA/(μmol·g-1)GSH/(mg·g-1)GSSG/(mg·g-1)GSSG/GSH对照组12114.32±19.2211.56±3.261.45±0.350.028±0.0040.017±0.003LPS组1289.13±15.89a37.74±13.54a0.89±0.21a0.035±0.007a0.037±0.007aω-6 PUFA组1283.28±12.48ab41.25±16.99ab0.79±0.15ab0.038±0.007ab0.048±0.010abω-3 PUFA组1296.65±13.19abc33.68±9.17abc1.02±0.11abc0.032±0.003abc0.032±0.005abcF5.95212.3235.1384.94710.232P0.0020.0000.0040.0040.000
注:与对照组比较aP<0.05;与LPS组比较bP<0.05;与 ω-6 PUFA组比较cP<0.05。
2.2各组新生大鼠海马组织AI比较结果见图1。对照组、LPS组、ω-6 PUFA组和 ω-3 PUFA组新生大鼠海马组织AI分别为(2.35±0.76)%、(2.87±1.14)%、(3.01±1.20)%、(2.77±0.89)%。LPS组、ω-6 PUFA 组和 ω-3 PUFA组新生大鼠海马组织AI显著高于对照组,差异有统计学意义(P<0.05);ω-6 PUFA组新生大鼠海马组织AI显著高于LPS 组,差异有统计学意义(P<0.05);ω-3 PUFA组新生大鼠海马组织AI显著低于ω-6 PUFA组和LPS 组,差异有统计学意义(P<0.05)。

A:对照组;B:LPS组;C:ω-6 PUFA 组;D:ω-3 PUFA。
图1TUNEL法检测各组新生大鼠海马组织细胞凋亡情况(×200)
Fig.1ApoptosisinhippocampusofneonatalratsineachgroupdetectedbyTUNEL(×200)
3 讨论
有研究表明,出生后 3~7 d啮齿类动物发育水平与人类孕23~36周早产儿的中枢神经系统发育水平接近[10]。动物实验表明,全身性 LPS 刺激可以导致小鼠脑损伤,在人类早产儿也有类似的情况出现[11]。采用3日龄新生大鼠腹腔内注射 LPS(0.6 mg·kg-1)可成功制作感染致脑损伤模型[12]。早产儿生后暴露于全身性感染可导致新生儿脑损伤[13-14]。炎症反应过程中产生大量的氧自由基也参与了脑损伤的形成[15]。在内毒素的激活下,巨噬细胞等免疫细胞生成过多的活性氧,可引起体内抗氧化能力下降,脂质过氧化反应增多,氧化还原平衡被打乱[16-17]。早产儿大脑发育不成熟,机体抗氧化能力有限,抗氧化酶活性相对偏低,因此,更容易出现氧化还原失衡[18-19]。SOD、GSH 是清除体内自由基的重要物质,SOD、GSH水平代表了体内抗氧化系统状态。MDA 是脂质过氧化的最终产物,由机体内PUFA在自由基作用下产生,可作为评估氧化损伤严重程度的间接指标[20-22]。GSH在氧化剂作用下通过谷胱甘肽过氧化物酶和谷胱甘肽转移酶被氧化成GSSG,GSSG/GSH比值可作为机体氧化/抗氧化系统是否失衡的间接评价指标。
ω-3 PUFA的主要成分是二十二碳六烯酸(docosahexaenoic acid,DHA)[23],DHA可直接透过血脑屏障进入脑细胞。研究表明,DHA 对新生大鼠缺氧缺血性损伤可发挥神经保护效应[24-25]。本研究结果发现,LPS组新生大鼠海马组织中SOD、GSH水平较对照组显著降低,MDA、GSSG水平GSSG/GSH比值较对照组显著升高,证明脑损伤新生大鼠海马组织中氧化应激反应增加;ω-3 PUFA组新生大鼠海马组织中SOD、GSH水平高于LPS组和ω-6 PUFA组,MDA、GSSG水平及GSSG/GSH比值低于LPS组和ω-6 PUFA组,使机体氧化还原系统失衡的程度降低,故可减少氧化应激产物对脑组织的损害;与LPS组比较,ω-6 PUFA组新生大鼠海马组织中SOD和GSH水平显著降低,MDA、GSSG、GSSG/GSH比值显著升高,提示ω-6 PUFA组新生大鼠体内氧化/抗氧化系统失衡较为严重。
中枢神经系统具有高氧耗、高代谢、抗氧化防御弱等特点,易受到活性氧作用而出现早期氧化应激反应,大量活性氧可导致机体氧化还原平衡紊乱,最终出现细胞凋亡。未发育成熟的大脑更容易受到氧化应激的损伤,细胞凋亡大量增加[24-25]。本研究结果发现,LPS组、ω-6 PUFA组和ω-3 PUFA组新生大鼠海马组织AI显著高于对照组;ω-3 PUFA组新生大鼠海马组织AI显著低于ω-6 PUFA组和LPS组;说明ω-3 PUFA可明显抑制海马组织细胞凋亡,且变化趋势与其降低氧化应激反应的趋势一致,提示 ω-3 PUFA可能通过降低氧化应激反应而减少细胞凋亡,具有神经保护作用。
综上所述,ω-3 PUFA可降低LPS所致脑损伤新生大鼠海马组织中氧化应激反应和细胞凋亡水平,但ω-3 PUFA是通过哪些信号通路调节氧化应激和细胞凋亡,尚需进一步探讨。
参考文献:
[1] VOLPE J J.Encephalopathy of prematurity includes neuronal abnormalities[J].Pediatrics,2005,116(1):221-225.
[2] VOLPE J J.Postnatal sepsis,necrotizing entercolitis,and the critical role of systemic inflammation in white matter injury in premature infants[J].JPediatr,2008,153(2):160-163.
[3] 许冰.从炎症反应和氧化应激探究麻醉剂影响老龄大鼠认知功能的分子机制[D].济南:山东大学,2016.
[4] HUSCHAK G,ZUR N K,HOELLl T,etal.Olive oil based nutrition in multiple trauma patients:a pilot study[J].IntensiveCareMed,2005,31(9):1202-1208.
[5] 石计朋,闫建国,韩金芬,等.ω-3 PUFAs、ω-6 PUFAs和ω-9 MUFAs对LPS诱导急性肺损伤大鼠血清IL-6及细胞凋亡的影响[J].中国儿童保健杂志,2014,22(3):271-274.
[6] 石计朋,闫建国,韩金芬,等.ω-3 PUFAs对LPS诱导急性肺损伤大鼠前炎症因子TNF-α、IL-1β、IL-6的影响[J].中国儿童保健杂志,2014,22(1):35-37,40.
[7] 宋亚辉,尤庆旺,王倩楠,等.Omega-3鱼油脂肪乳对缺氧缺血性脑损伤新生大鼠海马组织Toll样受体4和核因子κB的影响[J].中华实用儿科临床杂志,2016,31(12):923-926.
[8] 李艳艳.ω-3鱼油脂肪乳和亚低温对新生大鼠缺氧缺血脑损伤保护作用探讨[D].新乡:新乡医学院,2015.
[9] HAGBERG H,PEEBLES D,MALLARD C.Models of white matter injury:comparison of infectious,hypoxic-ischemic,and excitotoxic insults[J].MentRetardDevDisabilResRev,2002,8(1):30-38.
[10] MALLARD C,WAND X.Infection-induced vulnerability of perinatal brain injury[J].NeurolResInt,2012,2012:102153.
[11] DAMMANN O,LEVITON A.Inflammatory brain damage in preterm newborns:dry numbers,wet lab,and causal inferences[J].EarlyHumDev,2004,79(1):1-15.
[12] 徐发林,庄方莉,白琼丹,等.细菌脂多糖对不同成熟度新生小鼠脑发育的影响[J].实用儿科临床杂志,2012,27(8):611-613,616.
[13] STOLL B J,HANSEN N I,ADAMS-CHAPMAN I,etal.Neurodevelopmental and growth impairment among extremely low-birth-weight infants with neonatal infection[J].JAMA,2004,292(19):2357-2365.
[14] FAN L W,TIEN L T,ZHENG B,etal.Dopaminergic neuronal injury in the adult rat brain foowing neonatal exposure to lipopolysaccharide and the silent neurotoxicity[J].BrainBehavImmun,2011,25(2):286-297.
[15] VOLPE J J.Brain injury in premature infants:a complex amalgam of destructive and developmental disturbances[J].LancetNeurol,2009,8(1):110-124.
[16] DAL-PIZZOL F,RITTER C,CASSOL-JR O J,etal.Oxidative mechanisms of brain dysfunction during sepsis[J].NeurochemRes,2010,35(1):1-12.
[17] 李兰根,伟伟,张玉凤,等.信号转导/转录激活因子3抗ARPE-19细胞氧化应激研究[J].眼科新进展,2016,36(11):1020-1023.
[18] BLOMGREN K,HAGBERG H.Free radicals,mitochondria,and hypoxia-ischemia in the developing brain[J].FreeRadicBiolMed,2006,40(3):388-397.
[19] 栗志勇,张慧,张婷,等.丹皮酚对急性心肌梗死大鼠氧化应激和内皮型一氧化氮合酶信号通路的影响[J].新乡医学院学报,2017,34(5):356-360.
[20] 郭俊国,赵晴,王兴荣,等.六锐胶囊对葡萄膜炎大鼠血清SOD、MDA和NT-3含量的影响[J].眼科新进展,2016,36(4):334-335,344.
[21] 陈莹恩,杨秀丽,赵奕霖,等.辛伐他汀对慢性心力衰竭幼兔心肌凋亡及氧化应激机制的影响[J].中华实用儿科临床杂志,2017,32(13):1022-1025.
[22] 董志军,陈志宏,李玲娜,等.丝胶对糖尿病大鼠视网膜氧化应激和微炎症状态的改善作用[J].眼科新进展,2018,38(3):218-221.
[23] 齐可民,樊超男.n-3多不饱和脂肪酸与儿童生长发育和健康[J].中华实用儿科临床杂志,2016,31(23):1761-1765.
[24] 张雯婷.OMEGA-3多不饱和脂肪酸在新生大鼠脑缺血缺氧损伤中的作用及机制研究[D].上海:复旦大学,2010.
[25] BERMAN D R,MOZURKEWICH E,LIU Y,etal.Docosahexaenoic acid augments hypothermic neuroprotection in a neonatal rat asphyxia model[J].Neonatology,2013,104(1):71-78.

