高效液相色谱荧光法检测血浆中硫醇物的方法学研究
班艳娜,甄乾娜,傅惠佳
(1.重庆医科大学附属第一医院生殖健康与不孕症专科,重庆 400016;2.重庆医科大学附属第一医院内分泌科,重庆 400016)
生物硫醇物如同型半胱氨酸(homocysteine,Hcy)、谷胱甘肽(glutathione,GSH)、半胱氨酸(cysteine,Cys) 和半胱氨酸甘氨酸(cysteinylglycine,CysGly)等广泛分布于人体内的细胞和血浆中,可通过氧化还原反应在硫化物的生物转换中发挥重要作用。研究发现,尿毒症患者心血管疾病发病率比健康人高10~20倍[1],游离型硫醇物和还原型硫醇物浓度升高是尿毒症患者的主要危险因素[2-3]。BALD等[4]建立了反相高效液相色谱(high performance liquid chromatography,HPLC)法检测血浆中硫醇物水平,该方法以硼氢化钠为还原剂,用2-氯-1-甲基喹啉四氟化-2-氯-1-甲基喹啉衍生后进行检测,缺点是衍生条件复杂、流动相操作繁琐。SJOBERG等[5]以7-呋喃-4-磺酸铵盐(7-fuorobenzofurazan-4-sulfonic acid ammonium salt,SBD-F)为衍生剂建立了HPLC荧光检测法,该方法可同时测定GSH、Cys、Hcy、CysGly等氨基硫醇物,缺点是衍生时间较长,且衍生温度较高,不便于临床标本的检测。故本研究拟建立一种新型快速的、可同时测血浆中Hcy、Cys和CysGly的总量及其游离型、还原型浓度的HPLC荧光法,现将结果报道如下。
1 材料与方法
1.1主要试剂与仪器Hcy、Cys、CysGly、GSH、N-1-苯基-马来酰亚胺[N-(1-pyrenyl)maleimide,NPM]、三羧基乙基膦[tris-(2-carboxylethyl)-phosphine,TCEP]购自美国Sigma公司,乙腈、甲醇(色谱纯)购自美国TEDIA公司,醋酸钠、醋酸、磷酸等其他试剂均为国产分析纯,实验用水为Millipore净化装置(美国Millipore公司)纯化所得;HPLC系统(购自美国安捷伦公司)由液相系统、真空脱气系统(g1322a)、四元泵(g1311a)、手动进样器(g1328)和荧光检测器(g1321a)组成,数据采集和处理采用安捷伦化学工作站,HIMAC-cf15低温台式离心机(日立工机株式会社)。
1.2方法
1.2.1试剂配置用磷酸盐缓冲液(25 mmol·L-1,pH 7.4)配置标准混合溶液,GSH、Cys、Hcy、CysGly浓度分别为12、250、10、30 mmol·L-1,分装后于-20 ℃下保存备用。工作溶液用体积分数70%乙腈稀释备用。称取120 mg TCEP 溶于1 mL磷酸盐缓冲液配制成质量浓度为100 g·L-1的溶液,置于4 ℃保存。取7.4 mg NPM溶于25 mL乙腈中,其浓度为1 mmol·L-1,于4 ℃下保存备用。混合血浆是取5份正常人血浆作为基质备用。
1.2.2色谱条件采用HypersilC18色谱柱(250.0 mm×4.0 mm,5 μm)和安捷伦Hypersil ODS 预柱 (4 mm×4 mm,5 μm),柱温25 ℃;采用程序可变荧光检测器确定最佳发射波长和最佳激发波长,检测流速:0.5 mL·min-1,流动相A:15 mmol·L-1醋酸钠水溶液,流动相B:在300 mL水中加入1 mL乙酸和 1 mL 磷酸,流动相C:乙腈。梯度洗脱程序为:0.0~1.0 min,B和C体积分数分别为30%和70%;1.0~12.5 min,A、B、C体积分数分别为15%、15%和70%,进样量20 μL,检测时间13 min。
1.2.3标本预处理硫醇物总量测定:取血浆样品90 μL,加入10 μL TCEP (10 g·L-1)进行还原,(37.0 ± 0.3) ℃水浴10 min;在还原后的溶液中缓慢加入400 μL衍生剂NPM (1 mmol·L-1)溶液,同时漩涡振荡混匀,室温衍生15 min后加入10 μL体积分数30%乙酸,然后于4 ℃ 下13 000×g离心 10 min,取上清液20 μL进样测定硫醇物总量。游离型硫醇物测定:采用Millipore YM-30 离心超滤管,2 000×g离心 20 min 获取超滤液。取超滤液 90 μL,加入10 μL TCEP(1 g·L-1)进行还原,(37.0±0.3) ℃水浴10 min;然后再缓慢加入400 μL NPM(100 μmol·L-1)进行衍生,漩涡振荡混匀,室温衍生15 min后于4 ℃下 13 000×g离心10 min,取20 μL上清液进样测定游离型硫醇物。还原型硫醇物测定:取超滤液100 μL直接加入400 μL NPM(50 μmol·L-1),漩涡振荡混匀,室温衍生15 min后于4 ℃下 13 000×g离心10 min,取20 μL上清液进样测定还原型硫醇物。
1.2.4标准曲线制备和检测限配置系列标准溶液,再将10 μL标准溶液加入到90 μL混合血浆中,混合物浓度的测定按“1.2.3标本预处理”进行。以不同浓度的工作液加入到基质中后测得的峰面积减去基质的峰面积为纵坐标(y),不同浓度的工作液为横坐标(x)进行线性回归,得到总量和游离型硫醇物标准曲线。还原型硫醇物用标准溶液稀释成6个浓度,还原型Hcy浓度梯度为0.005、0.050、0.100、1.000、2.000和4.000 mmol·L-1;还原型GSH浓度梯度为0.1、0.5、2.0、4.0、8.0和 10.0 mmol·L-1;还原型Cys浓度梯度为1.5、5.0、10.0、20.0、30.0和50.0 mmol·L-1;还原型CysGly浓度梯度为0.2、1.0、3.0、6.0、12.0和30.0 mmol·L-1。以峰面积为纵坐标(y),硫醇物的浓度为横坐标(x)绘制标准曲线。以3倍信噪比S/N=3时样品浓度为最低检测限。
1.2.5精密度试验日内精密度试验是在1 d内连续测定5次同一混合血浆Hcy、GSH、Cys、CysGly总量及其还原型和游离型浓度,计算5份样本中4种硫醇物的浓度变异。日间精密度试验是连续5 d测定同一混合血浆中Hcy、GSH、Cys、CysGly总量及其还原型和游离型浓度,计算5份样本中这4种硫醇物的浓度变异。
1.2.6加样回收率试验取90 μL混合血浆,加入10 μL不同浓度的Hcy、GSH、Cys、CysGly标准溶液,测定加入标准溶液前后血浆硫醇物浓度。相对回收率=(血浆标准溶液浓度-未加标准液血浆浓度)/加入标准液浓度×100%。
1.2.7实例应用选择2015年10~11月在重庆医科大学附属第一医院血液透析中心进行血液透析的尿毒症患者34例,其中男17例,女17例,年龄34~75(58.7±12.8)岁。选择同期健康体检者32例,其中男16例,女16例,年龄36~69(55.5±10.3)岁。采集所有受试者清晨空腹静脉血,置于乙二胺四乙酸二钾真空管内,立即置于冰上,1 h内3 000×g离心10 min分离血浆,分成2份,一份用于测定硫醇物总量,置于-20 ℃冰箱保存;另一份置于Millipore YM-30离心超虑管中2 000×g离心 20 min,用于测定游离型和还原型硫醇物。游离型与还原型硫醇物应立即衍生,并在 24 h 内测定。

2 结果
2.1波长的选择通过Agilent LC-1100色谱化学工作站对NPM-GSH、NPM-Cys、NPM-Hcy和NPM-CysGly衍生物进行荧光光谱扫描,结果显示,GSH、Cys、Hcy、CysGly最佳发射波长为380 nm;GSH的最佳激发波长为230 nm,其余3种硫醇物的最佳激发波长均为330 nm。综合考虑选择激发波长330 nm和发射波长380 nm作为检测波长。
2.2色谱图在本研究色谱条件下血浆中4种硫醇物之间能达到与基线分离,与内源性化合物及TCEP、NPM反应的峰分离良好,无干扰峰;见图1。
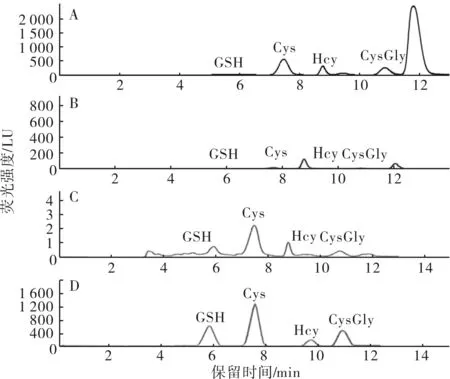
A:总的硫醇物;B:游离型硫醇物;C:还原型硫醇物;D:硫醇物标准品混合溶液。
图1硫醇物的色谱图
图1Chromatogramfortheaminothiols
2.3标准曲线和检测限结果见表1。总量及游离型和还原型GSH、Cys、Hcy、CysGly的线性回归方程相关系数均>0.99。GSH、Cys、Hcy及CysGly总量最低检测限分别是1.0、3.0、0.5、1.5 μmol·L-1,还原型GSH、Cys、Hcy、CysGly最低检测限分别是0.050、1.000、0.005、0.020 μmol·L-1。
表1GSH、Gys、Hcy、CysGly总量及其游离型和还原型浓度检测的标准曲线和最低检测限
Tab.1Standardcurvesandminimumdetectionlimitsoftotal,freeandreducedGSH,Cys,HcyandCysGly
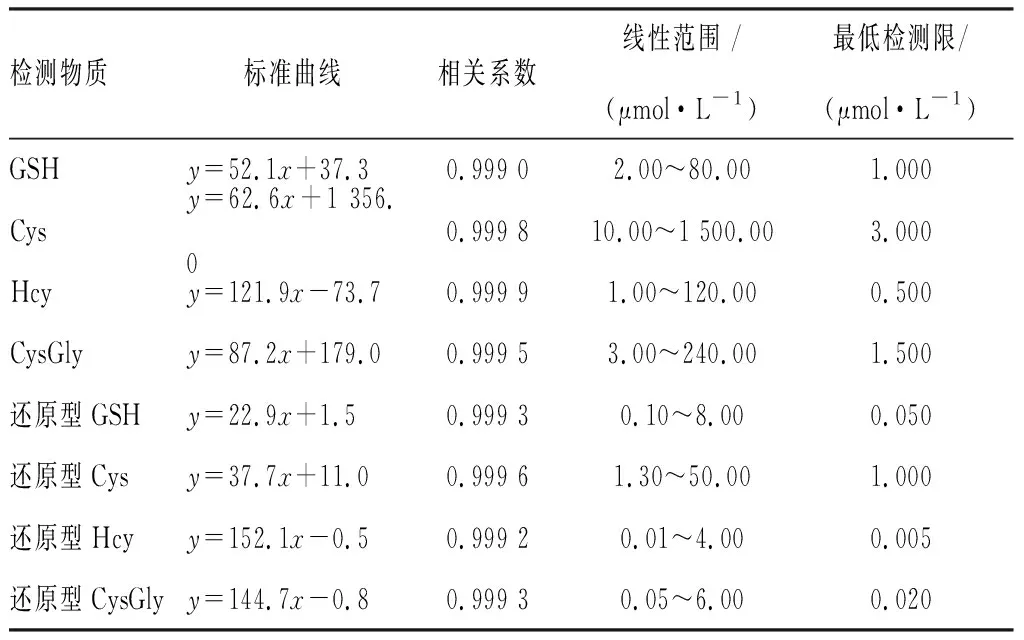
检测物质标准曲线相关系数线性范围 /(μmol·L-1)最低检测限/(μmol·L-1)GSHy=52.1x+37.30.999 02.00~80.001.000Cysy=62.6x+1 356.00.999 810.00~1 500.003.000Hcyy=121.9x-73.70.999 91.00~120.000.500CysGlyy=87.2x+179.00.999 53.00~240.001.500还原型GSHy=22.9x+1.50.999 30.10~8.000.050还原型Cysy=37.7x+11.00.999 61.30~50.001.000还原型Hcyy=152.1x-0.50.999 20.01~4.000.005还原型CysGlyy=144.7x-0.80.999 30.05~6.000.020
2.4精密度和回收率结果见表2。测得样本回收率在80.1%~111.7%。日内精密度相对标准偏差(ralative standard deviation,RSD)均小于5%,日间精密度RSD均小于10%。
表2GSH、Cys、Hcy和CysGly的回收试验和精密度
Tab.2RecoveriesandprecisionofGSH,Cys,HcyandCysGlyinplasma
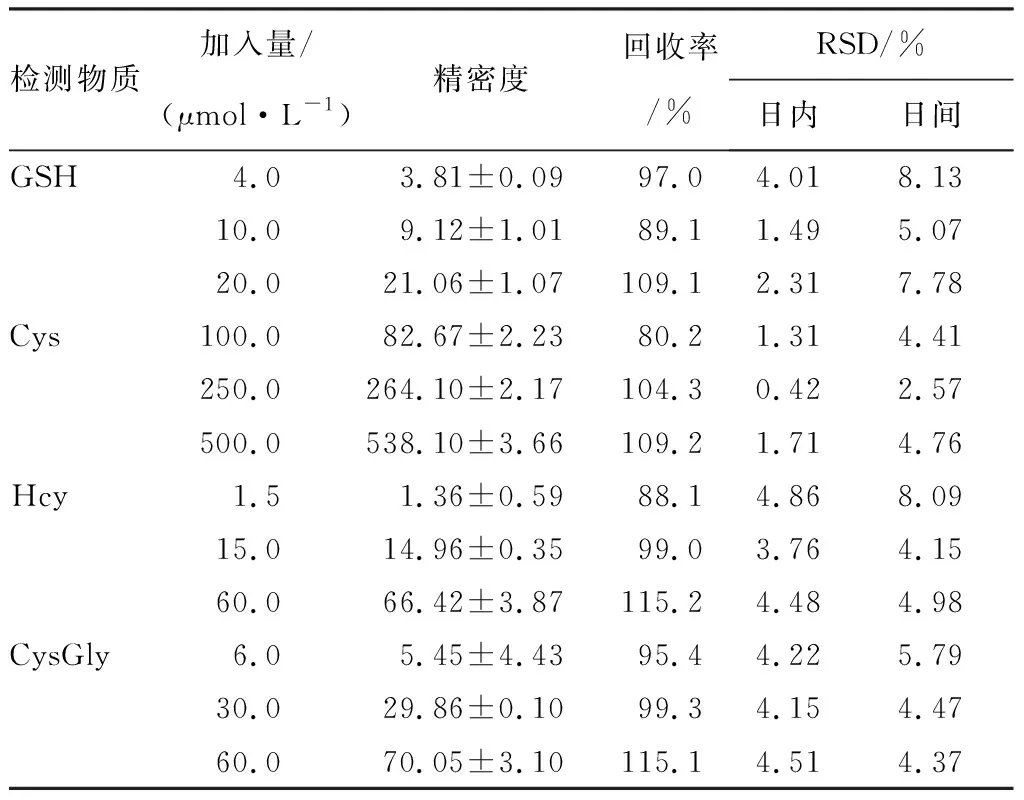
检测物质加入量/(μmol·L-1)精密度回收率/%RSD/%日内日间GSH4.03.81±0.0997.04.018.1310.09.12±1.0189.11.495.0720.021.06±1.07109.12.317.78Cys100.082.67±2.2380.21.314.41250.0264.10±2.17104.30.422.57500.0538.10±3.66109.21.714.76Hcy1.51.36±0.5988.14.868.0915.014.96±0.3599.03.764.1560.066.42±3.87115.24.484.98CysGly6.05.45±4.4395.44.225.7930.029.86±0.1099.34.154.4760.070.05±3.10115.14.514.37
2.5临床应用结果见表3。该方法成功应用于34例尿毒症患者和32例健康人血浆中GSH、Cys、Hcy和CysGly的总量及其游离型和还原型浓度的测定。
表3尿毒症患者和健康人血浆中GSH、Cys、Hcy和CysGly总量、还原型和游离型的浓度
Tab.3Thetotal,freeandreducedconcentrationsofGSH,Cys,HcyandCysGlyinplasmaofurimicpatientsandheathypeople
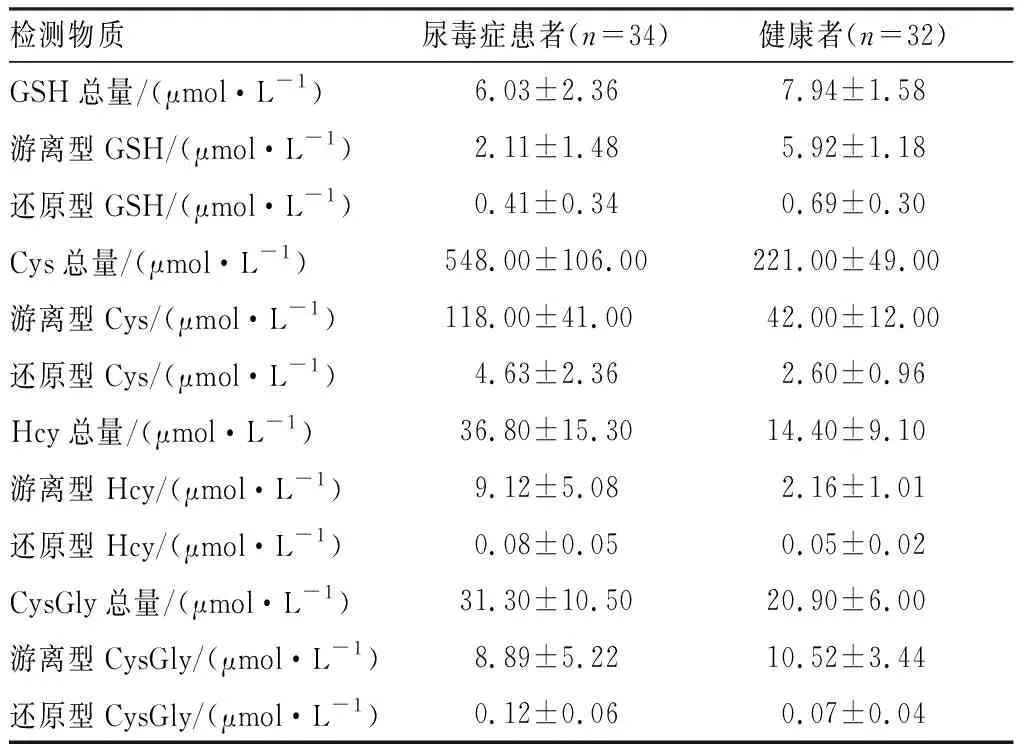
检测物质尿毒症患者(n=34)健康者(n=32)GSH总量/(μmol·L-1)6.03±2.367.94±1.58游离型GSH/(μmol·L-1)2.11±1.485.92±1.18还原型GSH/(μmol·L-1)0.41±0.340.69±0.30Cys总量/(μmol·L-1)548.00±106.00221.00±49.00游离型Cys/(μmol·L-1)118.00±41.0042.00±12.00还原型Cys/(μmol·L-1)4.63±2.362.60±0.96Hcy总量/(μmol·L-1)36.80±15.3014.40±9.10游离型Hcy/(μmol·L-1)9.12±5.082.16±1.01还原型Hcy/(μmol·L-1)0.08±0.050.05±0.02CysGly总量/(μmol·L-1)31.30±10.5020.90±6.00游离型CysGly/(μmol·L-1)8.89±5.2210.52±3.44还原型CysGly/(μmol·L-1)0.12±0.060.07±0.04
3 讨论
Hcy是蛋氨酸代谢的中间产物,是导致心血管疾病的危险因子,GSH、Cys、Hcy和CysGly是细胞还原能力的来源,在机体的生物代谢中起着重要的作用。当细胞功能受损时,GSH、Cys、Hcy和CysGly代谢会发生紊乱,生物体液中浓度会显著改变,同时检测这些硫醇物总的血浆浓度对疾病诊断、治疗以及评估机体的氧化还原状况具有重要意义[3-5]。
目前,测定血浆硫醇物的常见方法主要是HPLC[6-10],其中柱前衍生HPLC荧光检测是检测血浆中GSH、Cys、Hcy及CysGly总量最常用的方法。NOLIN等[8]以SBD-F为衍生剂同时测定了GSH、Cys、Hcy和CysGly的总量,其缺点是样品预处理方法复杂,衍生时间为1 h,温度60 ℃,不便于临床标本的检测。BENKOVA等[9]合成了一种新的衍生剂,仅用于测定血浆中GSH、Cys和Hcy的总量,该方法简单、快速、灵敏度高,最低检测限达1.2 pmol·L-1,但是色谱分离时易受大量的荧光杂质干扰。FERIN等[10]采用HPLC法同时测定了血浆中GSH、Cys、Hcy、CysGly的总量,该方法灵敏度高,最低检测限为0.01 μmol·L-1,但是衍生温度高达60 ℃,不宜临床常规检测。由于目前常用的检测硫醇物方法衍生条件均存在衍生温度高、时间长以及未能同时满足总量、游离型和还原型硫醇物的精确定量等缺陷,本研究采用HPLC荧光检测,以NPM为衍生剂,TCEP为还原剂,建立了一种简单测定血浆中各种硫醇物的总量、游离型和还原型浓度的方法。
血浆硫醇物大多以蛋白复合物形式存在,所以测定血浆中各种形式的硫醇物需在样品衍生前进行还原处理。TCEP作为还原剂,具有稳定、能溶于水、受反应时间、温度和浓度影响小等优点,较采用其他还原剂重复性好,在4 ℃可稳定1周[11],更适合临床常规分析。NPM是巯基的特异性衍生剂,衍生反应在常温10 min内即可完成,产生的荧光效率高且稳定,色谱图背景干净,色谱峰形良好,是一种理想的硫醇物荧光衍生剂[12]。该方法衍生条件简单、快速,灵敏度高,最低检测限达0.005 μmol·L-1,并成功运用于尿毒症患者透析前及健康人血浆中硫醇物的检测。
综上所述,本研究将NPM作为衍生剂,利用HPLC-荧光法,建立了一种新的可同时测定血浆中GSH、Cys、Hcy和CysGly的总量及其还原型和游离型浓度的方法。该方法具有衍生条件简单、衍生后灵敏度高的特点,并成功应用于尿毒症患者和健康人血浆中硫醇物浓度的快速测定。
参考文献:
[1] YEH J K,CHEN C C,HSIEH M J,etal.Impact of homocysteine level on long-term cardiovascular outcomes in patients after coronary artery stenting[J].JAtherosclerThromb,2017,24(7):696-705.
[2] AUSTEN S K,COOMBES J S,FASSETT R G.Homocysteine and cardiovascular disease in renal disease[J].Nephrology,2003,8(6):285-295.
[3] PRZEMYSLAW W,PIOTR K,GRAZYNA C,etal.Total,free,and protein-bound thiols in plasma of peritoneal dialysis and predialysis patients[J].IntUrolNephrol,2011,43(4):1201-1209.
[4] BALD E,CHWATKO G,GLOWACKI R,etal.Analysis of plasma thiols by high-performance liquid chromatography with ultraviolet detection[J].JChromatogrA,2004,1032(1/2):109-115.
[5] SJOBERG B,ANDERSTAM B,SULIMAN M,etal.Plasma reduced homocysteine and other aminothiol concentrations in patients with CKD[J].AmJKidneyDis,2006,47(1):60-71.
[6] 杨涛,沈高.高效液相荧光法同时测定人血浆中4种硫醇物的浓度[J].复旦学报(医学版),2014,41(5):679-684.
[7] JUAN G E,MARIA M B,ELISA B G,etal.Determination of reduced homocysteine in human serum by elemental labelling and liquid chromatography with ICP-MS and ESI-MS detection[J].AnalBioanalChem,2015,407(26):7899-7906.
[8] NOLIN T D,MCMENAMIN M E,HIMMELFARB J.Simultaneous determination of total homocysteine,cysteine,cysteinylglycine,and glutathione in human plasma by high-performance liquid chromatography:application to studies of oxidative stress[J].JChromatogrBAnalytTechnolBiomedLifeSci,2007,852(1/2):554-561.
[9] BENKOVA B,LOZANAV V,IVANOV I P,etal.Determination of plasma aminothiols by high performance liquid chromatography after precolumn derivatization with with N-(2-acridonyl)maleimide[J].JChromatogrBAnalytTechnolBiomedLifeSci,2008,870(1):103-108.
[10] FERIN R,PAVAO M L,BAPTISTA J.Methodology for a rapid and simultaneous determination of total cysteine,homocysteine,cysteinylglycine and glutathione in plasma by isocratic RP-HPLC[J].JChromatogrBAnalytTechnolBiomedLifeSci,2012,911:15-20.
[11] PASTORE A,MASSOUD R,MOTTI C,etal.Fully automated assay for total homocysteine,cysteine,cysteinylglycine,glutathione,cysteamine,and 2-mercaptopropionylglycine in plasma and urine[J].ClinChem,1998,44(4):825-832.
[12] RUAN Q,CHEN Y,KONG X,etal.Comparative studies on sulfhydryl determination of soy protein using two aromatic disulfide reagents and two fluorescent reagents[J].JAgricFoodChem,2013,61(11):2661-2668.
[13] NERBASS F B,DRAIBE S A,FEITEN S F,etal.Homocysleine and its determinants in nondialyzed chronic kidney disease patients[J].JAmDietAssoc,2006,106(2):207-270.

