抑癌基因PTEN单核苷酸多态性与鼻咽癌的相关性
杨琳红,王维峰,朱金玲,张淑红,范宗宪,佟琳琰,孙海燕,韩 琳
(1.佳木斯大学附属第一医院耳鼻咽喉科,黑龙江 佳木斯 154000;2.佳木斯大学附属第一医院神经外科,黑龙江 佳木斯 154000;3.佳木斯大学遗传学教研室,黑龙江 佳木斯 154000;4.中国人民解放军第二二四医院五官科,黑龙江 佳木斯 154000)
鼻咽癌是我国高发肿瘤之一,其发病原因包括病毒感染、化学致癌物质及遗传易感因素等。目前认为,鼻咽癌是一种多基因遗传病,涉及多个基因之间及基因与环境之间的交互作用。已有研究表明,与鼻咽癌有关的基因变异影响着其易感性[1]。人类基因多态性在某些疾病中发挥着重要作用,单核苷酸多态性(single nucleotide polymorphisms,SNP)是人类可遗传的变异中最常见的一种,是近年来肿瘤研究热点之一。抑癌基因PTEN异常与鼻咽癌有关[2-3],PTEN是一种具有磷酸酶活性的抑癌基因,能够通过促进细胞周期或加速细胞凋亡参与细胞生长调节,在肿瘤细胞浸润、血管形成及肿瘤转移过程中起一定抑制作用,与肿瘤的发生、发展有着密切的关系[4-6]。目前,有关PTEN 基因SNP与鼻咽癌发生和发展的研究较少。本研究采用限制性片段长度多态性分析(polymerase chain reaction-restriction fragment length polymorphisms,PCR-RFLP)技术和DNA测序法检测佳木斯地区汉族鼻咽癌患者和健康者的PTEN基因rs532678和rs701848位点的基因型和等位基因频率,探讨PTEN 基因SNP与鼻咽癌易感性的关系,为鼻咽癌的预防、诊断和治疗提供可能的分子基础。
1 资料与方法
1.1一般资料选择2008年9月至2018年1月佳木斯大学第一附属医院耳鼻咽喉科收治的汉族鼻咽癌患者132例(鼻咽癌组),男78例,年龄45~81(59.71±7.16)岁;女54例,年龄23~89(56.72±13.00)岁。所有鼻咽癌患者经病理组织切片首次确诊为鼻咽低分化鳞癌,且未接受任何治疗。另选择同期体检健康者73例作为对照组,其中男40例,年龄42~90(66.28±12.72)岁;女33例,年龄43~82(61.70±9.96)岁,2组受试者的年龄及性别构成比较差异无统计学意义(P>0.05),具有可比性。收集2组受试者晨起空腹静脉血样3.0 mL,乙二胺四乙酸抗凝,-20 ℃保存,待提取DNA。本研究通过医院医学伦理委员会批准,所有受试者签订知情同意书。
1.2主要试剂与仪器全血基因组提取试剂盒(美国Thermo Fisher Scientific公司),Taq DNA聚合酶、内切酶BpiⅠ、内切酶HaeⅢ(宝生物工程大连有限公司),Power Taq PCR Master Mix(上海申能博彩生物有限公司);电泳仪(北京六一仪器厂),凝胶成像分析系统(上海培清科技有限公司),GLISON微量加样器(美国Glison公司)。
1.3研究方法
1.3.1SNP位点选择利用NCBI Gene数据库检索PTEN基因。进入HapMap网站(http://www.hapmap.org),选择中文模式,HapMap 数据下选择通用基因组浏览器,查询、下载并保存dumped_region.hmp。运行Haploview,选择TagSNPs,相关的参数设为等位基因频率最小频率为0.2、连锁不平衡的阈值(r2)大于0.8,根据有无合适酶切位点,选择PTEN的TagSNP为rs532678和rs701848。
1.3.2SNP位点的引物设计在dbSNP数据库中查得rs532678和rs701848位点的核酸序列,用Primer 5.0软件设计引物,用Oligo 6.0软件进行检验,引物由生工生物工程(上海)股份有限公司合成。rs532678的正向引物序列为5′-CAAGAAAACCAGTCCAAGTGTGAAGA-3′,反向引物序列为5′-AGGGGCAACAAGAAGCAAACAT-3′,扩增片段长度为220 bp;rs701848的正向引物序列为5′-GAAT-CGTTTCTACATAGTGCT-3′,反向引物序列为5′-AAGTCCAGCACCAGTAAGTTA-3′,扩增片段长度为303 bp。
1.3.3基因组DNA提取利用BioTeKe全血基因组提取试剂盒提取静脉血样的DNA,按试剂说明书操作,提取的DNA置于-20 ℃冰箱保存,备用。
1.3.4PCR扩增PCR反应体系为15 μL,包括 2×Power Taq PCR Master Mix 8μL、正向引物1 μL、反向引物1 μL、模板DNA 1 μL,加ddH2O至15 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃终末延伸5 min。琼脂糖凝胶电泳检测PCR产物大小及特异性。
1.3.5限制性酶切rs532678位点的内切酶为BpiⅠ,rs701848位点的内切酶为HaeⅢ。酶切反应体系为:PCR产物5 μL、10×buffer 1 μL、BpiⅠ酶 0.5 μL、ddH2O 8.5 μL,总体积为15 μL。酶切反应体系配好振荡混匀后,放置于37 ℃水浴箱中酶切3 h,65 ℃ 水浴8 min终止酶切。
1.3.6酶切产物琼脂糖凝胶电泳分型15 μL酶切产物电泳分型:20 g·L-1琼脂糖凝胶,电压 150 V,电泳40 min,紫外线凝胶成像分析系统拍照并进行基因分型。rs532678位点发生C-T突变则产生BpiⅠ酶切位点,酶切后CC基因型长度为 220 bp,TT基因型为长度199、21 bp 2个片段,CT基因型为长度220、199、21 bp 3个片段。rs701848位点发生C-T突变后产生1个HaeⅢ酶切位点,酶切后CC基因型长度为303 bp,TT基因型为长度280、23 bp 2个片段,CT基因型为长度303、280、23 bp 3个片段。凝胶电泳过程中,由于21、23 bp的片段太短,电泳过程中无法观察到该片段。电泳结果由3人独立判读,对判读结果不一致者进行重复实验。
1.4统计学处理采用Hardy-Weinberg遗传平衡验证2组受试者是否为平衡群体,P>0.05说明该群体为平衡群体。应用SPSS 24.0软件统计基因型频率和等位基因频率,2组受试者基因型频率及等位基因频率比较采用χ2检验,采用相对危险度的估计值比值比(odds ratio,OR)和 95%可信区间(confidence interval,CI)估计多态位点与鼻咽癌的联系强度,P<0.05为差异有统计学意义。
2 结果
2.1Hardy-Weinberg遗传平衡检验结果见表1。2组受试者rs532678和rs701848位点的基因型及等位基因频率分布均符合Hardy-Weinberg 遗传平衡定律(P>0.05),证实2组受试者均为遗传平衡群体。
表12组受试者PTEN基因rs532678和rs701848位点的基因型及等位基因频率分布Hardy-Weinberg遗传平衡检验
Tab.1Hardy-Weinberggeneticequilibriumtestofgenotypeandallelefrequencydistributionatrs532678andrs701848lociofPTENgeneinthetwogroups

组别nrs532678位点CC/例CT/例TT/例χ2Prs701848位点CC/例CT/例TT/例χ2P对照组73 预期数472330.528>0.05502122.088>0.05 观察数4625248250鼻咽癌组132 预期数953430.461>0.056058142.522>0.05 观察数95352566610
2.2PTEN基因rs532678和rs701848位点基因型分析结果见图1和图2。rs532678位点扩增目的片段大小为220 bp,经酶切后有3种基因型,CC基因型仅有220 bp 1条带(泳道3);TT基因型出现199、21 bp 2条带(泳道4),CT基因型出现220、199和21 bp 3条带(泳道1、2)。rs701848位点扩增目的片段大小为303 bp,经酶切后出现3种基因型,CC基因型仅有303 bp 1条带(泳道1、2),TT基因型出现280、23 bp 2条带(泳道4),CT基因型出现303、280和23 bp 3条带(泳道3)。
2.32组受试者PTEN基因rs532678和rs701848位点基因型及等位基因频率分布比较结果见表2和表3。2组受试者PTEN基因rs532678位点的基因型和等位基因频率分布比较差异均无统计学意义(P>0.05)。2组受试者PTEN基因rs701848位点的基因型和等位基因频率分布比较差异有统计学意义(P<0.05);鼻咽癌组rs701848位点CT、TT基因型频率和T等位基因频率显著高于对照组(P<0.05),CC基因型频率和C等位基因频率显著低于对照组(P<0.05)。

M:DNA Marker;1、2:突变杂合子CT;3:野生型纯合子CC;4:突变纯合子TT。
图1PTEN基因rs532678位点电泳结果
Fig.1Electrophoreticresultsofrs532678locusofPTENgene

M:DNA Marker;1、2:野生型纯合子CC;3:突变杂合子CT;4:突变纯合子TT。
图2PTEN基因rs701848位点电泳结果
Fig.2Electrophoreticresultsofrs701848locusofPTENgene
表22组受试者rs532678位点基因型及等位基因频率分布比较
Tab.2Comparisonofgenotypeandallelefrequenciesofrs532678locusbetweenthetwogroups
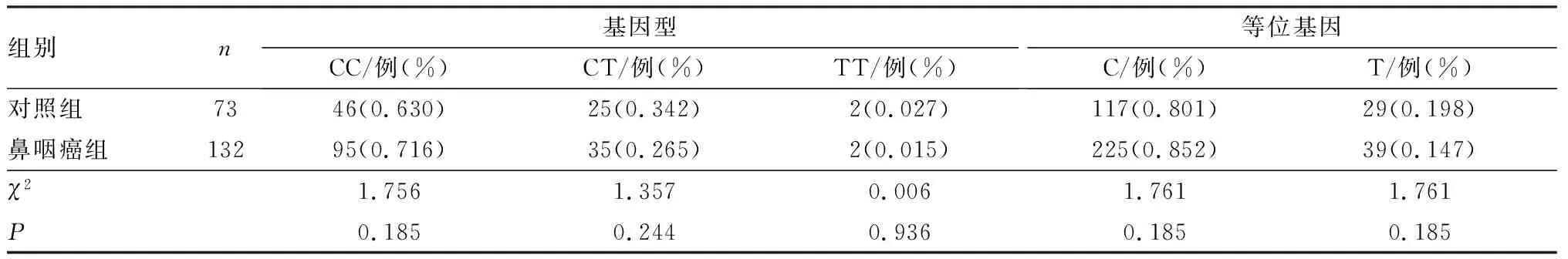
组别n基因型CC/例(%)CT/例(%)TT/例(%)等位基因C/例(%)T/例(%)对照组7346(0.630)25(0.342)2(0.027)117(0.801)29(0.198)鼻咽癌组13295(0.716)35(0.265)2(0.015)225(0.852)39(0.147)χ21.7561.3570.0061.7611.761P0.1850.2440.9360.1850.185
表32组受试者rs701848位点基因型及等位基因频率分布比较
Tab.3Comparisonofgenotypeandallelefrequenciesofrs701848locusbetweenthetwogroups

组别n基因型CC/例(%)CT/例(%)TT/例(%)等位基因C/例(%)T/例(%)对照组7348(0.657)25(0.342)0(0.000)121(0.828)25(0.171)鼻咽癌组13256(0.424)66(0.500)10(0.075)178(0.674)86(0.325)χ210.2354.7264.29611.36911.369P0.0010.0300.0380.0010.001
2.4PTEN基因rs701848位点基因型与鼻咽癌发病风险的关系结果见表4。PTEN基因rs701848位点CT+TT基因型个体罹患鼻咽癌的风险较高(P<0.05,OR=2.606,95%CI下限为1.439,上限为4.720)。携带CT+TT基因型个体的鼻咽癌发病风险是携带CC型个体的2.606倍。
表4PTEN基因rs701848位点基因型与鼻咽癌发病风险估计
Tab.4Estimationofthegenotypeatrs701848locusandonsetriskofnasopharyngealcarcinoma
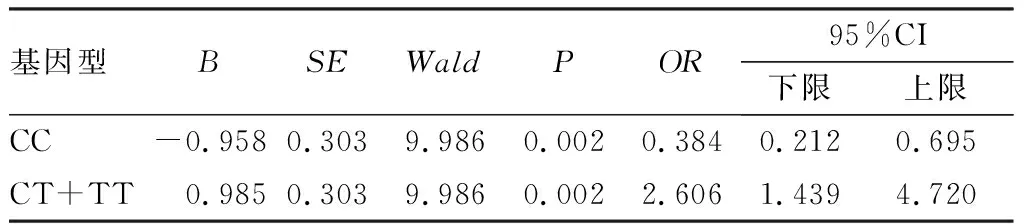
基因型BSEWaldPOR95%CI下限上限CC-0.9580.3039.9860.0020.3840.2120.695CT+TT0.9850.3039.9860.0022.6061.4394.720
3 讨论
鼻咽癌是指发生于鼻咽腔顶部和侧壁的恶性肿瘤,发病率居耳鼻咽喉部恶性肿瘤之首,其常见的临床症状为鼻塞、涕中带血、耳闷、听力下降、复视及头痛等。鼻咽癌的病因尚不确定,目前认为,鼻咽癌是一种多基因遗传病,涉及多个基因之间或基因与环境之间的交互作用[7]。近年来,分子遗传学研究显示,在鼻咽癌细胞中发现多染色体杂合性缺失区(1p、9p、9q、11q、13q、14q和16q),提示鼻咽癌的发生和发展过程中可能存在多个肿瘤抑癌基因变异[8]。
PTEN基因是继p53基因之后第2个被发现在人类癌症中存在高频突变的肿瘤抑制基因,其控制许多生物学进程,包括细胞增殖、迁移和凋亡[9-12]。PTEN基因位于染色体10q23上,是一种含有 105 000 个碱基对的抑癌基因,其由9个外显子和8个内含子组成,编码含有403个氨基酸的蛋白。BONNEAU等[13]对乳腺癌的PTEN基因突变研究发现,突变多发生在外显子5、7处,外显子5突变常导致磷酸酶活性丧失,从而使该基因抑制肿瘤生长的功能受到影响。李日著等[14]研究发现,PTEN基因多态性与食管癌的发病风险密切相关。这些研究提示PTEN基因可能在很多肿瘤的发生、发展中起着重要作用。目前,有关PTEN基因多态性与鼻咽癌易感性的研究报道较少。
SNP是指基因组水平上因单个核苷酸突变引起的序列改变,在人群中的发生率>1%,其在基因组中广泛存在,是一种常见的遗传变异类型,也是不同种族、 个体之间差异的遗传物质基础之一,可导致不同个体之间对恶性肿瘤等复杂疾病的易感性差异。目前,SNP被认为是预测各种肿瘤易感性及预后的稳定和有效的生物学标志物。吴晓红等[15]对XRCC1基因Arg399Gln多态性与鼻咽癌易感性进行了研究,发现Arg399Gln基因多态性与鼻咽癌易感性相关。鉴于PTEN基因与多种癌症的发生有关,本研究试图探讨PTEN基因SNP与鼻咽癌易感性的关系,结果显示,鼻咽癌患者PTEN基因rs532678位点的基因型频率和等位基因频率与健康者比较差异无统计学意义,但鼻咽癌患者PTEN基因rs701848位点的基因型频率和等位基因频率与健康者比较差异有统计学意义,鼻咽癌组rs701848位点CT、TT基因型频率和T等位基因频率显著高于对照组;提示PTEN基因rs701848位点多态性与鼻咽癌的发生可能存在一定相关性,其中CT+TT基因型个体具有较高的发病风险。本研究为解释鼻咽癌的发生提供了新的遗传学依据,并有望为鼻咽癌的预防、诊断和治疗提供可能的分子基础。但本研究所取样本量有限,尚需扩大样本量进一步验证。
参考文献:
[1] DAI W,ZHENG H,CHEUNG A K.Genetic and epigenetic landscape of nasopharyngeal carcinoma[J].ChinClinOncol,2016,5(2):16-29.
[2] 徐唐鹏,王琪,宋启斌.基因多态性与个体鼻咽癌易感性[J].武汉大学学报(医学版),2015,36(6):1005-1010.
[3] YANG J,LI L,YIN X,etal.The association between gene polymorphisms and risk of nasopharyngeal carcinoma[J].MedOncol,2015,32(1):398-406.
[4] LI J,YEN C,LIAW D,etal.PTEN,a putative protein tyrosine phosphatase gene mutated inhuman brain,breast,and prostate cancer[J].Science,1997,275(5308):1943-1947.
[5] WEN S,STOLAROV J,MYERS M P,etal.PTEN controls tumor-induced angiogenesis[J].ProcNatlAcadSci,2001,98(1):4622- 4627.
[6] BESSON A,YONG V W.Mitogenic signaling and the relationship to cell cycle regulation in astrocyt omas[J].JNeurooncol,2001,51(2):245-264.
[7] 鲁保才,卢振民,张爱民,等.干扰性小核糖核酸靶向抑制趋化因子受体4基因表达对鼻咽癌细胞增殖和侵袭的影响[J].新乡医学院学报,2018,35(1):30-34.
[8] 郭颖,方嬿,梁启万,等.47例鼻咽癌遗传变异的研究[J].癌症,1999,18(1):5-8.
[9] SUZUKI H,FREIJE D,NUSSKERN D R,etal.Interfocal heterogeneity of PTEN/MMAC1 gene alterations in multiple metastatic prostate cancer tissues[J].CancerRes,1998,58(2):204-209.
[10] SASAKI H,ZLATESCU M C,BETENSKY R A,etal.PTEN is a target of chromosome 10q loss in anaplastic with poor prognosis[J].AmJPathol,2001,159(1):359-367.
[11] 赵宁,张瑞君,刘磊,等.PTEN 基因对兔晶状体上皮细胞增殖抑制作用的实验研究[J].眼科新进展,2014,34(1):25-29.
[12] MUTTER G L.PTEN,a protean tumor supperssor[J].AmJPathol,2001,158(6):1895-1898.
[13] BONNEAU D,LONGY M.Mutation of the human PTEN gene[J].HumMutat,2000,16(2):109-122.
[14] 李日著,陈宏明,罗世官,等.PTEN 基因多态性与广西壮族食管癌发病风险的关系[J].现代医药卫生,2017,33(7):998-1000.
[15] 吴晓红,于祥远,王程强.XRCC1 Arg399Gln基因多态性与鼻咽癌易感性的Meta分析[J].重庆医学,2015,44(28):3962-3965.

