白藜芦醇对慢性阻塞性肺疾病大鼠骨骼肌过氧化物酶增殖物激活受体因子γ辅激活因子-1α表达的影响
齐 咏,吴纪珍,司 亶,席 芳,尚俊依
(河南省人民医院呼吸与危重症医学科,河南 郑州 450003)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) 是以不完全可逆的气流持续受限为特征且进行性发展的慢性呼吸道炎症性疾病[1]。重度COPD患者存在骨骼肌强度下降,骨骼肌功能异常是导致COPD患者运动耐量下降的重要因素。研究显示,COPD患者外周骨骼肌中存在线粒体异常,主要表现为线粒体数量减少和线粒体基因转录及生物合成异常[2-3]。过氧化物酶增殖物激活受体因子γ辅激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)可作用于下游物质核呼吸因子1(nuclear respiratory factor 1,NRF1),激活一系列核编码的呼吸相关基因,促进细胞色素C氧化酶Ⅳ(cytochrome c oxidase Ⅳ,COX Ⅳ)的表达,增强线粒体转录因子A(mitochondria transcription factor A,Tfam)的表达,调控线粒体生物合成功能[4]。本研究拟通过观察白藜芦醇干预前后COPD大鼠骨骼肌线粒体生物合成相关指标的改变,探讨其对COPD大鼠骨骼肌线粒体生物合成及机体炎症反应的影响。
1 材料与方法
1.1实验动物及分组无特定病原体级雄性Sprague Dawley大鼠45只,体质量(200±20)g,由河南省实验动物中心提供,合格证号:豫XK20050001。将45只大鼠随机分为对照组、模型组和白藜芦醇组,每组15只。
1.2药物、试剂与仪器白藜芦醇(美国LITOZIN公司,中华人民共和国出入境检验检疫卫生证书编号:120000113142900),兔抗大鼠PGC-1α多克隆抗体(sc-13067)、山羊抗大鼠NRF1多克隆抗体(sc-30911)、小鼠抗大鼠Tfam单克隆抗体(sc-166965)、山羊抗大鼠COX Ⅳ多克隆抗体(sc-69359)(美国Santa Cruz公司),酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国PeproTech公司),实时荧光定量聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)试剂盒(美国Invitrogen公司)。低温高速离心机(德国Heraeus公司),7300型qRT-PCR仪(美国ABI公司),PowerPac Universa C型电泳系统(美国BIO-RAD公司)。
1.3COPD模型制备与各组大鼠处理措施除对照组外,模型组和白藜芦醇组大鼠通过气管内滴注脂多糖和反复烟雾暴露法构建COPD模型[5]。烟雾暴露第29天,模型组和白藜芦醇组各取3只大鼠,对照组取1只大鼠处死,肺病理学检查验证COPD建模成功。自烟雾暴露第29天起,对照组和模型组大鼠给予 2 mL 生理盐水灌胃,白藜芦醇组大鼠给予2 mL白藜芦醇溶液灌胃(100 mg·kg-1·d-1),连续灌胃 30 d。所有实验操作均符合实验动物伦理规范要求。
1.4检测指标及方法
1.4.1大鼠血清和小腿骨骼肌组织中肿瘤坏死因子-α(tumornecrosisfactor-α,TNF-α)水平测定药物干预30 d后,100 g·L-1水合氯醛腹腔注射麻醉大鼠,穿刺腹主动脉采集血样,3 000 r·min-1离心10 min,取上清液,-80 ℃保存。采集血样后处死大鼠,取小腿三头肌约1 g,匀浆后3 500 r·min-1离心10 min,取上清液。采用ELISA法测定大鼠血清和小腿骨骼肌组织中TNF-α水平,严格按照试剂盒说明书进行操作。
1.4.2qRT-PCR检测大鼠小腿骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣmRNA表达取大鼠小腿三头肌100 mg,液氮中磨碎,加入TRIzol后匀浆,提取总RNA。通过8 g·L-1琼脂糖凝胶电泳和分光光度计测定总RNA的纯度,计算总RNA浓度。根据Supre®Ⅲ First-Strand Synthesis SuperMix for qRT-PCR说明书进行反转录操作。通过ROX的Platinum SYBR®Green®SuperMix-UDG进行qRT-PCR检测。GAPDH上游引物序列为5′-GGGTCAGAAGGATTCCTATG-3′,下游引物序列为5′-GGTCTCAAACATGATCTGGG-3′;PGC-1α上游引物序列为5′-AAGGTCCCCAGGCAGTAGAT-3′,下游引物序列为5′-TTCAGACTCCCGCTTCTCAT-3′;NRF1上游引物序列为5′-TTACTCTGCTGTGGCTGATGG-3′,下游引物序列为5′-CCTCTGATGCTTGCGTCGTCT-3′;Tfam上游引物序列为5′-GAAAGCACAAATCAAGAGGAG-3′,下游引物序列为5′-CTGCTTTTCATCATGAGACAG-3′;COX Ⅳ上游引物序列为5′-TCACTGCGCTCGTTCTGAT-3′,下游引物序列为5′-CGATCGAAAGTATGAGGGATG-3′。以2-ΔΔCt法计算mRNA相对表达量。
1.4.3Westernblot法检测大鼠小腿骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣ蛋白表达将小腿三头肌组织研磨成粉末状,收集组织裂解产物,4 ℃下10 000 r·min-1离心10 min,二喹啉甲酸法测定上清液中蛋白含量,-70 ℃保存备用。各取100 μg蛋白质样本进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜,封闭,添加一抗,室温下孵育1 h,4 ℃孵育24 h。漂洗3次,每次5 min,加入偶联辣根过氧化物酶的抗鼠IgG二抗,室温孵育 1 h,再次漂洗3次,每次5 min;采用增强化学发光法显色,运用图像分析软件定量测定杂交信号的吸光度。

2 结果
2.1各组大鼠血清和骨骼肌组织中TNF-α水平比较结果见表1。模型组和白藜芦醇组大鼠血清和骨骼肌组织中TNF-α水平显著高于对照组,白藜芦醇组大鼠血清和骨骼肌组织中TNF-α水平显著低于模型组,差异均有统计学意义(P<0.01)。
表1各组大鼠血清和骨骼肌组织中TNF-α水平比较

组别nTNF-α/(ng·L-1)血清骨骼肌对照组14154.7± 13.0129.8± 11.8模型组12378.1± 26.3a330.6± 23.8a白藜芦醇组12248.0± 23.5ab229.3± 26.5ab
注:与对照组比较aP<0.01;与模型组比较bP<0.01。
2.2各组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣmRNA表达比较结果见表2。白藜芦醇组和模型组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COX Ⅳ mRNA相对表达量显著低于对照组,差异均有统计学意义(P<0.01);白藜芦醇组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COX Ⅳ mRNA相对表达量显著高于模型组,差异均有统计学意义(P<0.01,P<0.05)。
表2各组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣmRNA表达比较

组别nPGC-1α mRNANRF1 mRNATfam mRNACOX Ⅳ mRNA对照组141.00± 0.001.00± 0.001.00± 0.001.00± 0.00模型组120.17± 0.05a0.20± 0.08a0.21± 0.04a0.25± 0.07a白藜芦醇组120.38± 0.22ab0.40± 0.19ab0.50± 0.21ac0.63± 0.37ab
注:与对照组比较aP<0.01;与模型组比较bP<0.05,cP<0.01。
2.3各组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣ蛋白表达比较结果见图1和表3。模型组和白藜芦醇组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COX Ⅳ 蛋白表达显著低于对照组,差异均有统计学意义(P<0.01);白藜芦醇组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COX Ⅳ 蛋白表达显著高于模型组,差异均有统计学意义(P<0.01)。
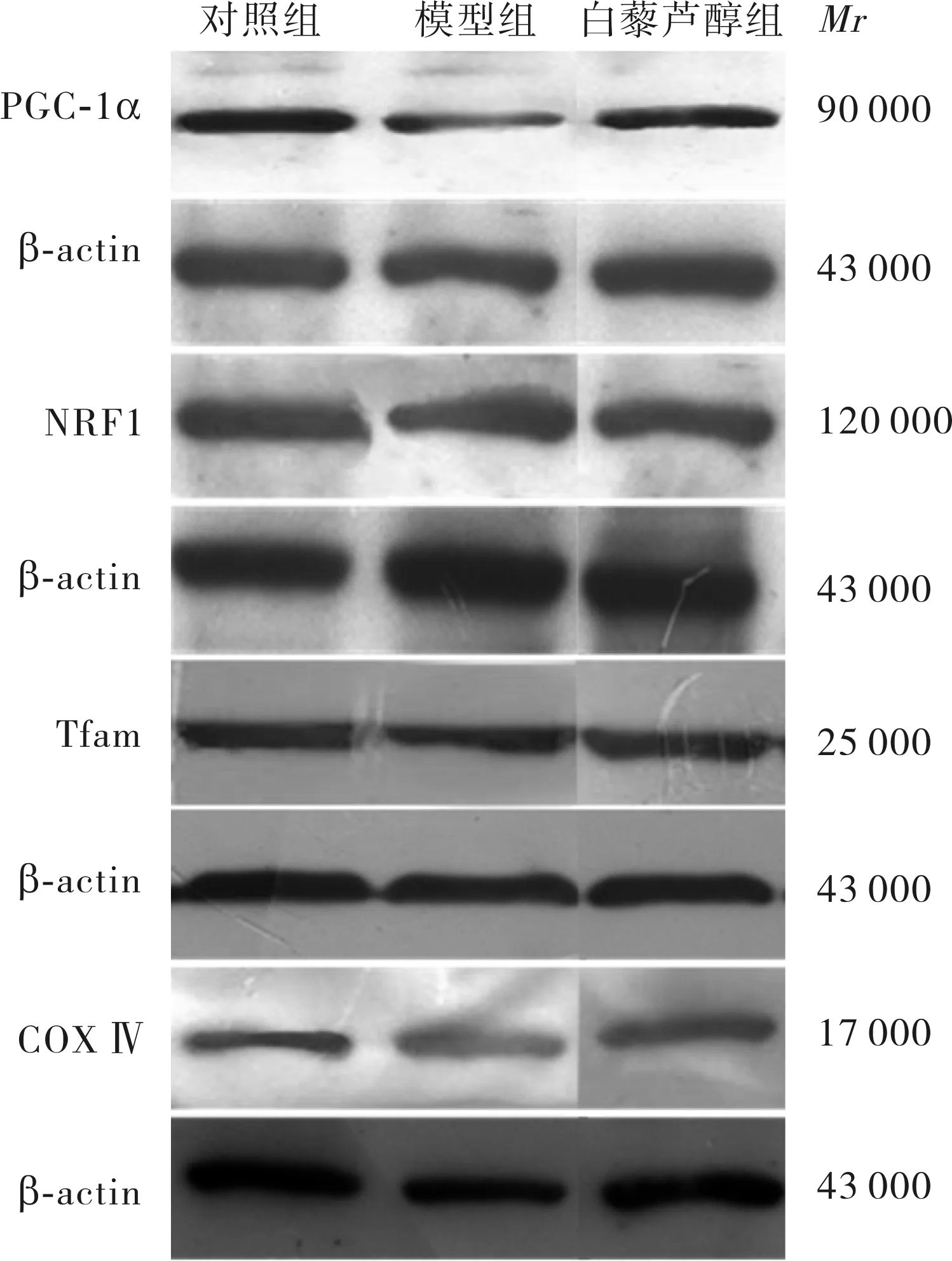
图1各组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣ蛋白表达(Westernblot)
Fig.1ExpressionofPGC-1α,NRF1,TfamandCOXⅣproteininskeletalmuscletissuesoftheratsamongthegroups(Westernblot)
表3各组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam及COXⅣ蛋白表达比较

组别nPGC-1αNRF1TfamCOX Ⅳ对照组140.65± 0.050.54± 0.050.48± 0.040.60± 0.04模型组120.16± 0.03a0.14± 0.02a0.12± 0.02a0.11± 0.02a白藜芦醇组120.39± 0.03ab0.34± 0.04ab0.29± 0.04ab0.31± 0.03ab
注:与对照组比较aP<0.01;与模型组比较bP<0.01。
3 讨论
骨骼肌运动所需能量来源于线粒体,线粒体功能的改变会引发细胞能量代谢异常。研究发现,COPD患者运动过程中早期出现乳酸释放,乳酸并非由呼吸肌产生,而是产生于腿部肌肉,这或许可以解释为什么COPD患者的运动耐受力下降[6]。研究显示,COPD模型大鼠小腿三头肌中线粒体出现数量减少、肿胀、空泡化以及内膜、嵴破坏溶解改变[7],提示COPD大鼠存在线粒体形态学异常。
研究显示,COPD患者骨骼肌病理变化伴随着PGC-1α水平变化,COPD时骨骼肌纤维可以发生由Ⅰ型向Ⅱ型的转变,而PGC-1α可以强力介导Ⅱ型肌纤维向Ⅰ型肌纤维的转变[8],但其具体机制仍有待研究。齐咏等[5]研究显示,COPD大鼠NRF1和Tfam蛋白及mRNA表达水平均下降,提示COPD大鼠线粒体存在生物合成障碍,这一结果与REMELS等[8]研究结果一致。
本研究结果显示,模型组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam、COX Ⅳ蛋白及mRNA表达显著低于对照组,白藜芦醇组大鼠骨骼肌组织中PGC-1α、NRF1、Tfam、COX Ⅳ 蛋白及mRNA表达显著高于模型组,提示白藜芦醇可以显著改善COPD大鼠骨骼肌细胞的线粒体生物合成功能,从而促进改善骨骼肌的能量代谢。研究显示,白藜芦醇诱导的线粒体生物合成及细胞保护作用的机制主要有:(1)激活沉默调节蛋白1,促进PGC-1α活化,改变线粒体生物合成状态;(2)上调线粒体锰超氧化物歧化酶水平,进而调节线粒体氧化还原状态;(3)上调解偶联蛋白2的表达,诱导解偶联依赖的线粒体活性类物质产生,改变氧化还原环境[9-10]。有研究表明,在实验性糖尿病神经病变时,白藜芦醇可以降低TNF-α、白细胞介素-6和环氧合酶-2水平[11-12]。本研究结果也显示,白藜芦醇可以降低COPD大鼠骨骼肌组织及血清中TNF-α水平,改善COPD大鼠的炎症反应状态。线粒体功能异常可以导致机体炎症反应增强[13],白藜芦醇可能通过改善机体线粒体生物合成功能减轻COPD大鼠全身及局部炎症反应,但其具体机制仍需进一步研究。
综上所述,白藜芦醇可以降低COPD大鼠血清及骨骼肌组织中TNF-α水平,提高PGC-1α表达水平,从而改善线粒体生物合成功能。
参考文献:
[1] 李航,郭伟丽,安珍,等.PM2.5对慢性阻塞性肺疾病影响研究进展[J].新乡医学院学报,2016,33(3):234-238.
[2] HOPKINSON N S,TENNANT R C,DAYER M J,etal.A prospective study of decline in fat free mass and skeletal muscle strength in chronic obstructive pulmonary disease[J].RespirRes,2007,13(3):8-25.
[3] 肖亚军,王宋平.慢性阻塞性肺疾病骨骼肌功能障碍的相关因素及机制的研究进展[J].临床肺科杂志,2016,21(2):340-343.
[4] ISLAM H,EDGETT B A,GURD B J.Coordination of mitochondrial biogenesis by PGC-1alpha in human skeletal muscle:a reevaluation[J].Metabolism,2017,79:42-51.
[5] 齐咏,刘青锋,尚俊依,等.慢性阻塞性肺疾病大鼠骨骼肌过氧化物酶体增生物激活受体γ辅激活因子-1α表达对线粒体合成的影响[J].中华实验外科杂志,2015,32(2):367-369.
[6] PUENTE-MAESTU L,LZARO A,HUMANES B.Metabolic derangements in COPD muscle dysfunction[J].JApplPhysiol,2013,114(9):1282-1290.
[7] QI Y,SHANG J Y,MA L J,etal.Inhibition of AMPK expression in skeletal muscle by systemic inflammation in COPD rats[J].RespirRes,2014,15(1):156.
[8] REMELS A H,SCHRAUWEN P,BROEKHUIZEN R,etal.Peroxisome proliferator-activated receptor expression is reduced in skeletal muscle in COPD[J].EurRespirJ,2007,30(2):245-252.
[9] JARDIM F R,DE ROSSI F T,NASCIMENTO M X,etal.Resveratrol and brain mitochondria:a review[J].MolNeurobiol,2018,55(3):2085-2101.
[10] LAGOUGE M,ARGMANN C,GERHART-HINES Z,etal.Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha[J].Cell,2006,127(6):1109-1122.
[11] KUMAR A,SHARMA S S.NF-κB inhibitory action of resveratrol:a probable mechanism of neuroprotection in experimental diabetic neuropathy[J].BiochemBiophysResCommun,2010,394(2):360-365.
[12] 刘海凤,张向东,杨洋.白藜芦醇对青光眼视网膜氧化损伤的保护作用[J].眼科新进展,2014,34(8):732-734.
[13] ZHOU R,YAZDI A S,MENU P,etal.A role for mitochondria in NLRP3 inflammasome activation[J].Nature,2011,469(7329):221-225.

