扩散加权成像评价肝细胞癌Ki-67指数的价值
张澍杰 饶圣祥 陆嘉磊 吴艾倩 陈财忠 曾蒙苏 施伟斌
原发性肝细胞癌(Hepatocellular carcinoma,HCC)是我国发病率和死亡率高的恶性肿瘤之一[1]。肿瘤细胞的增生状态影响肿瘤的预后。Ki-67是反映肿瘤细胞增殖状态的标记物,其表达程度与HCC的预后密切相关[2]。而Ki-67的表达通常需要手术切除后病理评估。扩散加权成像(diffusion weighted imaging,DWI) 通 过 表 观 扩 散 系 数(apparent diffusion coeffecient,ADC)的测定可反映肿瘤细胞密度[3],有望无创地反映肿瘤的增生程度。本文回顾性分析HCC病灶ADC测量值,与术后病理的Ki-67指数相关性,旨在探讨ADC值提供预测HCC的Ki-67指数的能力,为临床HCC的诊治提供有用的信息。
方 法
1.临床资料
回顾性分析复旦大学附属中山医院从2015年1月至2016年10月经手术切除病理证实的HCC患者。纳入标准为:①手术病理证实为HCC并同时做免疫组化Ki-67指数的评价;②手术前2周内在同一台3.0T机器上行腹部MR检查包括DWI序列;③病灶≥1cm;④ 肿瘤在MR检查前未做过肿瘤相关的治疗。排除标准为:DWI图像由于伪影较严重导致图像不清晰。最后,共56名患者(男44例,女12例,中位年龄57岁;29~75岁)纳入研究。
2.MR检查和ADC测量
腹部MR增强检查均在同一台3.0T MR机(MAGNETOM Verio,Siemens AG,Erlangen,Germany)上完成,采用体部相控阵和脊柱联合线圈。检查序列包括常规T2WI脂肪抑制2D自旋回波,同相位和反相位轴向T1加权成像和动态对比增强MRI采用容积式内插法屏气检查的3D梯度回波序列,增强静脉注射马根维显(Magnevist,Bayer Healthcare,0.1mmol/kg),行动脉期、门静脉期及延迟期。DWI序列在增强前扫描,使用自由呼吸单次回波平面成像技术,具体参数:b值为0,500秒 /mm2,TR/TE,3400/70ms,层厚 / 层距6mm/1.8mm,矩阵128×80。扫描包括整个肝脏,同时完成b=0和高b值的图像重组,各向同性,自动生成ADC参数图。并行采集采用全局自动校准部分(GRAPPA)技术,加速因子R=2,一次屏气完成扫描。
ADC值的测量在西门子工作站Leonardo进行,在DWI(b=500s/mm2)图像上沿着肿瘤的边缘画感兴趣区,覆盖整个肿瘤,并拷贝到同层的ADC参数图上获得相应ADC值(图1A、B)。测量肿瘤每一层的ADC值最后计算平均ADC值。
3.病理学检查
本组病例的HCC均行部分肝切除术后进行常规病理组织学分析。Ki-67指数检查使用单克隆小鼠抗人Ki-67抗体进行Ki-67蛋白的免疫组化分析,通过每1000个恶性肿瘤细胞中的免疫反应阳性细胞百分比(×400)来确定,且在肿瘤内具有最高阳性核数目(热点)的区域中进行计数。同时我们根据Ki-67的指数分为“低Ki-67” 组(≤10%)和“高Ki-67” 组(>10%)。
4.统计学分析
ADC值与Ki-67指数之间的相关性分析使用Spearman秩相关检验进行评价并计算相关系数(rho)。比较“低Ki-67” 组与“高Ki-67”组的ADC值采用t检验(正态分布)或Mann-Whitney U检验(非正态分布)进行比较,并进一步采用受试者工作特征(receiver operating characteristics,ROC)曲线分析ADC值在鉴别高Ki-67组和低Ki-67组之间的能力。同时计算ROC曲线下面积(areas under the ROC curve ,AUC)、灵敏度、特异度、阳性预测值和阴性预测值,并计算95%置信区间(95% confidence intervals,95%CI)。统计分析使用MedCalc 11.5.0.0(www.medcalc.be),P<0.05 认为差异有统计学意义。
结 果
1.患者的临床特征
经过病理学检查56名HCC中Edmondson-Steiner分级II级、II-III级及III级的病例数分别为15例、30例和11例。根据Ki-67指数免疫组化结果,“低Ki-67” 组16例,“高Ki-67” 组40例。肿瘤的直径为61.9mm±35.7mm,其中“低Ki-67”组直径为52.0mm±25.5mm,“高Ki-67” 组直径为65.8±38.6mm,两组肿瘤的直径没有统计学差异(P=0.19)。
2.ADC与Ki-67指数
肿瘤的ADC平均值随着Ki-67指数的升高而下降,并与Ki-67指数间存在显著相关性,rho=-0.504(95%CI: -0.677 ,-0.278,P=0.0001,图2)。
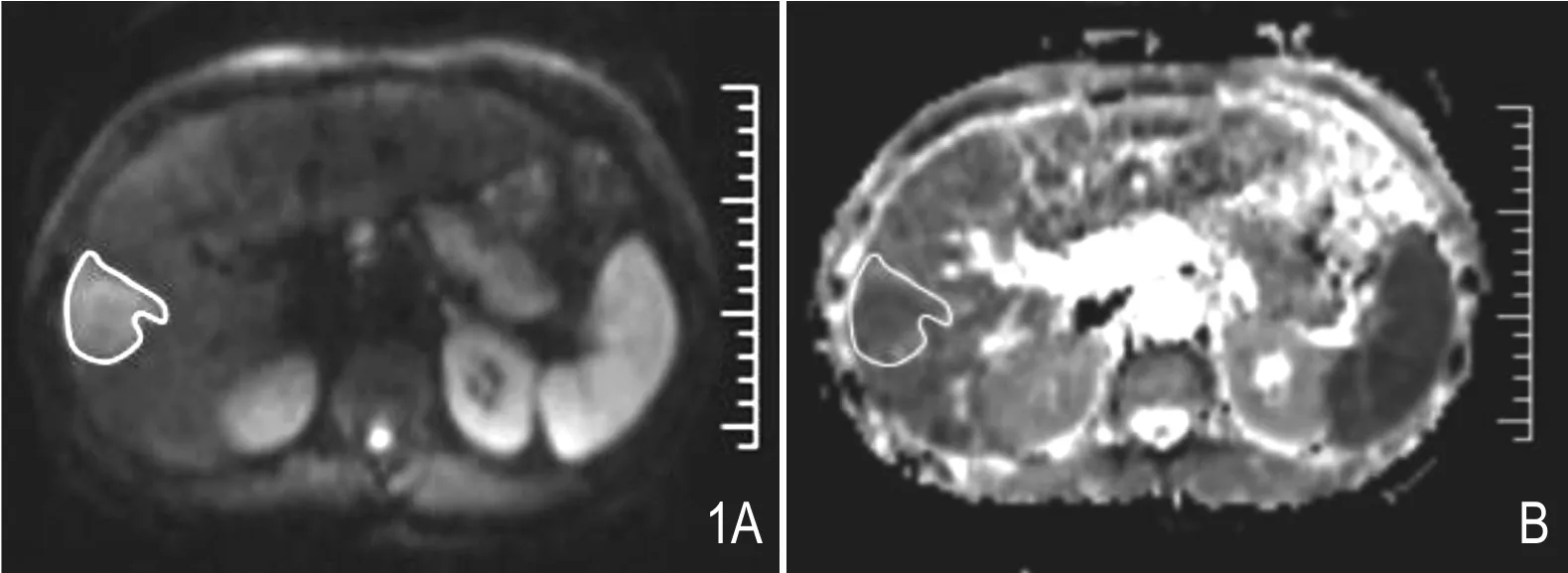
图1 ADC值测量示意图: DWI图像(b值=500 s/mm2)沿着肿瘤边缘画ROI包括整个肿瘤(A),然后将ROI拷贝至相应层面的ADC图(B)。

图 2 ADC 值(10-6mm2/s) 与Ki-67表达相关性的散点。
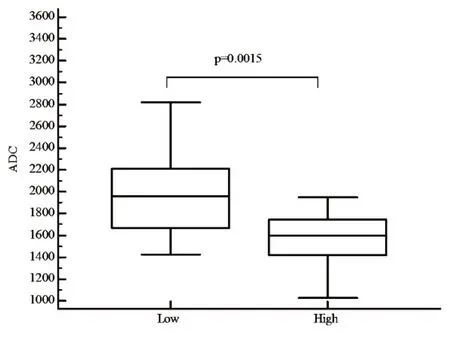
图3 “低Ki-67”组和“高Ki-67”组的ADC值的中位数和四分位数间距的范围的箱式图。
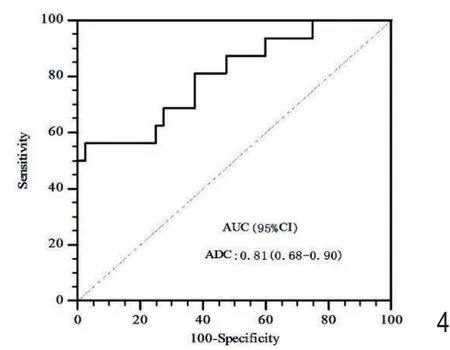
图4 ADC值判断肝癌的Ki-67≤10%受试者曲线(ROC)和曲线下面积(AUC)。其中95%CI为95%可信区间。
3.“低Ki-67”组和“高Ki-67”组比较
“低Ki-67”组的 HCC的ADC值高于“高Ki-67”组(图3),并具有显著统计学差异(1.98×10-3mm2/svs.1.57×10-3mm2/s,P=0.0015)。应用ADC值判断低Ki-67表达表达的曲线下面积为0.81(95%CI:0.68 ~ 0.90)(图 4)。以≥ 1.89×10-3mm2/s为界值判断低Ki-67表达的敏感性为 56.3%(95%CI:30.6% ~ 79.3%),特 异 性 为98.2%(95%CI:89.2% ~ 99.9%),阳性预测值为90.0%(95%CI:54.1% ~ 99.5%),阴性预测值为88.7%(95%CI:77.5% ~ 95.0%)。
讨 论
肿瘤细胞的增生程度是肿瘤的重要生物学特性之一,其直接影响肿瘤的预后和治疗的疗效。Ki-67是一种增殖细胞相关的核抗原,其表达越高代表肿瘤细胞增殖越活跃。荟萃分析显示Ki-67是HCC肿瘤恶化和预后差的重要生物学标志物[2]。DWI是一种MRI功能成像技术,可以无创反映组织中水分子的扩散自由程度,后者与细胞的增生程度(细胞密度)相关[3]。研究表明ADC值可以比较准确地反映肿瘤的Ki-67指数的潜在生物学标志物,从而有助于反映直肠癌[4]和乳腺癌[5]的肿瘤细胞增生程度,并可提示脑膜瘤的分级[6]和膀胱癌的侵袭性[7]等。
本研究发现HCC的ADC值与与Ki-67指数呈显著的负相关(r=0.504),这与文献报道的结果相似[8]。Huang等[8]研究表发现HCC的ADC值与Ki-67表达水平呈显著负相关(r=-0.371),其相关性略低于本研究的相关性。其在测量ADC值时只包括肿瘤的实质部分,排除了肿瘤内出血,坏死或囊性部分,这样测量容易受主观判断的影响而导致测量的一致性低,而且文献报道在肾癌和胰腺神经内分泌肿瘤的患者的肿瘤坏死的程度与肿瘤的增生程度即Ki-67指数具有高度相关[9-11],提示测量不包括肿瘤坏死部分可能会影响到结果的准确性,因此本研究包括整个肿瘤的平均ADC值。
本研究中高Ki-67组的HCC的ADC值明显低于低Ki-67组,其主要的原因在于肿瘤的增生程度高,其细胞密集,这样水分子的扩散运动具有较小的细胞外空间,水分子的扩散程度受到限制更高,ADC值则更低。由于我们的研究为回顾性研究,所采用的DWI序列只使用了两个b值(0和500s/mm2),b值相对比较低,其所计算的ADC值会受到血流灌注效应的影响。近年来扩散序列得到了进一步的改进和优化,尤其是体素内不相干运动(分离组织的微毛细血管灌注和扩散性[12])的DWI技术和弥散峰度成像(非高斯弥散分布[13]),有望进一步提高无创评价HCC的生物学行为的价值[14-15]。另外本研究使用Ki-67>10%为高Ki-67组主要依据较多文献选择的界值[16-17],亦有不同的研究亦有选择不同的界值如5%、15%等[18-19],我们未做一一计算其判断的准确性。
综上所述,ADC值对于预测HCC肿瘤细胞的增殖状态有重要的潜在应用价值,有望为HCC治疗方法的选择和判断预后提供有价值的信息。
[1]Chen W, Zheng R, Baade PD,et al.Cancer statistics in China, 2015.CA Cancer J Clin, 2016, 66:115-132.
[2]Luo Y, Ren F, Liu Y,et al.Clinicopathological and prognostic significance of high Ki-67 labeling index in hepatocellular carcinoma patients: a meta-analysis. Int J Clin Exp Med, 2015, 8:10235-10247.
[3]Lewis S, Dyvorne H, Cui Y, Taouli B.Diffusion-weighted imaging of the liver: techniques and applications. Magn Reson Imaging Clin N Am, 2014, 22:373-395.
[4]Meng X, Li H, Kong L,et al.MRI In rectal cancer: Correlations between MRI features and molecular markers Ki-67, HIF-1α, and VEGF. J Magn Reson Imaging, 2016, 44:594-600.
[5]Onishi N, Kanao S, Kataoka M,et al.Apparent diffusion coefficient as a potential surrogate marker for Ki-67 index in mucinous breast carcinoma. J Magn Reson Imaging, 2015, 41:610-615.
[6]relation of apparent diffusion coefficient with Ki-67 proliferation index in grading meningioma. AJR Am J Roentgenol, 2014,202:1303-1308.
[7]Kobayashi S, Koga F, Kajino Ket al.Apparent diffusion coefficient value reflects invasive and proliferative potential of bladder cancer. J Magn Reson Imaging, 2014, 39:172-178.
[8]Huang Z, Xu X, Meng X,et al.Correlations between ADC values and molecular markers of Ki-67 and HIF-1α in hepatocellular carcinoma.Eur J Radiol, 2015, 84:2464-2469.
[9]am JS, Shvarts O, Said JW,et al.Clinicopathologic and molecular correlations of necrosis in the primary tumor of patients with renal cell carcinoma. Cancer, 2005, 103:2517-2525.
[10]Tollefson MK, Thompson RH, Sheinin Y,et al.Ki-67 and coagulative tumor necrosis are independent predictors of poor outcome for patients with clear cell renal cell carcinoma and not surrogates for each other. Cancer, 2007, 110:783-90.
[11]Tracht J, Zhang K, Peker D.Grading and Prognostication of Neuroendocrine Tumors of the Pancreas: A Comparison Study of Ki67 and PHH3. J Histochem Cytochem, 2017, 65:399-405.
[12]Koh DM, Collins DJ, Orton MR. Intravoxel incoherent motion in body diffusion-weighted MRI: reality and challenges. AJR Am J Roentgenol, 2011,196:1351-1361.
[13]Rosenkrantz AB, Padhani AR, Chenevert TL,et al. Body diffusion kurtosis imaging: Basic principles, applications, and considerations for clinical practice. J Magn Reson Imaging, 2015,42:1190-1202.
[14]Woo S, Lee JM, Yoon JH,et al. Intravoxel incoherent motion diffusion-weighted MR imaging of hepatocellular carcinoma:correlation with enhancement degree and histologic grade.Radiology,2014,270:758-767.
[15]Rosenkrantz AB, Sigmund EE, Winnick A. Assessment of hepatocellular carcinoma using apparent diffusion coefficient and diffusion kurtosis indices: preliminary experience in fresh liver explants. Magn Reson Imaging,2014,30:1534-1540.
[16]Schmilovitz-Weiss H, Tobar A, Halpern M,et al. Tissue expression of squamous cellular carcinoma antigen and Ki67 in hepatocellular carcinoma-correlation with prognosis: a historical prospective study.Diagn Pathol,2011,7:121.
[17]Jang KY, Noh SJ, Lehwald N,et al. SIRT1 and c-Myc promote liver tumor cell survival and predict poor survival of human hepatocellular carcinomas. PLoS One,2012,7:e45119.
[18]Srivastava S, Thakkar B, Yeoh KG,et al. Expression of proteins associated with hypoxia and Wnt pathway activation is of prognostic significance in hepatocellular carcinoma. Virchows Arch,2015,466:541-548.
[19]Shi W, Hu J, Zhu S,et al. Expression of MTA2 and Ki-67 in hepatocellular carcinoma and their correlation with prognosis. Int J Clin Exp Pathol,2015,8:13083-13089.

