Exchange模型的DCE-MRI 定量研究评价肝纤维化的价值
张 岚 朱海云
肝纤维化起病隐匿,向肝硬化发展是一个渐进性的可逆过程。由于肝纤维化各阶段形态学无明显改变,且多数患者肝功能和临床症状无明显异常,以反映解剖为主的传统影像学检查方法对肝纤维化的诊断一直是个难点。研究表明,肝纤维化的进展伴随着肝内血流动力学和血管微环境的改变,且血流动力学改变早于形态学改变[1]。因此准确检测肝纤维化的血流动力学和微血管通透性的变化有助于早期诊断[2]。动态对比增强磁共振(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)定量研究结合双输入-双室Exchange血流动力学模型,客观地反映肝脏的血流灌注和微循环特点[3]。本研究旨在探讨Exchange模型的DCE-MRI评估肝纤维化的可行性,建立用于评价肝纤维化的定量指标。
方 法
1.临床资料
收集2015年1月-2016年12月在河南中医药大学第一附属医院消化科收治的经肝脏穿刺病理活检确诊的肝纤维化患者65例,包括慢性乙型肝炎55例,慢性丙型肝炎10例;男38例,女27例,年龄23~62岁,平均(43.5±7.6)岁,其中S1期15例,S2期15例,S3期15例,S4期20例。所有患者经超声、CT或MRI检查证实肝、脾内无占位性病变。同时选取20名健康志愿者为对照组。所有入组者无严重的心、脑、肺、血液系统疾病。本研究获取本院伦理委员会的批准,所有入组者均签署知情同意书。
2.检查方法
MRI检查采用荷兰Philip Ingenia 3.0T超导型磁共振,腹部8通道线圈。扫描序列①T1WI:TR/TE 10ms/2.3ms,层厚5mm,层间距0.5mm,FOV 400mm×352mm,矩阵160×160,激励次数(NEX)1次; ② 轴 位 T2WI:TR/TE 800ms/80ms,层 厚5mm,层间距0.5mm,FOV 400mm×352mm,矩阵160×160,NEX 1次;③3D-THRIVE:TR/TE 3.8ms/1.8ms,层厚 4mm,层间距 0.4mm,FOV 400mm×400mm,矩阵160×160,翻转角10°。前两期动态扫描后经肘正中静脉通过高压注射器4ml/s的流速团注对比剂(钆双胺,0.2mmol/kg),注射完对比剂后20ml生理盐水以相同速率冲洗,连续扫描50期,每期采集30 层,每个动态采集时间6秒,总时长5分钟。
3.图像处理
将原始数据导入Omni Kinetics(GE Healthcare)后处理软件进行分析。所有原始图像进行三维非刚性运动校正和配准(图1A),然后拟合肝动脉和门静脉血管输入函数(vascular input function,VIF),由2名高年资医师勾画VIF的感兴趣区(region of interest,ROI)。肝动脉的ROI由腹主动脉代替,门静脉取主干层面,腹主动脉和门静脉内的对比剂时间-浓度曲线作为肝脏双血供VIF曲线。肝脏各定量参数计算采用双输入-双室Exchange血流动力学模型,并获取各参数的功能性彩图(图1B~I)。手动勾画肝脏的ROI,肝右叶和左叶分别选取3个ROI,ROI大小约30mm2。记录各个ROI测量的数值,每组重复测量3次取平均值,计算得出各组定量参数。定量参数包括:对比剂容积转运常数(volume transfer constant of the contrast agent,Ktrans)、血管外细胞外间隙容积分数(volume fraction of EES,Ve)、血浆容积分数(volume fraction of plasma,Vp)、速率常数(reverse reflux rate constant,Kep)、肝脏总灌注量(full perfusion,FP)、门静脉灌注量(portal venous perfusion,PVP)、肝动脉灌注量(hepatic arterial perfusion,HAP)、肝动脉灌注指数(hepatic arterial perfusion index,HPI)、对比剂平均通过时间(mean transit time,MTT)、达峰时间(time to peak,TTP)、血容量(blood volume,BV)。
4.组织病理学检查
每例患者在各项检查完成后在一周内行超声引导下行肝组织活检,取病理标本,用10% 甲醛固定,常规制片,行HE、胶原纤维(Masson)及网织纤维染色。根据2000年肝纤维化诊断标准将肝纤维化分为S0、S1、S2、S3、S4共5期[4]。S0期无肝纤维化;S1期汇管区纤维化扩大,局限窦周或小叶内纤维化;S2期汇管区周围纤维化,纤维间隔形成,小叶结构大部分保留;S3期大量纤维间隔形成,伴小叶结构紊乱;S4期即早期肝硬化。正常对照组为S0期,Sl-2期为轻度肝纤维化,S3-4期为重度肝纤维化。
5.统计学分析
采用SPSS 21.0软件进行统计学分析,S0~S4期各组定量参数值的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。定量参数与肝纤维化严重程度的相关性采用Spearman秩相关分析。绘制受试者工作特征 (receiver-operator characteristic curves,ROC)曲线判断Ktrans、Ve、HPI、MTT、TTP值对轻度和重度肝纤维化的诊断效能,计算曲线下面积(area under the curve,AUC)、敏感度及特异度。P<0.05差异具有统计学意义。
结 果
1.肝纤维化不同分期的各定量参数值及其与分期的相关性
肝纤维化不同分期的Ktrans、Kep、Ve、Vp、HPI、MTT、TTP、BV、FP、HAP、PVP值见表1。
表1 肝纤维化各期DCE-MRI定量参数值的比较(±s )
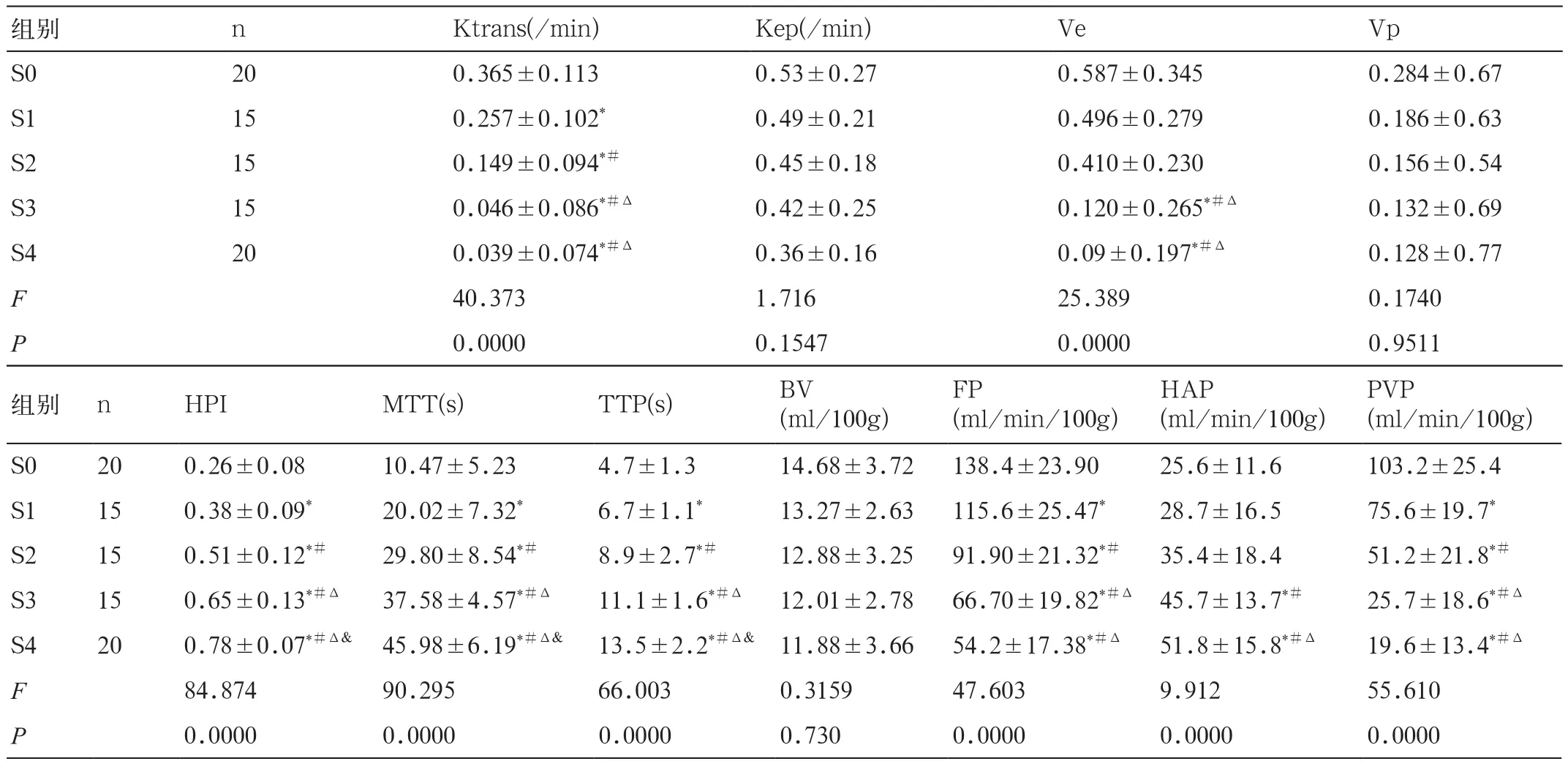
表1 肝纤维化各期DCE-MRI定量参数值的比较(±s )
注:*与S0比较,P<0.05;#与S1比较,P<0.05;Δ与S2比较,P<0.05;& 与S3比较,P<0.05
组别 n Ktrans(/min) Kep(/min) Ve Vp S0 20 0.365±0.113 0.53±0.27 0.587±0.345 0.284±0.67 S1 15 0.257±0.102* 0.49±0.21 0.496±0.279 0.186±0.63 S2 15 0.149±0.094*# 0.45±0.18 0.410±0.230 0.156±0.54 S3 15 0.046±0.086*#Δ 0.42±0.25 0.120±0.265*#Δ 0.132±0.69 S4 20 0.039±0.074*#Δ 0.36±0.16 0.09±0.197*#Δ 0.128±0.77 F 40.373 1.716 25.389 0.1740 P 0.0000 0.1547 0.0000 0.9511 PVP(ml/min/100g)S0 20 0.26±0.08 10.47±5.23 4.7±1.3 14.68±3.72 138.4±23.90 25.6±11.6 103.2±25.4 S1 15 0.38±0.09* 20.02±7.32* 6.7±1.1* 13.27±2.63 115.6±25.47* 28.7±16.5 75.6±19.7*S2 15 0.51±0.12*# 29.80±8.54*# 8.9±2.7*# 12.88±3.25 91.90±21.32*# 35.4±18.4 51.2±21.8*#S3 15 0.65±0.13*#Δ 37.58±4.57*#Δ 11.1±1.6*#Δ 12.01±2.78 66.70±19.82*#Δ 45.7±13.7*# 25.7±18.6*#Δ S4 20 0.78±0.07*#Δ& 45.98±6.19*#Δ& 13.5±2.2*#Δ& 11.88±3.66 54.2±17.38*#Δ 51.8±15.8*#Δ 19.6±13.4*#Δ F 84.874 90.295 66.003 0.3159 47.603 9.912 55.610 P 0.0000 0.0000 0.0000 0.730 0.0000 0.0000 0.0000组别 n HPI MTT(s) TTP(s) BV(ml/100g)FP(ml/min/100g)HAP(ml/min/100g)
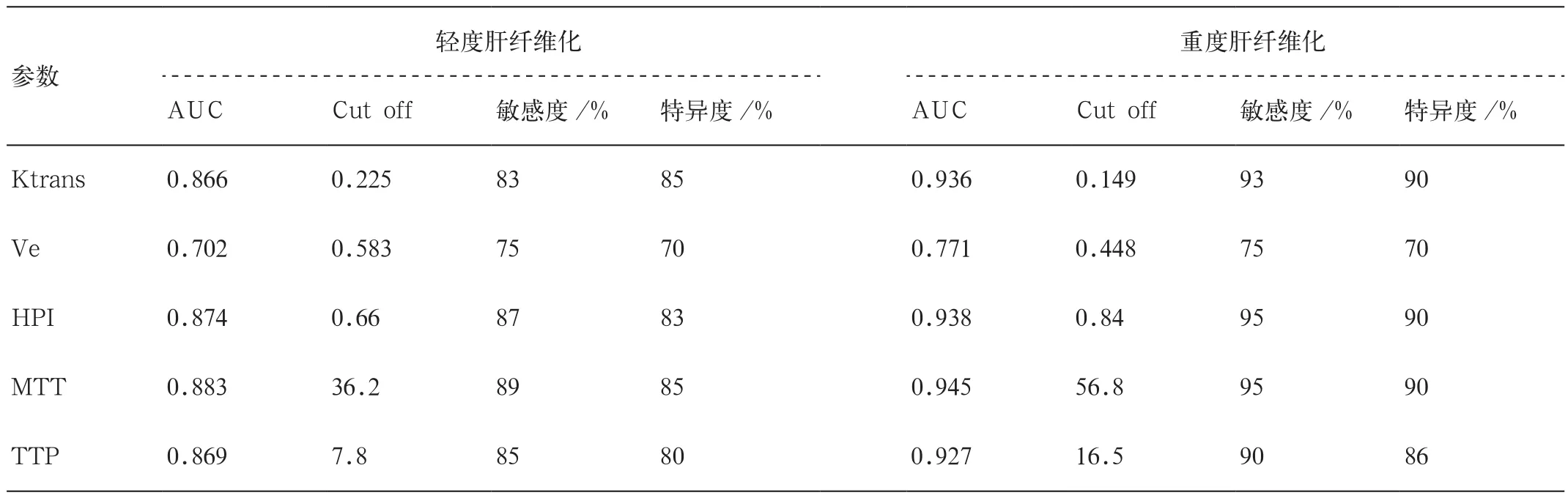
表2 DCE-MRI定量参数对轻度和重度肝纤维化的诊断效能
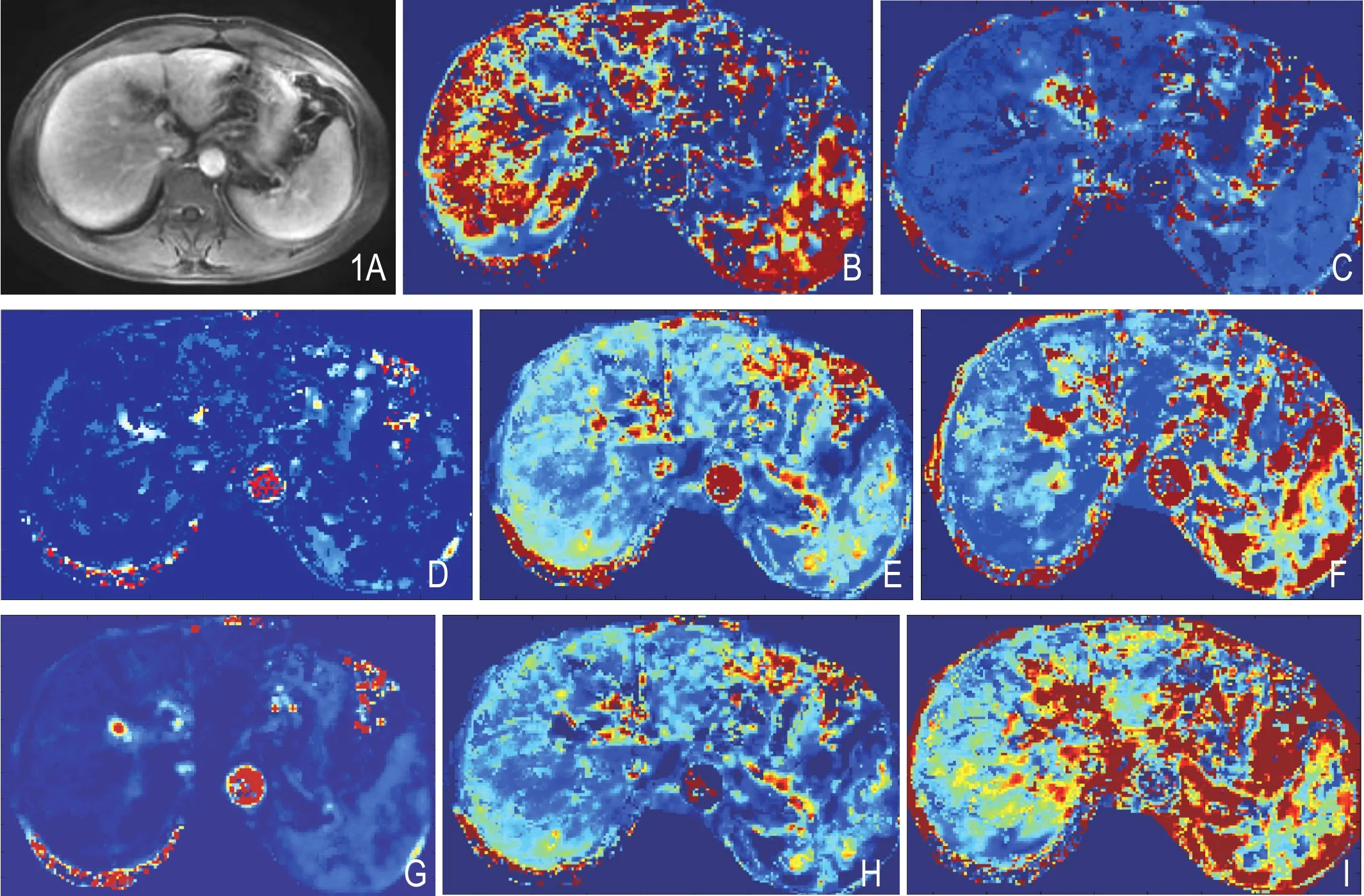
图1 A.原始图像; B~I.分别为Ktrans、Ve、Vp、FP、HPI、HAP、PVP、MTT的功能性伪彩图。
肝纤维化各期的Ktrans值降低,除S4与S3期外,余分期组间两两比较Ktrans值均具有统计学差异(P<0.05)。Ve值降低,S3与S4期分别较S0、S1和S2期降低具有统计学意义(P<0.05)。肝纤维化各期的HPI、MTT、TTP值升高具有统计学意义,且组间两两比较差异均有统计学意义(P均<0.05);除S4与S3期外,余分期组间两两比较FP和PVP值降低均具有统计学差异(P<0.05);HAP呈上升趋势,S3与S4期较S0和S1期HAP值升高具有统计学意义(P<0.05)。Ktrans、Ve与肝纤维化严重程度呈负相关,r值分别为-0.837和-0.726(P<0.05);PVP、FP与肝纤维化严重程度呈显著负相关,r值分别为-0.927和-0.864(P<0.05);HAP、HPI、MTT、TTP 与肝纤维化程度呈正相关,r值分别为 0.622、0.873、0.906和0.852(P<0.05)。
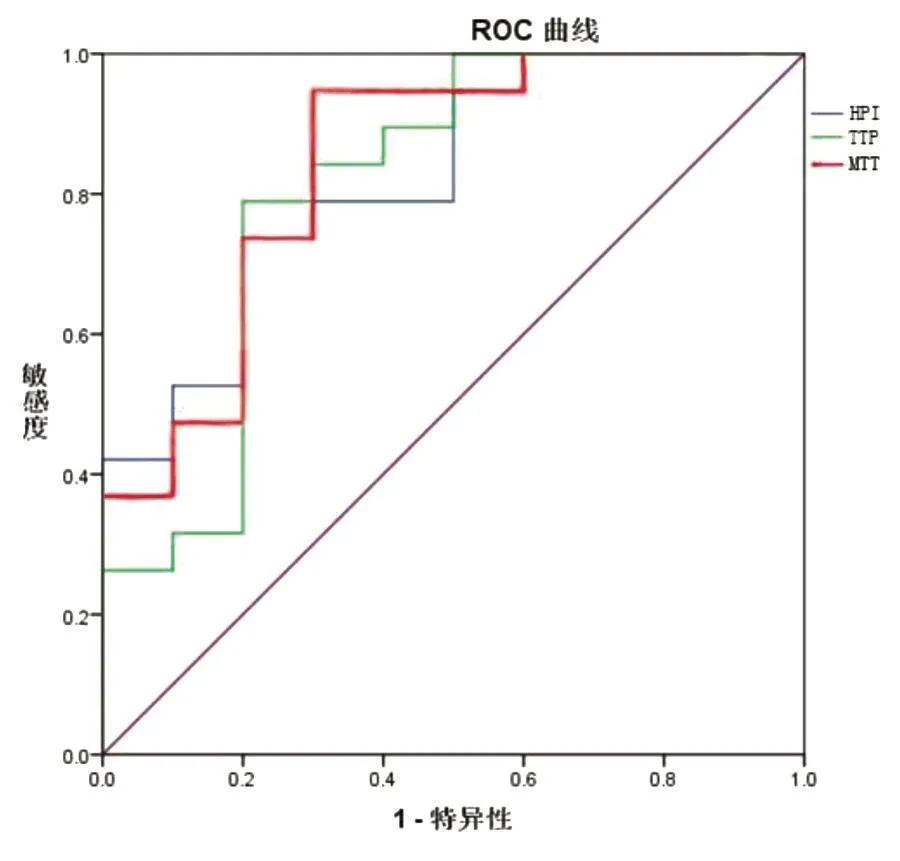
图2 肝脏DCE-MRI定量参数HPI、MTT、TTP诊断重度肝纤维化的ROC曲线。
2.定量参数值诊断轻度和重度肝纤维化的效能
采 用 ROC 曲 线 判 断 Ktrans、Ve、HPI、MTT、TTP诊断轻度和重度肝纤维化的效能(表2)。Ktrans对轻度和重度肝纤维化的诊断效能较高,尤其诊断重度肝纤维化,且诊断效能明显高于Ve。HPI、MTT、TTP三者对轻度和重度肝纤维化均具有较高的诊断效能,且HPI和MTT诊断效能略优于TTP(图2)。
讨 论
目前,肝穿刺活检是肝纤维化诊断及分期的金标准。但是肝穿刺活检为有创性检查,大多数患者接受度较差,因此不宜作为常规临床随访手段。所以,迫切需要寻找一种无创、安全可靠的诊断及评价肝纤维化的影像学方法。DCE-MRI定量研究基于血流动力学模型,通过快速注入对比剂模拟出血管内外对比剂的分布情况,拟合获取肝脏血流灌注和血管渗透性等方面的定量数值[5],从功能学角度对肝脏微循环状况进行分析。这对于准确了解肝脏的生理功能、病理变化及药物的代谢等具有重要的临床意义。由于肝脏为肝动脉和门静脉双重供血,作为一个双血供器官必须拟合双血供VIF获取的肝脏血流动力学变化的信息,才能客观地反映肝脏的病理生理状态。本研究采用的Exchange模型为双输入-双室模型[6],双输入指的是肝脏的肝动脉及门静脉双重供血;双室是指把肝脏分成两个室,肝血窦及血管外细胞外间隙。Exchange模型能够同时获取灌注定量参数和渗透定量参数,全面评估肝脏的微循环状态,从而更适用于肝脏疾病的评估。
当肝脏发生纤维化时,钆对比剂在肝血窦与血管周围间隙的自由交换受阻,而Ktrans反映的是对比剂从血浆分布到血管外细胞外间隙的速率。随着肝纤维化的进展,肝窦毛细血管化加重,钆对比剂从肝血窦分布至血管周围间隙的速率下降,Ktrans值是不断降低的。本研究结果显示Ktrans值随肝纤维化进展程度加重而呈下降趋势,与理论推断相一致,即当肝脏发生纤维化时肝窦毛细血管化阻碍了对比剂从血管内向血管外细胞外间隙的交换。本研究还发现Ve值只有在肝纤维化晚期,即S3和S4期时才与S0期、S1与S2期有显著性差异,而S0期与肝纤维化早期之间Ve值无明显统计学差异。因此,与Ve相比,Ktrans能更早、更敏感地检测到肝纤维化。此外,在诊断轻度和重度肝纤维化时,Ktrans的敏感度、特异度和诊断效能要优于Ve。Li等[7]和Hagiwara等[8]人的研究也认为Ktrans 是肝纤维化诊断与分级的一个良好的预测因子。由此可见,利用Ktrans能够敏感地检测到微血管的通透性,并且受其他因素影响较小,诊断效能较为可靠。
本研究发现轻度肝纤维化S1和S2期时,HAP上升,FP、PVP不同程度下降,以PVP降低明显,且S1、S2期与S0期相比PVP、FP值下降具有统计学差异,而HAP增加并无明显统计学差异。相应地,HPI增加,MTT和TTP均延长,且与S0期比较均具有统计学差异。这可能与肝纤维化早期肝细胞变性肿胀、肝血窦受压变窄、胶原纤维增生,肝内血流阻力增加,门静脉回流受阻,肝动脉与门静脉和肝静脉分支之间出现短路或分流,门静脉灌注量降低,肝动脉血流开始代偿性增加有关。当病变发展至重度肝纤维化S3和S4期时,FP、PVP进一步显著降低,HAP明显升高且差异具有统计学意义。考虑此时肝小叶结构紊乱,肝实质纤维间隔形成,肝窦及窦周毛细血管化等原因导致肝脏微血管床血流动力学发生改变,即肝内血管阻力越来越大,门静脉血流减少,灌注量持续下降,而肝动脉灌注代偿性增加越来越显著。相应地,HPI值明显增大,至S4期时HPI与S0~S3各期均有统计学差异,且此期由于肝脏灌注阻力的显著增加,导致MTT和TTP明显延长。
近年的研究报道中,龙莉玲等[9]的采用CT灌注成像和Logistic回归分析认为PVP诊断重度肝纤维化的敏感度、特异度和准确度较高。许尚文等[10]采用DCE-MRI评估乙肝肝纤维化,认为HPI和HAP在区分非肝纤维化和肝纤维化,非进展期和进展期肝纤维化时存在关联性。本研究结果显示HPI对轻度和重度肝纤维化均具有较高的诊断效能。HPI 尽管是相对值,但对于肝纤维化分期诊断有较大价值,可作为肝纤维化患者临床随访的一个观察指标。 Ronot等[11]对52例肝炎患者采用CT灌注研究发现,MTT为13.4s时,诊断轻、中度肝纤维化敏感度和特异度分别为71% 和65%。本研究中,MTT对重度肝纤维化的敏感度和特异度分别为95%和90%。MTT和HPI一样,对诊断肝纤维化具有较高的临床应用价值。Hagiwara等[8]采用双输入-单室模型的DCEMRI研究发现,MTT 随着肝纤维化进展而延长,在肝纤维化S0、S1~3、S4 期有统计学差异,分别为(9.3±4.3)秒、(18.8±9.1)秒 和 (23.0±10.5)秒。而本研究的MTT值较高,且MTT值在肝纤维化S0~S4期均具有统计学差异。分析其原因可能为本研究采用的是双输入-双室模型,而Hagiwara的研究则基于双输入-单室模型。单室模型是通过动脉及门静脉输入及输出率计算的,是假设对比剂只存在于血管腔,并未考虑到对比剂从血管腔扩散至血管外细胞外间隙的情况[12]。因此,与单室模型相比,双室模型更适合评估肝纤维化的血流动力学和微循环状态,得到的定量参数其敏感性、特异性较单室模型更为可靠。
本研究尚存在一些局限性,如肝纤维化各分期样本量较小,还需进一步扩大样本量进行后续研究;肝脏的灌注状态易受到脂肪变性和炎症的影响,本研究未能完全剔除;对原始图像的三维非刚性运动校正目前尚无统一的标准[13]。
综上所述,DCE-MRI结合Exchange双输入-双室血流动力学模型的研究获得多个定量参数,为肝纤维化的诊断和分期提供一种新的无创性影像学检查方法。
[1]Mormone E, George J, Nieto N. Molecular pathogenesis of hepatic fibrosis and current therapeutic approaches. Chem Biol Interact,2011,193:225–231
[2]谭 凡,王 皓,王云玲,等. 双源CT容积灌注成像评价肝纤维化分期的实验研究. 中国医学计算机成像杂志,2014, 20:142-146
[3]Eric Bultman, Ethan Brodsky, Debra K, et al. Quantitative hepatic perfusion modeling using DCE-MRI with sequential breath-Holds.Magn Reson Imaging,2014,39:853–865
[4]中华医学会传染病与寄生虫病学分会、肝病学分会. 病毒性肝炎防治方案. 中华肝脏病杂,2000,8:324- 329.
[5]Shimon Aronhime, Claudia Calcagno, Guido Jajamovich, et al.DCE-MRI of the liver: effect of linear and non-linear conversions on hepatic perfusion quantification and reproducibility.Magn Reson Imaging, 2014, 40:90–98
[6]章 俞,赵振华,赵 丽,等.Extended Tofts和Exchange模型的动态对比增强MRI参数鉴别诊断肝细胞癌和肝转移瘤的价值.中华放射学杂志,2015,49:656-660
[7]Li Z, Sun J, Chen L, et al. Assessment of liver fibrosis using pharmacokinetic parameters of dynamic contrast-enhanced magnetic resonance imaging. Magn Reson Imaging, 2016, 44 : 98-104
[8]Hagiwara M, Rusinek H, Lee VS, et al. Advanced liver fibrosis:diagnosis with 3D whole-liver perfusion MR imaging-initial experience. Radiology, 2008,246:926-934.
[9]龙莉玲, 黄仲奎, 丁 可,等.多层螺旋CT肝脏灌注成像评价慢性肝纤维化、肝硬化的价值.中华放射学杂志,2012,46:317-321
[10]许尚文,陈自谦,夏加林,等.3.0 T 磁共振动态增强扫描对乙肝肝纤维化的评估.功能与分子医学影像学(电子版) ,2015,4:778-784
[11]Ronot M, Asselah T, Paradis V, et a1. Liver fibrosis in chronic hepatitis C virus infection: differentiating minimal from intermediate fibrosis with pefusion CT. Radiology, 2010, 256:135-142.
[12]Thng CH, Koh TS, Collins DJ,et al. Perfusion magnetic resonance imaging of the liver. World J Gastroenterol, 2010,16:1598-1609
[13]Wang H, Cao Y. Correction of Arterial Input Function in Dynamic Contrast Enhanced MRI of the liver. Journal of Magnetic Resonance Imaging,2012,36:411-421

