ASiR-V联合低管电流技术在低剂量冠状动脉钙化积分扫描中的应用
李如刚 苏 优 石 卉 姜玉洁 陈雪莲 王冬青 朱海涛 张礼荣 宋 廉
CACS被用来评估冠状动脉的斑块负荷,与未来的心血管事件存在联系[1],可以对患者潜在或存在的病变进行动态监测和评估[2]。近年来,心脏CT检查的临床使用率呈指数升高[3]。如何降低扫描的辐射剂量成为研究的热点问题[4]。传统的CACS检查以FBP算法为评分基础,辐射剂量大。迭代重建算法可以降低辐射剂量,但有研究显示迭代重建往往会改变钙化积分值的准确性,影响心脏风险评估[5]。因此,迭代重建算法在低剂量CACS扫描的应用中受到限制。ASiR-V算法为一种全新的迭代重建平台,在固定管电压和噪声指数的条件下,增加迭代重建(ASiR-V)权重可以降低管电流,从而降低辐射剂量。本研究旨在评估ASiR-V联合低管电流技术对钙化积分值准确性及辐射剂量的影响,并且评价图像质量。
方 法
1.一般资料
自2017年3月至2017年7月共120名患者行常规剂量CACS检查,并嘱其两周内行低剂量CACS扫描复诊。病例纳入标准:①年龄≥25周岁且可以配合呼吸训练;②两周内行低剂量CACS扫描复查;排除标准:①冠状动脉支架植入术后或心脏瓣膜置换术后;②孕期妇女及备孕期男性或女性;③严重心律失常患者。共纳入患者98例:男性52例,女性46例;年龄28~93岁,平均61±12岁,身体质量指数(BMI)为(24.8±3.3)kg/m2,高血压患者65例,糖尿病患者20例,扫描心率74±12次/分范围 44~125次/分。所有患者扫描前均未使用调节心率的药物。本次研究经过本院医学伦理委员会的批准,并且每个患者都签署了知情同意书。
2.检查方法
所有扫描均使用256层CT扫描仪(Revolution CT,GE Healthcare,Waukesha,WI 美国)。对患者进行有效的呼吸训练,前瞻性心电门控。扫描参数:管电压为120kV,智能管电流(Smart mA)技术:管电流范围(50~600mA);NI:20,X管旋转速率:0.28s/r,准直器宽度:0.625mm×256,扫描范围自气管隆突至心脏膈面以下,层厚和层间距均为0.25cm,扫描视野为25cm。常规剂量扫描:ASiR-V比例选择0%;低剂量扫描ASiR-V比例选择50%。有效剂量计算公式:有效剂量(ED) =剂量长度乘积(DLP)×胸部转换系数(k=0.014 mSv/mGycm)。
3.图像的后处理和分析
将原始数据导入工作站(Advantage AW 4.6 GE Healthcare)。记录两组扫描的CT剂量指数(CTDI)和DLP并计算出ED,比较两组扫描辐射剂量的差异。在升主动脉左冠状窦口水平选取100mm2的椭圆形作为感兴区域(region of interest,ROI),ROI的标准差(SD)作为图像的噪声值,使用信噪比(SNR)评价图像的质量,SNR的计算公式:SNR=ROI平均CT值/SD。利用钙化积分处理软件(Smartscore4.0,GE公司Healthcare)计算图像的AS,MS及VS。以预测心血管疾病(cardiovascular disease,CVD)风险的程度把AS分为5组:0(无风险)、1~10(低风险)、11~100(低到中风险)、101~400(中风险)及400以上(高风险)。
4.统计学方法
所有的计量资料均以±s来表示,ED和图像噪声及SNR的比较使用配对样本t检验,使用Wilcoxon符号秩检验和Bland-Altman分析法比较两组扫描积分值的差异性和一致性。使用Pearson相关系数检验两组结果的相关性,以r值大于0.700为高度相关,r值大于0.900为极高度相关。两种检查方法的AS危险分组的一致性用Kappa检验,以Kappa值≥ 0.75表示一致性较好,0.75> Kappa值≥0.4为一致性一般,kappa<0.4为一致性差,P<0.05有统计学意义。
结 果
1.两组扫描图像的质量及辐射剂量的比较
低剂量组和常规剂量组ED的比较为1.8±0.97 mSvvs.2.6±1.08mSv,P<0.05。低剂量组和常规剂量组图像噪声值的比较为 15.5±2.1HUvs.17.2±3.5HU,P<0.05;低剂量组和常规剂量组图像 SNR 的比较为 2.9±0.5vs.2.6±0.6,P<0.05。低剂量组的有效辐射剂量显著低于常规剂量组且改善了图像质量,降低剂量的幅度约为33.4%(表1)。
表1 各变量在常规剂量扫描和低剂量扫描的比较(±s)

表1 各变量在常规剂量扫描和低剂量扫描的比较(±s)
常规剂量组 低剂量组 P管电流(mA) 522.50 ± 93.50 361.78 ± 134.41 <0.05 CT计量指数(CTDI,mGy) 11.64 ± 4.82 8.13 ± 4.26 <0.05有效剂量(mGy) 2.60 ± 1.08 1.80 ± 0.97 <0.05图像噪声 17.16 ± 3.53 15.46 ± 2.12 <0.05信噪比 2.66 ± 0.62 2.92 ± 0.53 <0.05
表2 低剂量组及常规剂量组的AS、MS及VS(±s)

表2 低剂量组及常规剂量组的AS、MS及VS(±s)
低剂量组ASIR-V50% 常规剂量组FBP P 秩检验Z值 秩检验P值Agaston 积分 148.88 ± 403.77 150.36 ± 424.82 0.77 0.08 0.94质量积分 27.11 ± 96.90 25.84 ± 88.34 0.21 0.86 0.39体积积分 52.01 ± 121.32 53.40 ± 124.04 0.38 1.04 0.30

表3 常规剂量及低剂量扫描AS积分风险分级比较
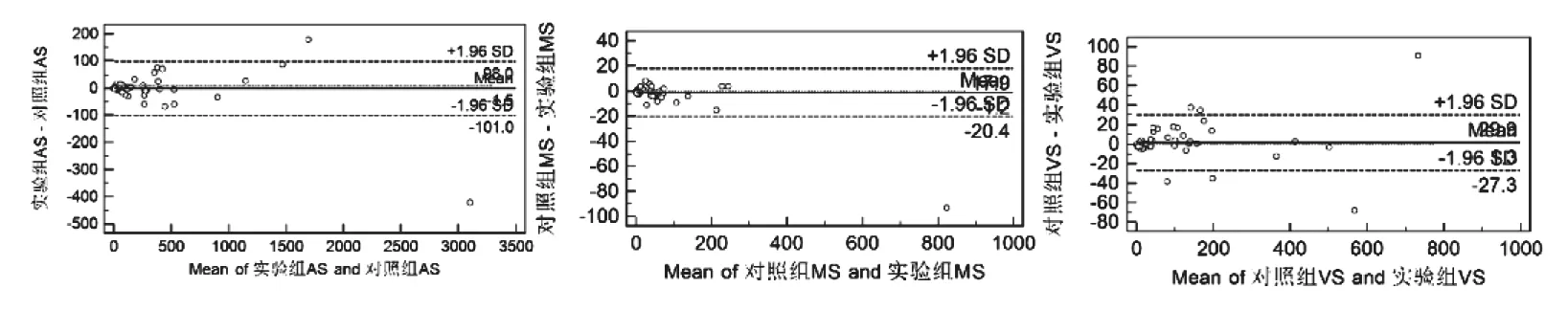
图1 两组扫描AS,MS及VS的Bland-altman散点图。AS及MS显示了良好的一致性。VS散点图显示6点(6%)位于一致性界限外,其中2点靠近上下界,位于LOA95%可信区间内,其差异是可以接受的。注:实验组为低剂量CACS扫描,对照组为常规剂量CACS扫描。

图2 低剂量组和常规剂量组AS、MS及VS相关性散点图,相关系数分别为0.994、0.999及0.993.注:实验组为低剂量CACS扫描,对照组为常规剂量CACS扫描。
2.两组检查钙化积分值的比较
配对样本t检验和Wilcoxon符号秩检验显示两种扫描方法的AS、MS及VS的差异均无统计学意义,P值均大于0.05(表2)。
3.钙化积分的一致性及相关性
Bland-Altman分析显示低剂量钙化积分扫描与常规剂量积分扫描的AS及MS有良好的一致性(图1),两种检查方法AS、MS及VS的pearson相关系数分别为0.994、0.999和0.993,均为极高度相关(图2)。
4.两组检查钙化积分评估心血管风险的一致性
与常规剂量组的风险分组相比,低剂量组仅有4例(4%)产生了重新分组,且均为相邻级别的再分组,没有出现跨级别再分组的病例。钙化积分为零的所有患者,没有出现重新分组的现象(表3)。两种检查方法风险分级的一致性较好,Kappa值为0.937。
讨 论
CACS扫描是一种可靠的无创的检查技术,它与冠状动脉斑块的总负荷以及心肌梗死和心源性猝死相关,已成为有效的CVD风险的评估方法。其中AS是一种最为广泛接受的冠状动脉钙化的定量方法[6]。2010年美国心脏病协会基金会/美国心脏病协会(ACCF/AHA)风险评估指南中,CACS被列为Ⅱa类、B级证据和Ⅱb类、B级证据。近年来,我国心血管疾病的发病率和死亡率呈上升趋势,为城市居民和农村居民的首要死亡原因,所占比例分别为41.52%和41.09%。并且大约一半的心源性死亡患者之前并未被诊断为心血管疾病或没有相关症状[7]。在无症状人群中,CACS的检测有利于CVD的早期诊断和治疗。
随着CT检查使用率的增加,电离辐射的致癌风险受到了越来越多的关注,有研究显示大约2%的恶性肿瘤可能是因为CT的电离辐射引起的[8]。因此,CT检查需遵从辐射防护最优化(as low as reasonably achievable,ALARA)原则[3]。
迭代重建算法在低剂量冠状动脉CT造影(CCTA)检查中得到了广泛的应用。然而,因其影响钙化积分值的准确性,在CACS扫描中的应用受到了限制[9]。Nakazato等探讨了低电压技术的降低辐射剂量方法,但是在该研究中调整了计算AS的阈值[10]。本研究管电压的设定和传统钙化积分扫描一致,采用GE公司最新开发的实时迭代重建ASiR-V算法,联合 Smart mA技术,降低辐射剂量的程度和仅和管电流的变化相关。管电压和图像的噪声指数没有发生变化,所以得到的钙化积分值与使用FPB算法的常规剂量扫描无显著差异,同时辐射剂量降低约33.4%。在心脏风险分级评估分组种仅有4例(4%)产生了再分组,风险分组的一致性较好。
本研究的局限性:①本研究的样本量较小,且只研究了单一比例迭代重建(ASIR-V50%),最优权重的ASiR-V的设定尚需进一步研究。②本研究使用单一的噪声指数,NI和管电压对钙化积分值的影响尚需进一步研究。
综上所述,ASiR-V联合低管电流技术可以在不改变钙化积分准确性的前提下,降低CACS扫描的辐射剂量,并且改善图像的质量。
声明:本研究过程和结果均未受到相关设备、材料、药品企业的影响。
[1]侯志辉,吕 斌. 冠状动脉CT成像对急性冠状动脉事件的预测价值.中华放射学杂志,2012,46:382-384
[2]姚振威,陈 爽,冯晓源,等.冠心病的16层螺旋CT冠脉成像.中国医学计算机成像杂志,2005,11:320-324.
[3]Sarma A, Heilbrun M.E, Conner K.E., et al.Radiation and chest CT scan examinations:what do we know?. Chest ,2012, 142:750–760.
[4]McCollough C, Primak A.N, Braun N, et al. Strategies for reducing radiation dose in CT. Radiol Clin North Am,2009, 47:27–40.
[5]Szilveszter B, Elzomor H, Karolyi M, et al. The effect of iterative model reconstruction on coronary artery calcium quantification. Int J Cardiovasc Imaging, 2016, 32:153-160
[6]Krishna A, Parag HJ, Travis SH, et al.Scoring of coronary artery calcium scans: History, assumptions,current limitations, and future directions.Atherosclerosis, 2015, 239:109-117.
[7]Wang W,Hu H,Kong Z,et al. Summary of report on cardiovascular diseases in China,2012. Biomed Environ Sci,2014,27:552-558
[8]尤 佳,代 岳,李菁菁,等. 低管电压结合迭代重建技术在不同BMI患者的头颈部CT血管成像中的应用研究.中国医学计算机成像杂志,2015, 21:459-465
[9]Willemink MJ,Takx RA,de Jong PA,et al.The impact of CT radiation dose reduction and iterative reconstruction algorithms from four different vendors on coronary calcium scoring.Eur.Radiol,2014,24:2201-2212.
[10]Nakazato R, Dey D, Gutstein A,et al. Coronary artery calcium scoring using a reduced tube voltage and radiation dose protocol with dual-source computed tomography. Cardiovasc.Comput Tomogr 2009,30:394–400.

