拟南芥生物钟突变体gi延迟营养生长时相转变
郭 蕊,傅 钰,马婉琪,王 苓,白 惠,龙 鸿
(天津农学院 园艺园林学院,天津 300384)
营养生长是高等植物早期形态建成的重要时期,由幼龄期和成熟期组成[1]。只有经历幼龄期和成熟期,实现营养生长时相转变(vegetative phase change, VPC),植物体才能进入生殖生长,完成开花、结果[2]。
最早关于VPC的研究是Knight对木本植物梨树(Pyruscommunis)和苹果(Malusdomestica)进行的嫁接实验,实验说明了植物的营养特性与其未来生殖能力密切相关[3]。
模式植物拟南芥中,幼龄期叶片近圆形,叶缘平滑,叶片长宽比小,仅在近轴面出现表皮毛;成熟期叶片近匙形,叶缘卷曲,近轴面和远轴面均具有表皮毛[2-3]。调控VPC的分子基础仍不清楚,拟南芥和玉米(Zeamays)中VPC的分子遗传分析表明,一种小分子RNA,miR156,及其靶基因SPL(SQUAMOSAPROMOTERBINDINGPROTEINLIKE)基因家族,在这个转变中发挥重要作用。miR156表达量在幼龄期较高,而在成熟期则降低;SPL3基因表达则相反,并受到miR156的强烈抑制[2,4]。
生物体中,以约24 h为一个时间节点,周期反复振荡,这一节律,接近地球自转周期,在原核和真核生物中都存在,是为生物钟[5-6]。研究表明,生物钟参与调控植物生理和生长发育过程,如细胞伸长、气孔开闭、叶片运动和开花等[5]。生物钟由输入途径、输出途径及核心振荡器组成;生物钟核心振荡器又由中心反馈环、早反馈环及晚反馈环组成[7-8]。拟南芥中,该反馈调节环由3个基因组成:CCA1 (CIRCADIANCLOCKASSOCIATED1)、LHY(LATEELONGATEDHYPOCOTYL)和TOC1 (TIMINGOFCABEXPRESSION1),其中LHY和CCA1负调控TOC1表达,TOC1则正向调控LHY和CCA1表达[9]。GI(GIGANTEA)是植物特异的核蛋白,GI在开花时间调控、光信号传导、下胚轴伸长、生物钟调控、糖和淀粉积累、抗植物逆境胁迫等许多生理反应中起作用[10]。在参与生物钟调控中,GI是维持CCA1和LHY启动子高表达所必需,并可能是一个TOC1的共同作用因子[5]。
营养生长时相转变是植物生长发育的一个重要生理过程,与植物自身生物钟节律密切相关,但其调控机制仍不清楚,生物钟相关基因在此转变中的作用仍不明确。本研究对拟南芥gi突变体VPC过程进行了观察研究,以探讨GI对VPC的影响,为生物节律与VPC之间的关联提供实验依据。
1 材料与方法
1.1 材料
材料来源参见文献[11]。WT-Col背景下的gi突变体在突变体库中编号为SALK_092757。
1.2 方法
1.2.1 植物种植
方法参见文献[11]。植物生长箱中培养周期为:光照培养16 h,暗培养8 h。
1.2.2 植株形态观察
待种子长出子叶后,开始观察野生型Col-0及突变体gi的表型,并记录其生长速率。方法参见文献[11]。抽薹后,将所有莲座叶片摘下,测量其长和宽,计算其长宽比。
1.2.3 石蜡切片
方法参见文献[11]。
1.2.4 反转录PCR(RT-PCR)与荧光定量PCR(Q-PCR)
利用RT-PCR与Q-PCR做miR156表达分析,为Actin-2。植株的总RNA采用CTAB法提取,反转录方法参见文献[11]。miR156扩增采用颈环法,Col-0扩增33个循环,gi扩增31个循环。Q-PCR实验过程中使用BIO-RAD CFX96实时荧光定量PCR仪,反应条件参见文献[11]。引物序列:Actin2-F:5′-GCTGAGAGATTCAGATGCCCA-3′,Actin2-R:5′-GTGGATTCCAGCAGCTTCCATACT-3′;miR156-F:5′-CATCTTGTAGATCTCTGAAGTTGGACT-3′,miR156-R: 5′-GAGATTGAGACATAGAGAACGAAGACA-3′。
2 结果与分析
2.1 gi突变体莲座叶远轴面表皮毛出现和生长发育进程
为探讨GI对植物生长发育过程和VPC的影响,我们观测了gi突变体的生长周期特征。通过对各自25株植株进行详细的表型观察统计及分析可看出,野生型Col-0莲座叶叶片总数为10片,gi突变体莲座叶叶片总数为40片,数量明显增多(表1),说明突变体gi生长周期明显延长;Col-0莲座叶出现远轴面表皮毛为第6片(15 d时),而gi则是在第8片(18 d时),表明突变体的远轴面表皮毛出现晚于野生型(表1;图1),说明其VPC被延迟;生长发育进程观察显示,野生型Col-0在生长约23 d出现可见花芽,而突变体在约43 d才出现可见花芽(表1),开花明显延迟。
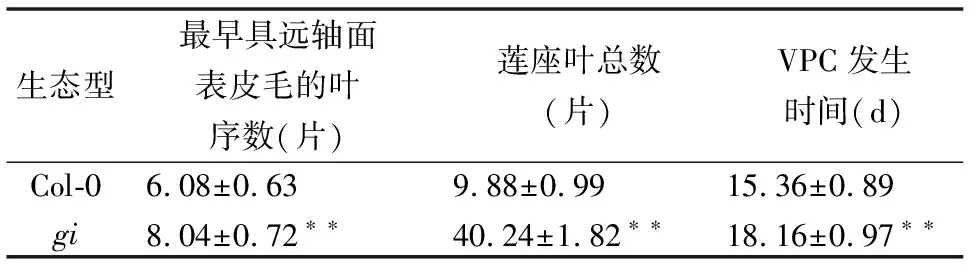
表1 拟南芥野生型和突变体营养生长发育情况统计Table 1 Growth characteristics of wild-type Col-0 and mutant gi
2.2 gi突变体的叶形和叶片长宽比
为进一步探讨gi突变体的VPC过程特点,我们对野生型Col-0和gi突变体的叶形变化进行了观察比较。结果显示,野生型Col-0的前4片莲座叶接近圆形,后期的叶片则呈渐长的匙形,叶片长宽比在第6片叶时达到高位值1.55,随后逐渐增大;gi突变体的前5片莲座叶也近圆形,后期的叶片逐渐呈较长的匙形,叶片长宽比在第8片叶时达到高位值1.89,随后逐渐增大(图1),说明野生型和突变体分别在第6和第8片叶时完成VPC,与远轴面表皮毛出现的时间一致,突变体的VPC被延迟。
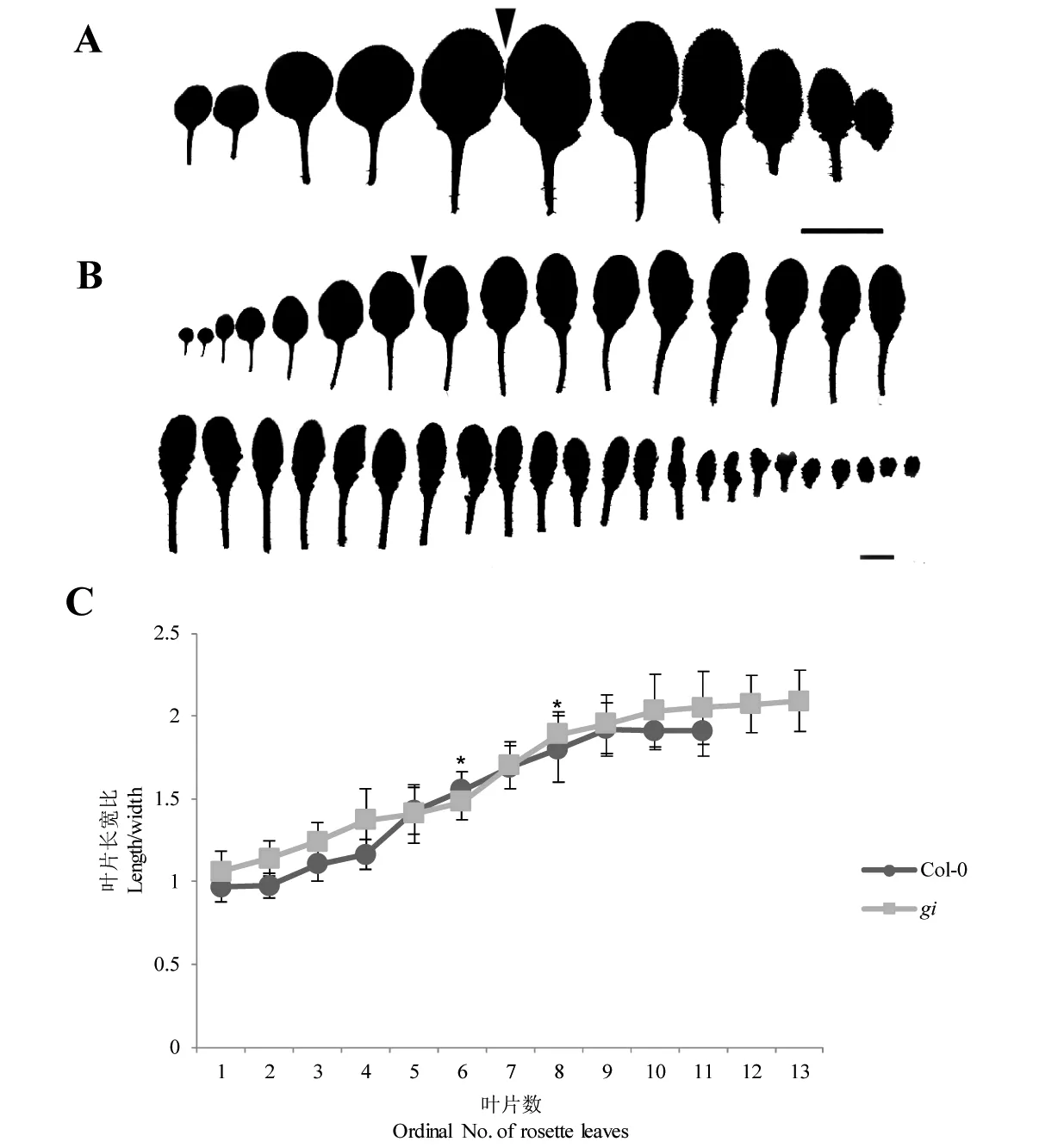
图1 野生型Col-0与gi突变体的叶形图及不同生长时期gi突变体和野生型的叶片长宽比Fig 1 Leaf morphology of wild-type Col-0 and gi mutant and the length width ratio of leaves in wild-type Col-0 and mutant giA:Col-0从第1片真叶开始至第11片莲座叶叶形;B:gi从第1片真叶至第39片莲座叶叶形。箭头处表示VPC发生时期,即从箭头后的叶片开始出现远轴面表皮毛,Bars=1 cm。C:叶片长宽比是以叶片顶端到叶柄联合处的距离为长,叶片中部最宽位置为宽得到的比值。* P<0.05 (Student′s t-test)
2.3 gi突变体的茎尖分生组织解剖结构特征
我们在解剖结构层面对茎尖分生组织(shoot apical meristem, SAM)的发育过程进行了显微观察。茎尖石蜡切片结果显示:Col-0在生长第5 天时,植株分化出2片叶,此时SAM生长锥纵切面呈平坦状,细胞尚未分化(图2-A);在生长第10天时,植株分化出4片叶,生长锥纵切面稍有凸起,SAM的原套细胞为单层(图2-B);在生长第15天时,植株分化出6片叶,生长锥明显凸起,原套细胞开始分化成多层,原体和髓分生组织细胞分裂,数目增多(图2-C);在第19天,植株分化出8片叶,生长锥继续生长、发育,凸起增高(图2-D);在第23天时,植株分化出12片叶,花原基出现(图2-E)。gi突变体在生长第5天时,植株分化出2片叶,SAM纵切面也为平坦状,细胞无分化(图2-F)。在生长第10天和第15天时,植株分别分化出4片叶和6片叶,生长锥纵切面开始凸起,但茎尖分生组织原套细胞无分化或为单层(图2-G和2-H);在生长第19天时,植株分化出8片叶,生长锥纵切面凸起明显,原套、原体和髓分生组织均分化、发育(图2-I);在生长第43天时,植株分化出20片叶,花芽发育(图2-J)。根据野生型和突变体茎尖生长锥明显凸起且分化的时间(分别为第15天和第19天),判定突变体VPC延迟,与形态学观察结果一致。
2.4 miR156表达量水平显示GI突变导致VPC推迟
我们还检测了植株发育过程中miR156的表达变化。RT-PCR显示,在野生型Col-0和突变体gi植株中miR156的转录水平都随着生长进程呈下降趋势。Col-0植株在第15 d时,miR156表达量比第11天明显降低,只约为前者的一半(图3),说明在15天时发生VPC;突变体植株则是在第19天时表达量约为15天时的一半(图3),说明在19 d时发生VPC。这一结果表明,突变体VPC延迟。随后发育中,当植株进入开花期(即Col-0生长到23 d,gi生长到43 d)时,几乎检测不到miR156的表达(图3)。

图2 野生型Col-0与gi突变体茎尖分生组织解剖结构Fig 2 The anatomical structure of SAM of wild type Col-0 and mutant gi
A-E:Col-0在LD下生长5、10、15、19、23 d时SAM纵切图;F~J:gi在LD下生长5、10、15、19和43 d时SAM纵切图。A~J:Bars=50 μm。左上角为切片取材时植株的生长发育情况,Bars=1 cm
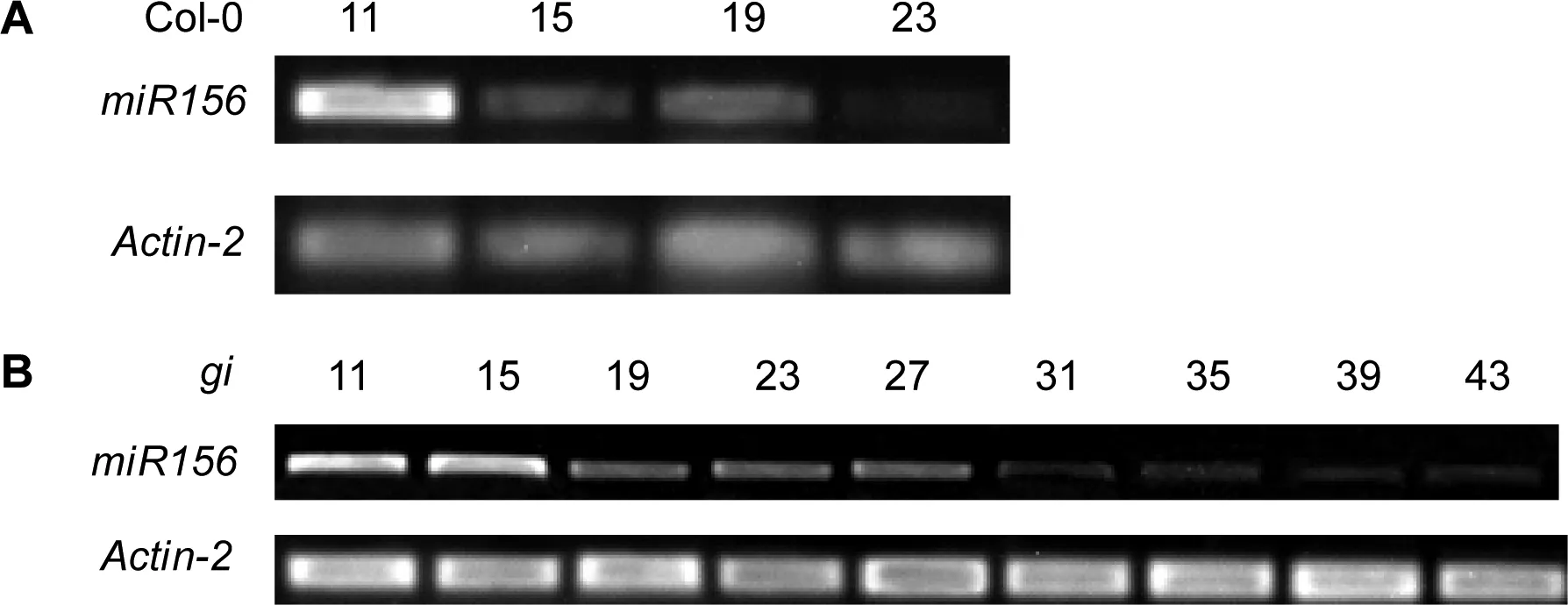
图3 RT-PCR检测Col-0与gi不同发育过程中miR156的表达Fig 3 Expression analysis of miR156 in Col-0 and gi with RT-PCR amplification
A:Col-0植株中在LD下生长11、15、19、23 d时miR156的表达量变化; B:gi植株中在LD下生长11、15、19、23、27、31、35、39和43 d时miR156的表达量变化;Actin-2基因为内参,其表达量作为对照
进一步荧光定量PCR检测结果显示,随着生长发育进程,野生型和突变体植株中的miR156表达均呈下降趋势,且miR156在gi中的表达量高于相应发育时期的Col-0(图 4);Col-0植株在生长第15天时,miR156的表达量下降最快,比前面11 d时测定的量下降1倍多,而gi突变体植株则在第19天时miR156的表达量下降到前面的1倍多,之后均缓慢下降,说明野生型和突变体植株分别在第15天和第19天时发生VPC,gi突变体中相对于野生型Col-0延迟了VPC,与本文中其他实验(包括RT-PCR检测)结果相符。
3 讨论
在对长日照开花途径的研究过程中,鉴定出了与开花相关的重要基因CO(CONSTANS)、FT(FLOWERINGLOCUST)和GI(GIGANTEA)[12]。其中GI是一个与生物钟相关的控制开花周期的基因,GI发生突变导致拟南芥在长日照条件下开花延迟[13],GI超表达会造成早花表型[14]。由于开花是营养生长的延续,GI作为生物钟相关基因,参与调节了开花的进程,但它对营养生长发育进程的影响仍未知。
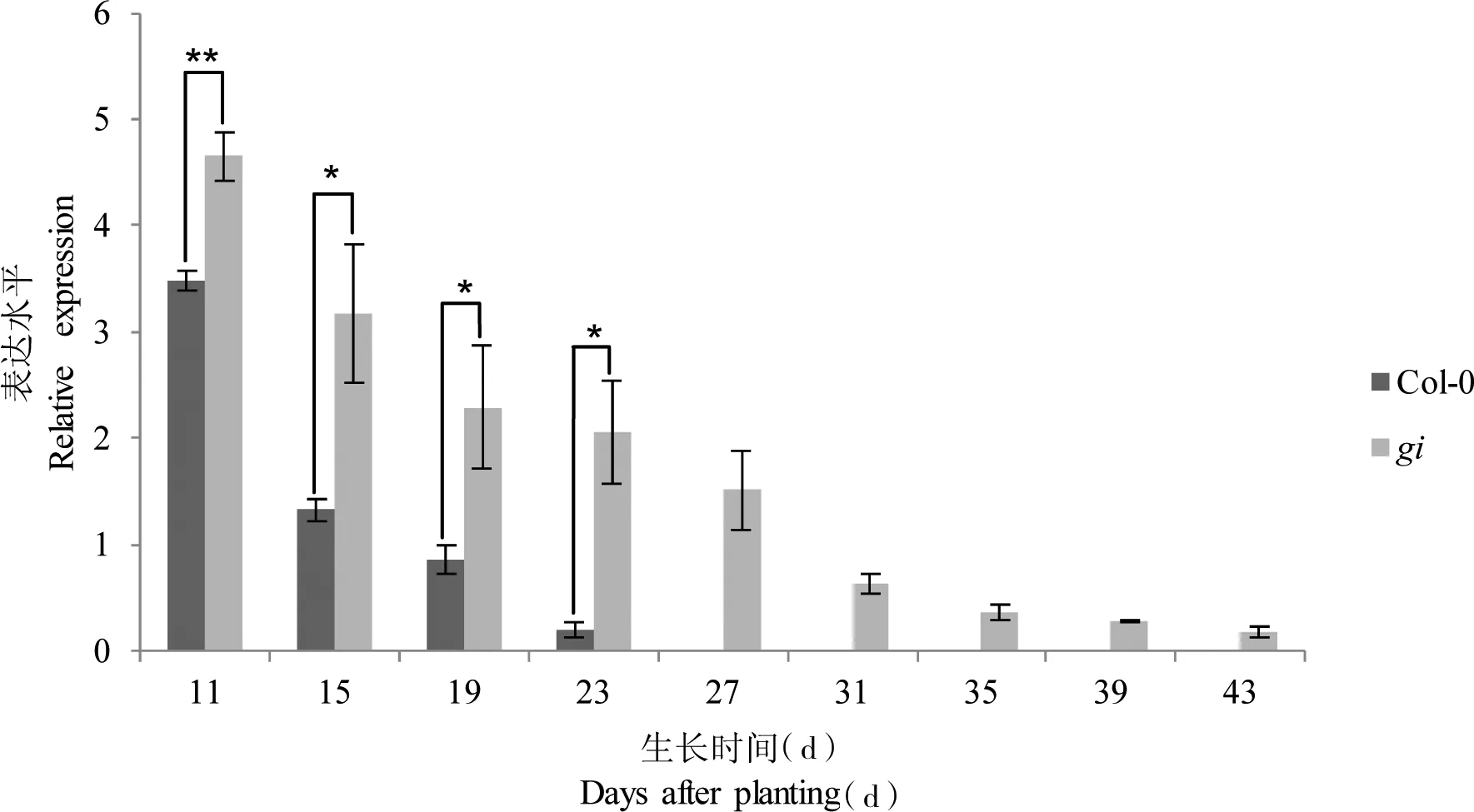
图 4 Col-0与gi不同发育过程中Q-PCR检测miR156表达Fig 4 Relative expression analysis of miR156 in Col-0 and gi with Q-PCR amplification
Col-o植株在生长第15 d时,miR156的表达量比gi植株在生长第19 d时下降较快,结果表明,突变体相对于野生型Col-o延迟了VPC。*P<0.05 (Student′st-test); **P<0.01
本文中,我们从观察突变体gi的生长发育进程起始,对其VPC进行了较为详细的研究。结果显示,从形态特点、解剖结构以及调控VPC的miR156表达的分子检测等各方面分析,对比野生型Col-0,gi突变体的VPC延迟;而且,gi突变体全部生长发育历时较长,至第43天才出现可见花芽,果实成熟需要80 d以上,而野生型Col-0在生长约23 d即出现可见花芽,约60 d果实即成熟,说明gi突变体营养生长时期中成熟期被延长,植株进行较长时间的营养生长,产生更多的叶片,导致迟迟不开花,结果期也延长。据此推测,GI可能参与VPC的调控,使得植株从幼龄期及时转变到成熟期,同时,通过和其他开花基因互作,及时完成从营养生长到生殖生长的转变,调控植物正常开花;GI基因突变,导致VPC延迟的同时,也产生晚花、晚结果的表型。此外,我们的前期研究[11]表明,莲座叶数目减少的突变体mgo3推迟了VPC的发生;而莲座叶数目增多突变体amp1-1并未使VPC的发生提前,切除第1、2片真叶推迟了Col-0的VPC发生。本研究中,gi突变体莲座叶叶片总数明显增多,但其VPC延迟;推测突变体幼龄期产生的真叶受GI基因突变影响较大,数量较少,造成VPC发生延迟,而在VPC完成后的成熟期,突变体产生了较多的叶片,使得其成熟期被延长。Yang等[15]通过叶原基切除实验证明,VPC起始于叶原基的信号,这些信号抑制了miR156的转录而起作用,这种叶原基产生的因子可能与植物叶片数量相关。从本研究的结果分析,这种相关性可能更集中在幼龄期叶片的发生上,且也是通过miR156的表达调控的。
SAM的解剖结构在拟南芥发育成熟过程中产生了凸起的变化[11,16]。gi突变体营养生长期间SAM解剖观察表明,突变体茎尖分生组织原套、原体细胞和髓分生组织的高度均低于野生型,且分裂的细胞层数和分化状态发生变化,说明GI活性缺失改变了生长的节律,延迟了SAM的发育,原套产生多层细胞较晚,原体和髓分生组织的细胞发育延迟,使得突变体莲座叶生长速率落后于野生型。GI可能通过调控SAM细胞活性使其发育延缓,从而造成营养生长时相转变的延迟。我们在前期工作[11]的基础上,通过本研究进一步说明VPC的发生与茎尖分生组织中原套、原体细胞和髓分生组织的细胞分化相关,进一步的工作有待GI的时空表达原位杂交定位。
4 小结
我们的研究结果表明GI除了参与开花调控外,也在VPC调控中起作用,因此,GI具有功能冗余作用,这些结果也暗示了营养生长和生殖生长可能存在的发育相关性,其他生物钟基因是否也具有此特性尚待研究。
[1]HUIJSER P, SCHMID M.The control of developmental phase transitions in plants [J].Development, 2011, 138(19): 4117-4129.
[2]POETHIG R S.The past, present and future of vegetative phase change [J].Plant Physi, 2010, 154(2): 541-544.
[3]KNIGHT T A.Observations on the grafting of trees: in a letter from Thomas Andrew Knight, Esq.to Sir Joseph Banks, Bart.PRS [M].London: Philos Trans R Soc Lond, 1795, 85: 290-295.
[4]WU G, POETHIG R S.Temporal regulation of shoot development inArabidopsisthalianabymiR156 and its targetSPL3 [J].Development, 2006, 133(18): 3539-3547.
[5]SOMERS D E.The physiology and molecular bases of the plant circadian clock [J].Plant Physio, 1999, 121(1): 9-20.
[6]SALOMÉ P A, MCCLUNG C R.TheArabidopsisthalianaclock [J].J Biol Rhythms, 2004, 19(5): 425-435.
[7]BAUDRY A, ITO S, SONG Y H, et al.F-box proteins FKF1 and LKP2 act in concert with ZEITLUPE to controlArabidopsisclock progression [J].Plant Cell, 2010, 22(3): 606-622.
[8]IMAIZUMI T.Arabidopsiscircadian clock and photoperiodism: time to think about location [J].Curr Opin Plant Biol, 2010, 13(1): 83-89.
[9]MISHRA P, PANIGRAHI K C.GIGANTEA-an emerging story [J].Front Plant Sci, 2015, 6: 8.
[10]ALABADD, OYAMA T, YANOVSKY M J, et al.Reciprocal regulation betweenTOC1 andLHY/CCA1 within theArabidopsiscircadian clock [J].Science, 2001, 293(5531): 880-883.
[11]卢 阳, 龙 鸿.拟南芥叶片数目变化突变体对营养生长时相转变的影响[J].植物学报, 2015, 50(3): 331-337.
[12]YANG S, WEERS B D, MORISHIGE D T, et al.CONSTANS is a photoperiod regulated activator of flowering in sorghum [J].BMC Plant Biology, 2014, 14: 148.
[13]FOWLER S, LEE K, OMOUCHI H, et al.GIGANTEA: a circadian clock-controlled gene that regulates photoperiodic flowering inArabidopsisand encodes a protein with several possible membrane-spanning domains [J].EMBO J, 1999, 18 (17): 4679-4688.
[14]PARK D H, SOMERS D E, KIM Y S, et al.Control of circadian rhythms and photoperiodic flowering by theArabidopsisisGIGANTEAgene [J].Science, 1999, 285(5433): 1579-1582.
[15]YANG L, CONWAY S R, POETHIG R S.Vegetative phase change is mediated by a leaf-derived signal that represses the transcription of miR156 [J].Development, 2011, 138(2): 245-249.
[16]JACQMARD A, GADISSEUR I, BERNIER G.Cell division and morphological changes in the shoot apex ofArabidopsisthalianaduring floral transition [J].Annals of Botany, 2003, 91: 571-576.

