3种转染试剂在SKOV3细胞中转运大质量质粒的效率比较
朱国念,倪银芸,吴思思
(四川大学 华西医院公共实验技术中心,成都 610041)
在基因治疗中,时常需要使用大质粒,用于传输大编码序列如全长肌营养不良蛋白基因[1]或同时转染含有多个基因的大质粒(如用于诱导多能干细胞重编程)[2]。对于大基因的转染,病毒转染法通常不是最好的选择,因为它们可以携带的总DNA数量有限;此外,它们可能存在许多安全性问题,特别针对临床应用的限制。目前基因治疗研究最多的是通过脂质体介导法、磷酸钙沉淀法、电穿孔法及显微注射法等技术实现[3-4],不同基因转染方法,其转染效率也具有一定的差别。其中脂质体介导法具有安全、操作简便、对细胞毒性低、低免疫原性等特点而得到广泛的应用[5]。然而,在体外脂质体转染效率会随着质粒大小的增加而下降,脂质体包裹外源DNA向细胞质扩散过程中强烈依赖于DNA的大小;同时通过脂质体转染在体内也观察到随着质粒的大小增加时,转染效率下降。另一方面,尽管在阳离子脂质介导的转染中,与小质量分子相比,大质量的质粒在核递送过程中更易受损,已有研究使用等效质量或摩尔浓度的不同大小的构建体观察到这种效应,表明质粒的核递送可能受细胞内转运的速率的限制,小质粒通过快速转运通过细胞质来避免降解,而不是通过饱和细胞防御[6]。
卵巢癌细胞株SKOV3,是用于化学药物及重组载体对肿瘤细胞治疗效果评价的重要细胞系。此细胞也经常用于基因治疗有关功能的研究,在基因敲除实验中细胞实验部分最常采用的是外源基因转染的方法来实现敲除,故采用SKOV3细胞株来研究转染试剂的效率,为以后基因治疗提供更多的基本思路[7-9]。本研究分别用Lipofectamin3000、 FuGENE HD和DNA-In CRISPR 3种转染试剂转染带有绿色荧光蛋白的大质粒pAdeasy-1-EGFP(35 kb)质粒进入SKOV3细胞,以探究较适合转染大质量质粒的转染试剂。
1 材料与方法
1.1 材料
1.1.1 细胞系和质粒
293T细胞、SKOV3细胞、pAdeasy-1-EGFP质粒,均由本实验室提供。
1.1.2 主要试剂
DMEM高糖培养基和胎牛血清购自Gibco公司;Lipofectamine 3000转染试剂购自Invitrogen公司;FuGENE HD转染试剂购自Roche公司、DNA-In CRISPR转染试剂购自Amsbio公司;质粒提取试剂盒购自Omega公司;CCK-8细胞增殖检测试剂盒购自东仁化学。
1.2 方法
1.2.1 质粒制备
在大肠杆菌感受态细胞DH5α中转化pAdeasy-1-EGFP质粒,在培养平板中倒置培养过夜后挑出阳性克隆,在含有卡那霉素抗性的溶菌肉汤培养基(LB培养基)中进行扩大培养,按照质粒提取试剂盒中的产品说明书进行提取纯化,并测定浓度和纯度。
1.2.2 细胞转染
荧光观察:将SKOV3细胞分别按3×104/孔接种于24孔板,待细胞融合至约60%融合度时转染pAdeasy-1-EGFP质粒,每孔转染1 μg质粒。Lipofectamine 3000和DNA-In CRISPR分别以转染试剂(μL)∶质粒(μg)=2∶1的比例配制脂质体-质粒复合物;FuGENE HD则以3∶1的比例配制脂质体-质粒复合物,后续转染步骤分别按每种转染试剂的说明书进行转染操作,在37℃培养24 h后观察分析转染效率。
CCK8检测细胞增殖:将293T细胞和SKOV3细胞分别按1×104/孔接种于96孔板,待细胞融合至约60%融合度时转染pAdeasy-1-EGFP质粒,每孔转染质粒0.1 μg。3种转染按比例配制脂质体-质粒复合物,后续步骤严格按照每种转染试剂的说明书进行操作。37℃培养24 h后检测细胞增殖情况。
1.2.3 荧光显微镜采图
在转染24 h后,更换新鲜的DMEM培养基,使用ZEISS倒置荧光显微镜观察绿色荧光蛋白信号,使用显微镜自带ZEN软件对荧光信号进行采集与分析,以确定荧光细胞的比例。
1.2.4 细胞活性检测
细胞转染24 h后,按照每孔培养基体积∶CCK-8 溶液体积=10∶1的比例加入10 μL的CCK8,在培养箱中继续孵育培养 2 h,在酶标仪450 nm 处测定各孔的吸光度值以此来计算细胞增殖情况。
1.2.5 统计学分析
每组实验重复3次以上,所获得的数据均以统计学分析中平均值±标准差的形式来表示,不同转染试剂组间细胞活性的对比采用单因素方差分析,以P<0.05 表示差异有统计学意义。所有统计均在Graphpad Prism软件中完成分析处理。
2 结果
2.1 293T和SKOV3细胞转染效率比较
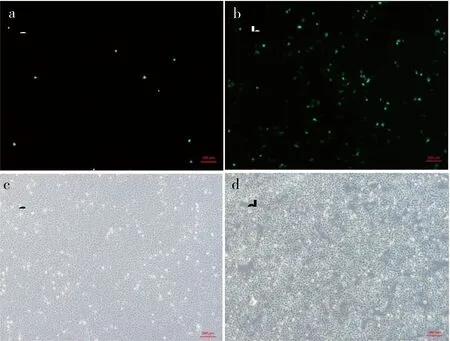
图1 DNA-In CRISPR转染293T细胞和SKOV3细胞后荧光图(5×)Fig 1 The fluorescence of 293T and SKOV3 cells transported by DNA-In CRISPR (5×)
a、b:293T和SKOV3细胞转染荧光; c、d:293T和SKOV3细胞明场
将DNA-In CRISPR(μL)和pAdeasy-1-EGFP质粒(μg)以2∶1的比例配制脂质体-质粒复合物,对293T细胞和SKOV3细胞进行转染,培养24 h后通过荧光显微镜观察荧光信号。结果发现针对这两种细胞,SKOV3细胞转染效率约5%,293T细胞转染效率不到1%(图1)。因此可得,同种转染试剂针对不同细胞其转染效率也会有所不同;而对于SKOV3细胞,需要使用更为合适的转染试剂以此来提高其转染效率。
2.2 3种转染试剂转染SKOV3细胞的效率比较
将Lipofectamine 3000、FuGENE HD、DNA-In CRISPR 3种转染试剂与pAdeasy-1-EGFP质粒以不同比例配制成脂质体-质粒复合物后对SKOV3细胞进行转染,作用24 h后用荧光显微镜观察荧光情况,图像结果表明Lipofectamine 3000(2∶1)的转染效率高于50%;而FuGENE HD(3∶1)的转染效率约20%;DNA-In CRISPR(2∶1)转染效率在5%左右(图2)。
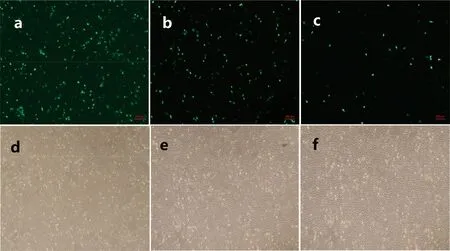
图2 3种转染试剂转染SKOV3细胞荧光(5×)Fig 2 The fluorescence of SKOV3 cells transported by three transfection reagents(5×)
a、b、c:Lipofectamine 3000、FuGENE、DNA-In CRISPR转染SKOV3细胞荧光图; d、e、f:Lipofectamine 3000、FuGENE、DNA-In CRISPR转染SKOV3细胞明场图
2.3 3种转染试剂对SKOV3细胞活性的影响
通过用CCK-8法检测3种转染试剂对SKOV3细胞增殖情况的影响。实验数据显示,Lipofectamine 3000、FuGENE HD和DNA-In CRISPR对SKOV3细胞增殖影响无明显差异,Lipo3000转染SKOV3细胞24 h后细胞活性达到97.5%±2.52%,FuGENE和DNA-In 转染试剂的细胞活性分别为89.5%±2.43%和95.5%±3.48%(图3),3种转染试剂毒性均相对较低。
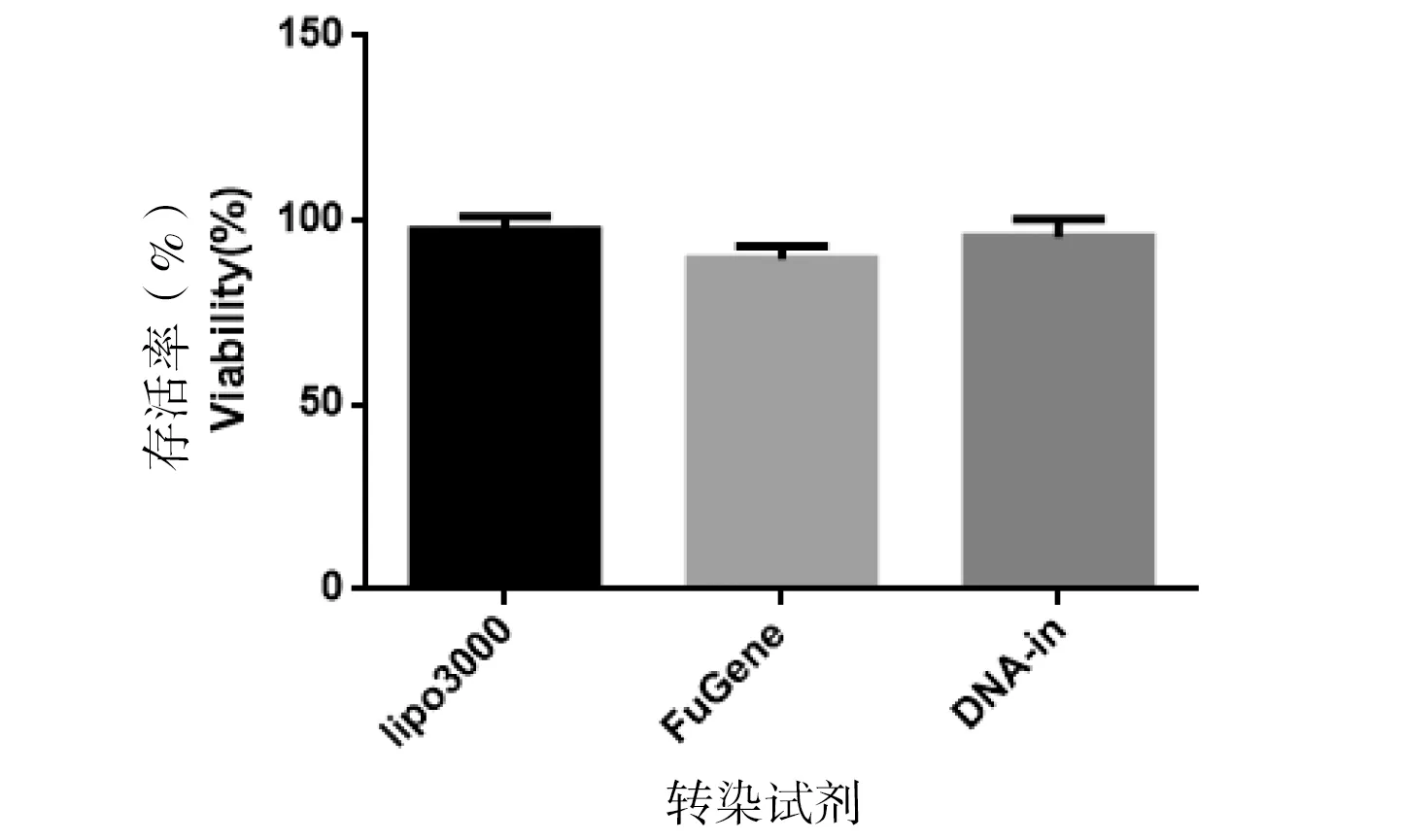
图3 3种转染试剂转染SKOV3细胞24 h后细胞活性Fig 3 The activity of SKOV3 cells transported for 24 hours
3 讨论
目前转染大质粒的研究逐步增多,随着大质粒疫苗和产品的出现,获得一个合格的药用DNA建立稳定宿主菌从而建立生产平台成为一个重大研究方向[10]。除此之外,许多蛋白质表达与功能研究都需要将大质粒转移进入细胞或者菌株内部,多种染色体编码蛋白的丰度发生了变化从而研究大质粒能否调控染色体编码基因的表达[11]。针对不同实验内容,人们通常采用电穿孔法、病毒转染法或使用脂质体介导和腺病毒辅助共转染的方式进行大片段质粒的转染[12-13]。杨蔚等在研究中显示对于MDR胃癌细胞、HepG2细胞,电穿孔转染法不易受其细胞膜成分的影响,能明显提高大片段载体的转染效率[14],但是在李亚等的研究中显示几种转染方法中电穿孔法细胞活力最低[15],此外也有文献显示影响电穿孔法转染效率和细胞活性的因素较多,如脉冲强度、脉冲时间、电穿孔介质、温度、细胞生长状态等,实验过程中诸多因素不易控制。病毒转染法是体外培养神经元、组织切片及体内转染实验效率最高的一种方法,主要病毒载体有腺相关病毒、腺病毒、单纯孢疹病毒、慢病毒等;但考虑到安全性、经济、时间、细胞毒性,此种方法的应用受到一定的限制[16]。
在本研究中,为了能够获得转染pAdeasy-1-EGFP质粒到SKOV3细胞效率较高的转染试剂,我们采用脂质体转染试剂,按转染试剂的比例以及质粒转染量进行调整选择最优的转染大质粒的条件。结果表明阳离子脂质体Lipofectamine 3000转染SKOV3细胞24 h后细胞活性达到97.5%,转染效率大于50%,Lipofectamine 3000转染效率高于FuGENE HD,而DNA-In CRISPR转染效率最低(见图2和3)。有研究表明转染效率到达38.36%以上即为有效的转染手段[17-18],我们的研究结果与此相符合。此外考虑到转染方法对细胞活性会产生重要影响,因此在保证较高转染效率的同时也要尽量减少对细胞的毒性。3种转染试剂转染SKOV3细胞24 h后检测细胞活性结果显示,3种转染试剂的毒性均相对较小,无明显差异(见图 3)。因此综上考虑,在这3种转染试剂中Lipofectamine 3000转染效率最高,而且转染毒性相对较低,更适合用于较大质粒pAdeasy-1-EGFP的转染。
[1]QUENNEVILLE S P, CHAPDELAINE P, ROUSSEAU J, et al.Nucleofection of muscle-derived stem cells and myoblasts with phiC31 integrase: stable expression of a full-length-dystrophin fusion gene by human myoblasts[J].Molecular Therapy: the Journal of the American Society of Gene Therapy,2004,10(4):679-687.
[2]曲鑫建, 刘天庆, 宋克东,等 多顺反子质粒重编程人脂肪干细胞为诱导多能干细胞[J].生物化学与生物物理进展, 2013, 40(5):436-444.
[3]张文智, 李 亚, 王鹏雁,等 三种转染试剂对PEF细胞与BHK细胞转染效率的比较[J].新疆农业科学, 2013,50(4):753-758.
[4]COLOSIMO A, GONCZ K, HOLMES A, et al.Transfer and expression of foreign genes in mammalian cells[J].Biotechniques, 2000,29(2):314-318,320-322,324.
[5]ZHANG C, YADAVA P, HUGHES J.Polyethylenimine strategies for plasmid delivery to brain-derived cells[J].Methods, 2004, 33(2):144-150.
[6]LUKACS G L, HAGGIE P, SEKSEK O, et al.Size-dependent DNA mobility in cytoplasm and nucleus[J].Journal of Biological Chemistry, 2000,275(3):1625-1629.
[7]HE Z, ZHENWU D U, FAN L, et al.Construction of recombinant vector on IL-24 and its effect in combination with chemotherapy drugs for TUBB3 and ERCC-1 expression in SKOV3 cells[J].Chemical Journal of Chinese Universities, 2015,36(5):927-931.
[8]陈 佳, 王 琪, 张 玮,等.下调MTRR基因表达对顺铂耐药的卵巢上皮性癌细胞自噬和凋亡的影响及机制研究[J].中华妇产科杂志, 2016,51(4):285-292.
[9]GU J, TANG Y, LIU Y, et al.Murine double minute 2 siRNA and wild-type p53 gene therapy enhances sensitivity of the SKOV3/DDP ovarian cancer cell line to cisplatin chemotherapy in vitro and in vivo[J].Cancer Letters, 2014,343(2):200-209.
[10]吴 昊, 王 宇, 朱晓明,等.大质粒DNA疫苗pSVK-CAVA高稳定性宿主菌的筛选与鉴定[J].生物技术, 2013,23(1):48-52.
[11]刘红胜, 郭景玉, 冯尔玲,等.鼠疫耶尔森菌201株和201△pCD1株蛋白表达谱比较研究[J].军事医学, 2015,39(5):348-353.
[12]ZHANG G, SU C, JIN X, et al.Recombinant adenovirus-mediated bone morphogenetic protein 9 and erythropoietin genes co-transfection in promoting osteogenic differentiation of adipose-derived stem cells in vitro[J].Chinese Journal of Reparative and Reconstructive Surgery, 2016,30(3):272-278.
[13]GAO G, WILSON J M, ALVIRA M R.Adeno-associated virus (AAV) serotype 8 sequences, vectors containing same, and uses therefor[P].U.S.Patent:7,282,199 B2.2007-10-16
[14]杨 蔚, 张 毅, 钟 玲,等.电穿孔法和化学法在多药耐药胃癌细胞转染中的效果比较[J].中国普通外科杂志, 2015, 24(8):1116-1120.
[15]李 亚, 付 强, 张俊波, 等.巨噬细胞RAW264.7不同转染方法的比较[J].生物技术, 2014,24(2):44-48.
[16]刘俊燕, 赵凤艳, 屈 艺, 等.原代神经元转染方法[J].生命的化学, 2013,33(4):455-460.
[17]郭彩霞,李艳博,王 华,等.大鼠Smac基因的克隆及其在心肌细胞H9C2中的表达[J].吉林大学学报(医学版), 2008, 34(3):369-373,350.
[18]HAN Z C,ZHANG H N,WANG Y Z,et al.Effect of the human insulin-like growth factor 1 gene transfection to human umbilical cord blood mesenchymal stem cells[J].Saudi Medical Journal, 2014, 35(5):435-441.

