红树林沉积物中芘降解菌群及其代谢质粒转化菌的研究
蔡丽希, 陈小萍, 刘黎星
(莆田学院 基础医学部,莆田 351110)
多环芳烃(PAHS)是一类广泛存在于环境中的具有致畸、致癌、致诱变的典型有机污染物[1],尤其是像4环芘一样的高分子量多环芳烃很难被氧化降解,对生态环境和人类健康造成极大的威胁[2-3]。目前微生物修复被认为是治理PAHS污染的最具潜力的修复方法[4]。但是研究工作已经从单一筛选能够降解PAHS的微生物转变为基因调控机制、代谢途径和高效工程菌的研究[5-6]。本实验采用富集培养的方法从海洋红树林表层沉积物中筛选出多环芳烃芘的降解菌群,提取其质粒并导入至大肠杆菌DH5α中,驯化筛选出降解芘的高效基因工程菌群[7],并进一步探讨了该菌群和质粒的降解机制,进而为芘的微生物修复提供重要的科学依据[8]。
1 材料与方法
1.1 材料与试剂
土样采样于海洋红树林区的表层沉积物。
芘购置于Sigma-Aldrich 公司;二氯甲烷、甲醇(色谱纯)购置于江苏汉邦科技有限公司。
海洋细菌培养基:磷酸高铁0.01 g;酵母浸膏1 g;蛋白胨5 g,加陈海水定容至1 L,pH 7.6~7.8。
无机培养基(MSM,mg/L): MgSO4·H2O(200); Na2HPO4(800);(NH4)2SO4(1000);CaCl2·2H2O(100);(NH4)6M0O24·4H2O(1);FeCl3·6H2O(5);KH2PO4(200);pH值为7.2,121℃,灭菌15 min。
芘母液:芘溶解于丙酮并定容为浓度5 mg/mL的母液,经0.22 μm尼龙膜过滤后封口避光保存。
PYR-MSM培养基:依据不同的芘终浓度(50~500 mg/L),移取一定体积的芘母液到无菌的无机培养基中,过夜待丙酮挥发后使用。
1 .2 实验方法
1.2.1 环境样品的富集培养
分别称取10 g新鲜红树林表层沉积物样品和8 g无菌小玻璃珠,置于盛有90 mL无菌水的锥形瓶中,25℃,150 r/min恒温震荡3 h[9]。静置30 min后,移取5 mL上清液至45 mL新配置的以芘为唯一C源与能源的PYR-MSM培养基中(芘终浓度为100 mg/L)。25℃,150 r/min,继续避光振荡培养,每3 d观察锥形瓶中培养液的颜色和浊度的变化。一个月后,转接5 mL的上层培养液到新配制的45 mL PYR-MSM培养基中(200mg/L),富集驯化培养一个月,再梯度增加芘浓度重复以上步骤;如此共富集驯化培养5个月,获得能够将500 mg/L芘作为唯一C源与能源的降解菌群[10-11]。
1.2.2 质粒的提取
选用本实验室的改良方法:移取1.5 mL芘降解菌群 YL液体培养菌液至已灭菌的离心管中,在4℃下12 000 r/min离心30 s,弃上清(尽可能吸干培养液)。加入TAE涡漩振荡洗涤菌体,4℃下10 000 r/min离心收集菌体沉淀,加入100 μL TAE充分混匀菌体,室温静置5 min;加入300 μL冰预冷的 SolutionⅠ(50 mmol/L Tris-Hcl,3(SDS,PH 值为12.61),混匀,65℃水浴8-12 min至液体清亮;加入等体积的氯仿∶异戊醇(24∶1)混合液,轻柔颠倒混匀;4℃下12 000 r/min离心10 min;吸取上清液至5 mL离心管中,加入两倍体积冰预冷的无水乙醇,4℃下静置30 min,12 000 r/min,离心10 min,弃上清,倒扣离心管在吸水纸上,吸干液体。1 mL 70%乙醇洗涤1次,4℃下12 000 r/min,离心1 min,弃上清液,将离心管平放、开盖置于37℃烘箱中干燥。加入20 μL无菌去离子水-20℃保存[10-11]。
1.2.3 感受态细胞制备和转化
移取30 μLE.coliDH5α菌液,接种于3 mL LB液体培养基中,37℃、200 r/min恒温培养3 h;将上述培养液平均分装至2支离心管中,于4℃下4000 r/min离心10 min收集菌体,弃上清液;振荡使菌体悬浮于1 mL冰预冷的100 mmol/L CaCl2溶液,以台式高速离心机最大转度离心30 s,弃上清,每管加入100 μL冰预冷的0.1 mol/L CaCl2溶液并轻缓悬浮细胞,4℃冰箱放置16 h后使用效果最好,可保存一周。移取2 μL本实验室改良方法提取的质粒反应液于50 μL感受态细胞中,轻柔转动混匀并冰浴30 min后,放入42℃水浴中热击90 s,立即放冰上2min。每管加入450 μL SOC培养基,37℃复苏60 min。
1.2.4 降解芘质粒的筛选与鉴定
移取30 μL质粒转化菌液,接种于芘浓度为0.1 mg/L的PAHs-LB培养基中,37℃,150 r/min避光培养过夜。取2 mL质粒转化菌液至18 mL PAHs-MSM培养基(芘浓度为50 mg/L)中,25℃,150 r/min,避光培养,定期观察三角瓶中培养液的颜色和浊度的变化。一个月后,转接2 mL的上层液至新配制的18 mL PYR-MSM培养基中(芘终浓度为100 mg/L),避光富集驯化一个月,再梯度增加芘浓度重复以上步骤;如此富集驯化培养共进行5个月,获得能够以芘为唯一C源与能源的质粒转化菌群。
分别移取原大肠杆菌E.coliDH5α及经诱导含降解芘基因的质粒转化菌,接种至PAHs-MSM培养基中(50 mg/L),25℃,150 r/min避光培养,每3 d取样1次。
1.2.5 芘降解菌群YL和质粒转化菌对芘降解效果的测定
移取芘降解菌群YL和质粒转化菌液至海洋细菌培养基上培养50 h,离心收集菌体,振荡使菌体悬浮于MSM培养液,离心,再重悬去除海洋细菌培养基中的碳源,移取相同体积的菌液至新配制的20 mL PYR-MSM培养基(50 mg/L)中,25℃,150 r/min振荡避光培养。每3 d取1次样,共取样7次。21 d后,在培养液中以盐酸调pH值为2并加入二氯甲烷,40°C以下超声萃取振荡30 min。后用分液漏斗萃取2次并定容。取2 mL样品用0.22 μm尼龙膜过滤后,于Agilent高效液相色谱仪检测。设未加菌的PYR-MSM (50 mg/L)为空白对照。进样量20 μL,流量1 mL/min,流动相为甲醇/Mllli-Q水(90∶10),柱温30℃,检测波长为239 nm。 Agilent化学工作站进行数据处理及分析。
2 结果与分析
2.1 从红树林沉积物中富集分离芘降解菌群
细菌在降解多环芳烃过程中会释放某种或某些中间产物,使培养液的颜色发生一定的变化[12]。Grifoll等发现多环芳烃在降解去除过程中会产生一些橙黄色物质,培养液的颜色随即发生变化,同时水相由澄清变浑浊,表明存在以 PAHs为碳源的降解菌株[13]。在我们的研究中,环境样品加入唯一碳源和能源——芘进行富集培养,经过1个月的驯化培养后,培养液颜色由乳白色(无机培养基加入一定浓度芘后会由无色透明转变为乳白色)→白色混浊→淡黄色有丝状条带→稳定不变;在随后4个月的富集驯化过程中,均可看到上述颜色变化且变化所需时间间隔逐渐缩短。表明随着PAHs接触时间的延长,微生物生长的延滞期逐渐缩短,培养液中的微生物及其酶体系已适应高浓度芘存在的环境且降解能力在增强,其混合微生物可以利用芘作为生长基质繁殖生长。
2.2 芘降解菌群YL对多环芳烃的降解
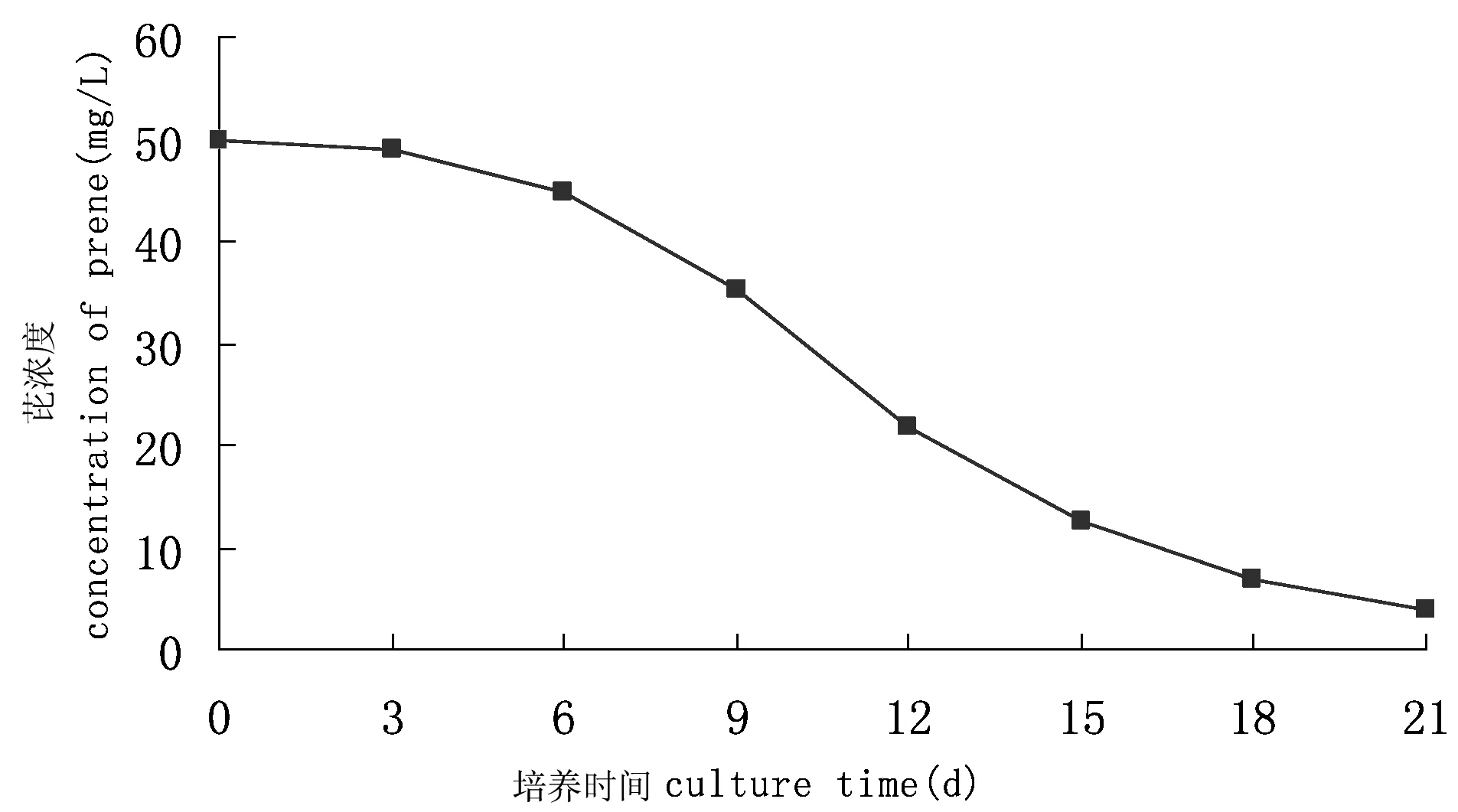
图1 芘降解菌群YL对多环芳烃芘的降解曲线Fig 1 The degradation curve of pyrene by YL
芘降解菌群YL在21 d内对芘的降解率如图1所示。在0~6 d内,芘降解率处于较低的水平,推测菌群刚投放至高浓度芘的环境时,受到芘的胁迫与毒害,菌体利用外源底物需用一定的时间,因而显示出较低的降解率。从第7天开始,芘降解的幅度增大,可能是因为菌群已适应培养环境并利用其中某种细菌的降解中间产物作为营养物质,同时已被驯化利用芘作为碳源与能源。从第15天开始,芘降解出现停滞期,其后虽然继续降解,但速率相当缓慢。原因可能是随着培养基中的芘数量减少,使C源不足,降解过程中产生的某些中间代谢产物抑制细菌对芘的进一步利用,这有待于进一步的研究考证。在培养的第21天,测定培养液中剩余的芘浓度为3.95 mg/L,相应的降解率92.09%;空白对照瓶中芘的回收率达到92.9%以上,表明非生物因子对芘降解的影响很小,可视为对照样无变化。说明芘降解菌群YL中存在着能很好地利用芘作为底物的微生物。
2.3 转化菌的芘降解能力
2.3.1 降解芘质粒的筛选与鉴定
PAHs在降解过程中会产生某种或某些中间产物,使培养液的颜色发生变化。质粒转化菌在富集培养的前2个月未像芘降解菌群YL发生颜色变化,第3个月后,颜色由乳白色→白色混浊→粉红色伴有丝状沉淀→稳定不变,表明带有降解基因的质粒转化菌需要一定时间适应环境并诱导产生相应的酶后,才可以利用芘作为唯一碳源和能源生长。
在芘含量为50 mg/L的无机培养基中加入原大肠杆菌E.coliDH5α及驯化得到的质粒转化菌,两者对芘的降解率的结果如表1所示,培养21 d后,质粒转化菌培养液中芘含量由50 mg/L下降到7.155 mg/L,相应降解率为85.69%,而对照物受体菌E.coliDH5α的芘去除率仅为2.01%。由此表明质粒转化菌具有不俗的芘降解能力,携带芘降解基因的重组质粒已成功转化进E.coliDH5α,并稳定地发挥降解作用。
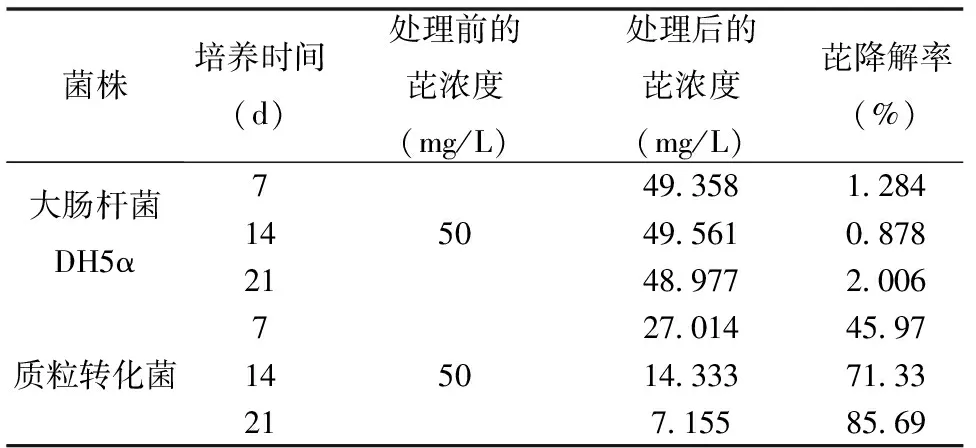
表1 质粒转化菌与大肠杆菌DH5α芘降解率的对比Table 1 The comparison of the degradation rate of pyrene by DH5α and the transformed bacteria
2.3.2 质粒转化菌对芘的降解
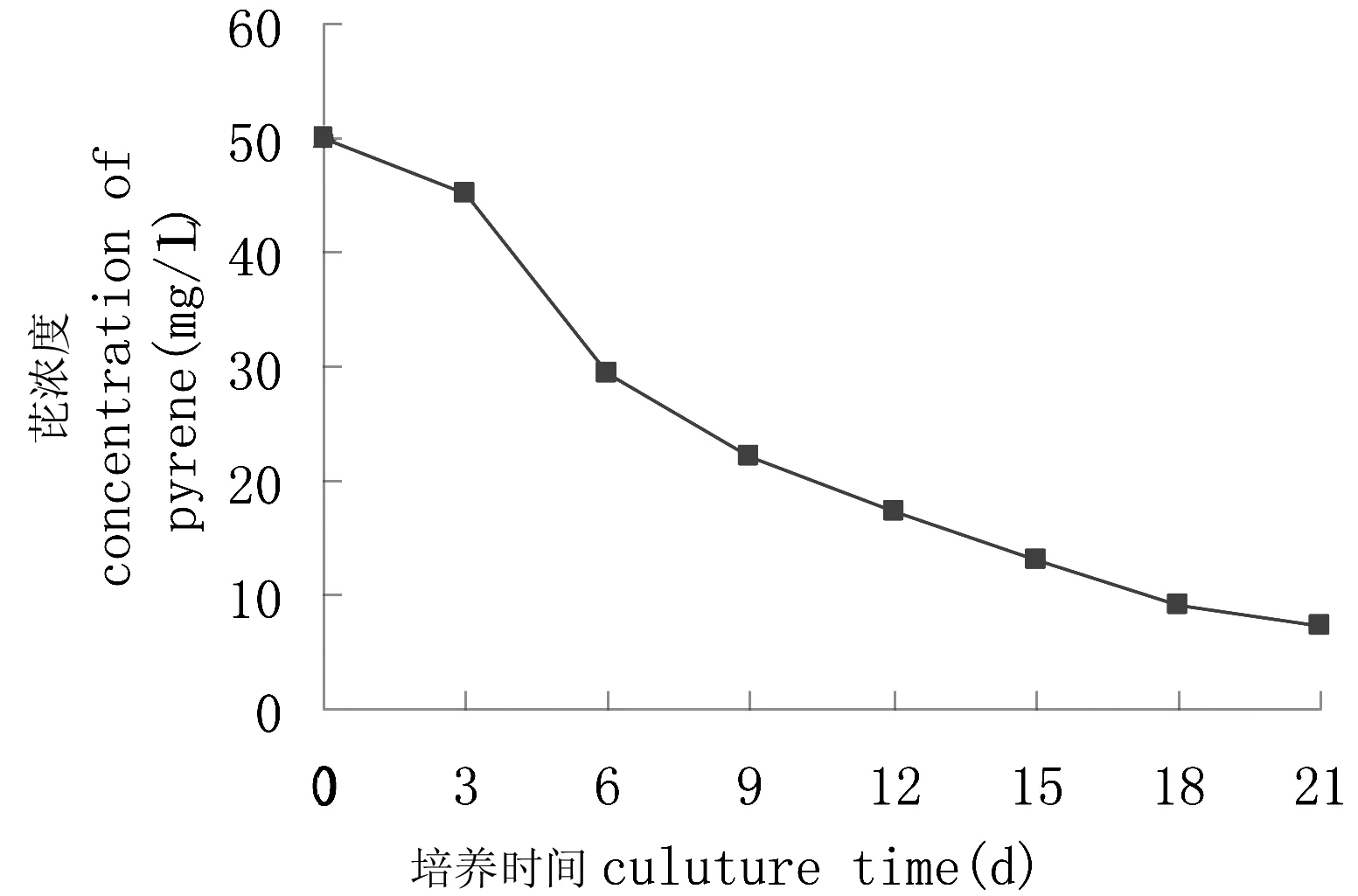
图2 转化菌对芘的降解曲线Fig 2 The degradation curve of pyrene by the transformed bacteria
相比于降解菌群YL降解芘的情况,质粒转化菌的降解趋势不一样,在刚投放时,质粒转化菌的适应期缩短了近一半,而且即使是在适应期也具有一定的降解作用;在第3~6天,降解幅度最大;在培养的第6天,测定培养液中剩余芘的浓度为29.40 mg/L,相应的降解率为41.2%;7~18 d,芘的降解幅度逐渐减小并在18~21 d时趋于平缓。原因可能是随着芘的消耗,过低浓度的芘不利于与质粒转化菌的充分接触,使得可利用的碳源与能源减少,受芘诱导产生的酶量也相应减少,芘降解受到一定的抵制,这有待于进一步研究考证。最后第21天,测定培养液中剩余的芘的浓度为7.155 mg/L,相应的降解率为85.69%;而未加菌液的对照瓶中芘的回收率达到90%以上,非生物因子对多环芳烃芘的降解影响很小,仍可视为对照样无变化。说明质粒转化菌能够利用芘作为唯一的碳源与能源并繁殖生长。质粒转化菌具有不俗的降解芘的能力,其重组质粒上携带降解芘的基因。
3 结论
目前研究表明,负责PAHS降解的基因簇有的位于染色体上[14],有的位于质粒上[15-16],能够降解多环芳烃的代谢酶通常是由细菌的质粒基因编码的[17]。本课题通过比较受体菌大肠杆菌与质粒转化菌的芘降解率,表明与多环芳烃降解有关的基因位于芘降解菌群的内生质粒上,并且通过导入质粒的方法成功地创造出具有不俗降解能力的新菌株。为利用重组工程菌进行多环芳烃的生物修复奠定理论基础与实验基础[18-19]。
[1]HUA F,WANG H.Uptake modes of octadecane byPseudomonassp.DG17 and synthesis of biosurfactant [J]. Journal of Applied Microbiology,2012,112(1):25-37.
[2]陈远志.Mycobacteriumsp.WY10的特性及其对菲和芘的降解研究[D].杭州:浙江大学.2017:1-7.
[3]刘 鑫,黄兴如,张晓霞,等.高浓度多环芳烃污染土壤的微生物-植物联合修复技术研究[J].南京农业大学学报,2017,40(4): 632-640.
[4]BOURGUIGNON N,ISAAC P,ALVAREZ H,et al.Enhanced polyaromatic hydrocarbon degradation by adapted cultures of actinomycete strains [J].Journal of Basic Microbiology,2014,54(12):1288-1294.
[5]GUZIK U,HUPERT-KOCUREK K,SITNIK M,et al.High activity catechol 1,2-dioxygenase fromStenotrophomonasmaltophiliastrain KB2 as a useful tool in cis-muconic acid production [J].Antonie van Leeuwenhoek,2013,103(6): 1297-1307.
[6]CHEN K,ZHU Q,QIAN Y G,et al. Microcalorimetric investigation of the effect of non-ionic surfactant on biodegradation of pyrene by PAH-degrading bacteriaBurkholderiacepacia[J]. Ecotoxicology and Environmental Safety,2013,98(12): 361-367.
[7]VERDIN A,SAHRAOUI A L H,DURAND R.Degradation of benzo[a]pyrene by mitosporic fungi and extracellular oxidative enzym[J].International Biodeterioration & Biodegradation,2004,53(2): 65-70.
[8]KONECKA E,BARANEK J,BIELINSKA I,et al.Persistence of the spores ofB.thuringiensissubsp. kurstaki from Foray bioinsecticide in gleysol soil and on leaves [J]. Science of the Total Environment,2014,472(8): 296-301.
[9]周作明,郑 娜,方柏山.活性污泥驯化过程中芘降解菌的群落多样性分析[J].湖南农业大学学报(自然科学版), 2009,35 (6): 694-698.
[10]许晓毅,苏 攀,姬 宇,等.沉积物中 2 株多环芳烃降解菌的分离鉴定及其对菲、荧蒽的降解特性[J].环境工程学报, 2009,9(3):1513-1520.
[11]蔡丽希,许桂芬.芘降解质粒提取方法的研究[J].生物技术通报,2009,202(5): 92-95.
[12]魏 妍,杨娇艳,王文玲,等.多环芳烃降解菌的筛选及其对天然水的净化效果分析[J].化学与生物工程,2010, 27(12):56-60.
[13]张宏波, 林爱军, 刘 爽,等.芘高效降解菌的分离鉴定及其降解特性研究[J].环境科学, 2010,31(1):243-248.
[14]SATIO A,IWABUCHI T,HARAYAMA S.A novel phenanthrene dioxygenase fromNocardioidessp. strain KP7: expression inEscherichiacoli[J]. Journal of Bacteriology,2000, 182(8):2134-2141.
[15]CHO J C,KIM S J.Detection of mega plasmid from polycyclic aromatic hydrocarbon-degradingSplingomonassp.strain 14[J].Microbiol Biotechnol,2001, 3(4):503-506.
[16]TANG S Y, BAI J Q,YIN H,et al. Tea saponin enhanced biodegradation of decabromodiphenyl ether byBrevibacillusbrevis[J].Chemosphere,2014, 114: 255-261.
[17]宋 蕾,王 慧,施汉昌,等.1,2,4-三氯苯降解菌的分离及其降解质粒的研究[J].中国环境科学,2005,25(4):385-388.
[18]WOJCIESZYNSKA D,HUPERT-KOCUREK K,JANKOWSKA A,et al.Properties of catechol 2,3-dioxygenase from crude extract ofStenotrophomonasmaltophiliastrain KB2 immobilized in calcium alginate hydrogels[J]. Biochemical Engineering Journal,2012:66(6): 1-7.

