慢病毒介导CDCA5敲低的三阴乳腺癌细胞的构建及鉴定
吕璐冶,黄燕,李万金,韩秋影,宋楠,张学敏,周涛
国家生物医学分析中心,北京 100850
乳腺癌是一类发生在乳腺腺上皮组织的恶性肿瘤[1],其发病率位居女性肿瘤第一位,约占女性新发肿瘤的30%,致死人数占女性肿瘤死亡总人数的14%[2-4]。其中三阴乳腺癌(triple-negativebreast cancer)患者约占乳腺癌患者总体病例的20%,其特点是肿瘤细胞缺乏雌激素受体(estrogenreceptor,ER)、孕激素受体(progesteronereceptor,PR)和人表皮生长因子受体2(humanepidermalgrowthfactor receptor2,HER2)的表达[5-7]。与非三阴乳腺癌相比,三阴乳腺癌往往具有较快的肿瘤进程和较强的侵袭性,并且对化疗响应差。患者发病5年内具有较高的复发率及死亡率[8-10]。目前临床使用的主要治疗手段如手术、放化疗、免疫治疗、内分泌治疗等,对三阴乳腺癌治疗效果有限,因而寻找新的三阴乳腺癌治疗靶点具有重要意义[9,11]。
细胞分裂周期相关蛋白5(celldivisioncy⁃cleassociated5,CDCA5)是细胞周期有丝分裂检查点重要复合物——Cdh1激活的后期促进复合物(anaphase-promotingcomplex,APC)的底物,参与调节姐妹染色单体与黏连蛋白的结合[12-14]。CDCA5在脊椎动物中广泛表达,保守性强,且在其他种类生物如酵母、爪蛙卵中存在同源基因,同样参与调节黏连蛋白与染色体之间的相互作用[13]。有研究指出,敲除CDCA5显著影响G2期细胞维持黏连蛋白与DNA稳定结合[15]。近年研究发现CDCA5在多种亚型肺癌中高表达,超过70%的非小细胞肺癌呈CDCA5阳性,并且指示不良预后[16]。但是CDCA5作为癌基因,在乳腺癌及其他肿瘤中是否发挥作用有待研究。
RNA干扰(RNAinterference,RNAi)技术是一种能够特异性敲低或沉默体内目的基因表达的分子生物学技术[17-18],具有高效、稳定、特异性强、可遗传等优点,是生物学研究的重要工具[19-21]。慢病毒载体是一种基于逆转录病毒发展出的基因载体,能够高效地将外源基因整合进宿主细胞,并持续稳定表达。慢病毒载体的应用克服了瞬转过程中转染效率差、干扰RNA表达时间短等问题,目前在生物学研究中已得到广泛应用。
本实验室前期研究表明CDCA5蛋白在三阴乳腺癌患者癌组织中高表达,且与患者不良预后存在正相关,指示CDCA5在三阴乳腺癌中可能存在重要功能。为深入探讨CDCA5在三阴乳腺癌增殖、转移中的作用及相关分子机制,我们应用慢病毒感染体系和RNAi技术,构建了稳定干涉CDCA5表达的三阴乳腺癌细胞MDA-MB-231,为进一步研究提供重要的实验材料。
1 材料与方法
1.1 材料
MDA-MB-231细胞、用于病毒包装的HEK293细胞来源于本实验室细胞库;大肠杆菌DH5α感受态细胞购自Genstar科技有限公司;pLKO.1空载体质粒(嘌呤霉素抗性)、对照组质粒来源于本实验室质粒库。
限制性核酸内切酶、T4DNA连接酶购自Ther⁃moFisherScientific有限公司;核酸胶回收试剂盒、小提质粒提取试剂盒均购自Promega公司;Opti-MEM、DMEM培养基、RPMI1640培养基、磷酸钙转染试剂、抗生素(青霉素、链霉素)、胰蛋白酶均购自迈晨科技有限公司;胎牛血清购自Hy⁃clone公司;2×上样缓冲液购自北京鼎国科技有限公司;蛋白质转印PVDF膜购自GEHealthcare公司;免疫印迹用兔抗人CDCA5抗体购自SigmaAl⁃drich公司;鼠抗人Tubulin抗体购自CellSignal⁃lingTechnology公司;辣根过氧化物酶标记的兔抗人二抗购自Jakson公司;ECL显影试剂购自威哥拉斯公司;CellTiter96AqueousOneSolution CellProliferationAssay购自Promega公司。
细菌培养箱购自上海一恒科技有限公司;PCR仪购自Biometra公司;恒温金属浴购自杭州恩盛公司;恒温摇床购自上海恒智公司;细胞孵箱购自SANYO公司;蓝光切胶仪购自无锡博弗瑞德公司;核酸电泳仪购自Bio-Rad公司;荧光仪购自TECAN公司;常温高速离心机购自Sigma公司;低温高速离心机购自Eppendorf公司;细胞操作台购自Airtech公司。
1.2CDCA5短发夹RNA(shRNA)引物设计
在 PublicTRCPortal(https://portals.broadinsti⁃tute.org/gpp/public/)和 Sigma网站(https://www.sig⁃maaldrich.com/)在线设计人源CDCA5特异shRNA干涉序列,选择其中2条得分较高且适用于pLKO.1载体构建的序列(表1、2)。
1.3CDCA5shRNA慢病毒质粒的构建与鉴定
①将合成的CDCA5shRNA单链引物稀释至10μmol/L,取互补的单链引物(1#F和1#R,或2#F和2#R)对应等量混匀;②取混合液5μL,加入5μL10×退火缓冲液、40μLddH2O配制成引物退火体系,置95℃水浴锅中加热15min,停止加热4h后体系温度达到室温,完成退火;③取pLKO.1空载体质粒5μg,加入10×缓冲液、限制性内切酶EcoRⅠ和AgeⅠ各5μL,用ddH2O补齐至50μL酶切体系,于37℃水浴锅中酶切1h;④将酶切产物加入1.5%琼脂糖核酸胶中,130V恒压进行凝胶电泳,根据酶切位点确定目的片段大小并切下目的条带,用胶回收试剂盒回收载体酶切DNA片段;⑤各取回收的pLKO.1酶切片段和shRNA引物1μL退火,加入T4DNA连接酶和缓冲液各1μL,与6μLddH2O混合均匀,室温连接2h;⑥将30μL大肠杆菌DH5α感受态细胞置于冰上,加入5μL连接产物混匀,配制成转化体系,30min后在42℃水浴锅热激90s,迅速冰浴10min;⑦向转化体系中加入无抗LB液体培养基500 μL,37℃摇床孵育1h,3000r/min常温离心3min后弃300μL上清,重悬菌液,均匀涂布于LB固体培养基(含氨苄青霉素),37℃细菌孵箱中过夜;⑧用限制性内切酶EcoRⅠ和AgeⅠ对LB固体培养基中的单克隆进行双酶切,产物通过核酸胶电泳鉴定;⑨选取有明显条带的阳性单克隆菌落分别加入5mLLB液体培养基(含氨苄青霉素)进行培养,用试剂盒提取质粒并测序。

表1 CDCA5干涉靶序列

表2CDCA5shRNA引物序列
1.4 病毒包装、感染
在10cm培养皿内接种1×106HEK293细胞,待细胞贴壁,细胞密度达到50%左右时进行病毒包装:①将 VSVG(1.5 μg)、PAX2(4.5 μg)、对照组质粒或CDCA5干涉质粒(6μg)加入1mL HBS中,轻柔混匀,室温静置5min;②向该混合液中缓慢加入67μLCaCl2,混匀后室温静置15 min;③将混合液逐滴均匀加入HEK293细胞中,转染10h后更换为10mLDMEM完全培养基;④分别于转染后48和72h收集病毒,48h第一次收集培养上清并补加新鲜培养基,室温1500r/min离心5min,取上清在50mL离心管中于4℃保存,72h第二次收集病毒;⑤将2次收集的上清液混匀,1500r/min离心5min;⑥取培养基上清加入病毒浓缩柱中,6000r/min低温离心30 min,收集滤芯中含病毒培养基,-80℃储存;⑦将2×106MDA-MB-231细胞接种于10cm培养皿,待完全贴壁后更换为10mL含8μL促感染剂聚凝胺(Polybrane)的RPMI1640完全培养基;⑧向MDA-MB-231细胞中均匀滴加浓缩后病毒,恒温细胞孵箱培养24h;⑨撤去含病毒培养基,更换为含嘌呤霉素(2μg/mL)的RPMI1640完全培养基继续培养,直至细胞无大面积死亡,完成筛选。
1.5 细胞感染后的干涉效果和增殖能力检测
将用嘌呤毒素筛选过的表达稳定干涉质粒的MDA-MB-231细胞培养皿置于冰上,弃掉培养基,用PBS清洗2次,用细胞裂解液(20mmol/L pH7.4Tris-HCl,3mmol/LEDTA,3mmol/LEG⁃TA,0.5%NP40,250mmol/LNaCl,50×Cocktail)裂解10min,收集裂解产物,12000r/min低温离心3min,收集上清加入等量2×上样缓冲液混匀,105℃金属浴加热30min,使样品蛋白质充分变性,用Western印迹检测CDCA5蛋白的表达水平。
将筛选后的MDA-MB-231细胞进行消化处理,将对照组和干涉组细胞用台盼蓝进行活细胞计数,种入7个96孔板中,每孔接种2×103细胞,每种细胞种3个复孔,分别于接种培养的第0、24、48、72、96、120、144h检测每孔细胞活力。
2 结果
2.1 pLKO.1-CDCA5-shRNA质粒构建
利用数据库信息设计了特异针对人源CDCA5进行干涉的引物序列。将退火引物加入DNA核酸胶中进行电泳,发现核酸凝胶最前端出现明显条带(图1),表明引物退火成功。根据需求选取EcoRⅠ和AgeⅠ酶切位点对pLKO.1空载体进行双酶切。将载体片段与退火产物进行连接,构建pLKO.1-CDCA5-shRNA质粒。
2.2 菌液鉴定与质粒测序
将2种CDCA5干涉质粒进行转化后,分别挑选2株单克隆进行菌落酶切鉴定。PCR产物DNA凝胶电泳结果如图2,核酸胶中1#、2#干涉质粒菌落均有明显条带,表明pLKO.1-CDCA5-shRNA质粒构建成功。培养阳性菌落,提取质粒并测序,将测序结果与shCDCA5-mRNA进行碱基序列比对,发现特异性干涉CDCA5基因的DNA片段成功插入pLKO.1空载体(图3),表明pLKO.1-CDCA5-shRNA质粒构建成功。
2.3 MDA-MB-231中敲低CDCA5的干涉效果检测
将对照组质粒与干涉组质粒用磷酸钙转染法进行病毒包装,收集48与72h含病毒培养基,用100k病毒浓缩柱浓缩病毒,感染人乳腺癌细胞系MDA-MB-231,24h后进行抗性筛选。收集筛选得到的稳定表达干涉质粒的细胞样品,通过Western印迹检测CDCA5蛋白质表达水平,结果见图4,与对照组相比,表达1#、2#干涉质粒的细胞CDCA5蛋白表达水平显著降低,2条干涉序列对CDCA5敲低效果明显。
图1CDCA5干涉序列引物退火结果
图2 菌落酶切鉴定结果
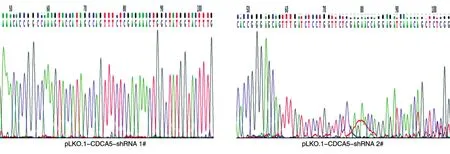
图3 pLKO.1-CDCA5-shRNA质粒测序
2.4 MDA-MB-231中敲低CDCA5后显著抑制细胞增殖能力
细胞完成病毒感染、抗性筛选后,计数种入96孔板,用 CellTiter96AqueousOneSolution CellProliferationAssay分别检测接种后第0、24、48、72、96、120、144h的细胞活力。结果显示,敲低CDCA5能显著抑制MDA-MB-231的细胞增殖能力(图5)。
3 讨论
乳腺癌是女性常见的癌症和主要的癌症致死原因[1-4]。随着社会发展、人口老龄化、生化压力增大及生态环境的恶化,乳腺癌发病率和复发率逐渐升高,并已成为威胁人类生存与社会发展的严重疾病和重大公共卫生问题[3]。而三阴乳腺癌因其恶性程度高、对化疗的不敏感及缺乏ER、PR、HER2等常规靶点的表达,从发现以来便成为人们想要解决的重点问题[5-7,11]。因此,探索和发现三阴乳腺癌中新的基因靶点具有重大意义。
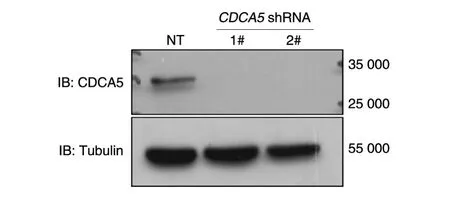
图4CDCA5shRNA敲低CDCA5基因的效果检测
CDCA5在人体多个组织器官中高表达,如骨髓、睾丸、胃、淋巴结、脾脏等,并且在一些癌细胞中也明显高表达,如非小细胞肺癌、口腔鳞状细胞癌、前列腺癌、胃癌等[16,22-24]。且文献报道其与ERK通路、周期蛋白E1等具有相互作用,指示其在癌细胞增殖中发挥重要作用,但是CDCA5在三阴乳腺癌中的生理学功能还有待探索[16,23-24]。
前期,我们通过大数据分析发现CDCA5在三阴乳腺癌细胞中高表达。为了研究CDCA5在三阴乳腺癌中的调控功能,本实验室利用RNAi技术和慢病毒感染体系,构建了稳定干涉CDCA5的MDA-MB-231细胞系。在随后的细胞活力检测实验中,我们发现在干涉CDCA5后能够显著抑制三阴乳腺癌细胞的增殖能力,表明CDCA5在人三阴乳腺癌细胞MDA-MB-231增殖过程中发挥重要作用。那么CDCA5在三阴乳腺癌的发生、发展、转移过程中是否具有调控作用,以及CDCA5对三阴乳腺癌患者抵抗放化疗及复发具有怎样的影响?本研究将为我们进一步探索CDCA5在三阴乳腺癌中的功能及相应机制提供实验基础。
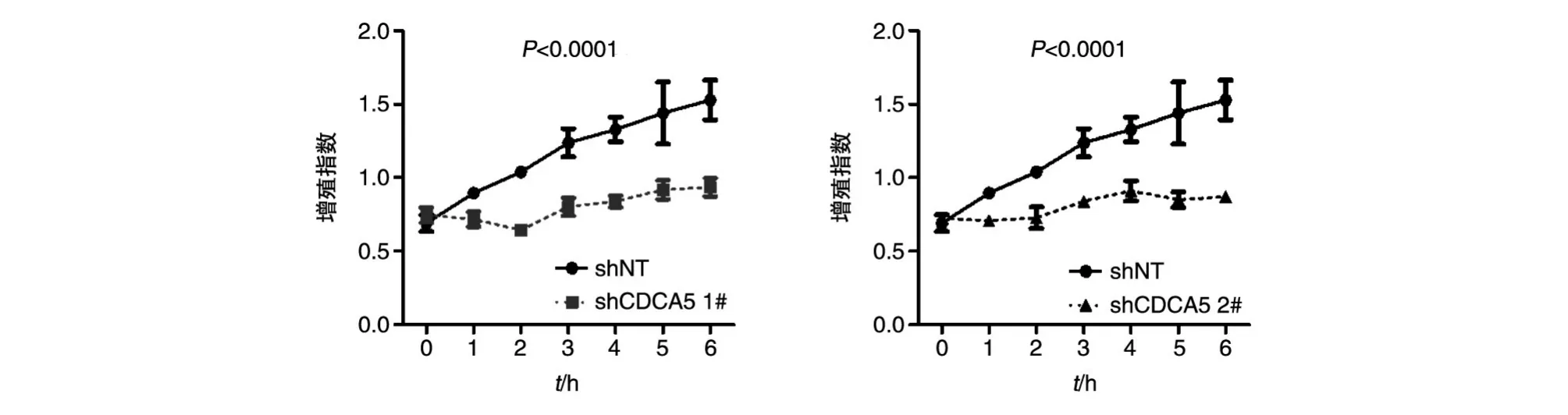
图5 敲低CDCA5抑制MDA-MB-231细胞增殖能力

