基于免疫共沉淀-液质联用技术的新型孕烷X受体配体检测方法的建立
赵爽,姜棋予,孙慧伟,柴燕涛,李晓娟,王志杰,侯俊,赵敏
1.北京大学三〇二临床医学院;2.解放军第三〇二医院 临床研究管理中心;北京 100039
肝炎病毒在我国有很高的感染率,超过8000万人携带肝炎病毒或罹患肝炎病毒引起的各种慢性肝病,尽管对症治疗(如各种抗病毒治疗策略)能够发挥抗病毒作用、延缓疾病恶化,但仍有相当比例的患者最终会进展为肝细胞癌(hepato⁃cellularcarcinoma,HCC),对我国的公共卫生系统以及临床诊疗构成巨大挑战[1]。在此基础上,受限于现有临床诊疗技术,大部分HCC患者初诊即为进展期(advancedHCC),失去手术治疗等根治性治疗的机会,因此抗肿瘤药物治疗具有极其重要的地位[1]。进展期肝细胞癌治疗药物极为有限,主要是多靶标蛋白激酶抑制剂等分子靶向药物,包括惟一的一线治疗药物索拉非尼(sorafenib),以及少数二线治疗药物如瑞戈非尼(regorafenib)或阿帕替尼(apatinib)等[2-4]。尽管索拉非尼的广泛使用能够在一定程度上延长患者生存期、改善患者生存质量,但仅有部分患者(26%~43%)对索拉非尼敏感,而随着治疗的进行,这些对索拉非尼初始敏感的患者,往往会出现对药物的耐受[5]。因此,探究进展期HCC患者接受分子靶向治疗敏感性差异和耐药相关调控机制具有重要意义。
目前,对进展期HCC分子靶向治疗耐药的机制相关研究主要是探索不同信号通路之间的相互作用,如MAPK、PI3K/AKT等[5]。HCC除分子靶向治疗耐药外,还具有对传统细胞毒性化疗药物的多药耐药(multi-drug resistance,MDR)[6]。尽管取得了一些进展,但现有研究理论或模型等涉及的信号通路并非HCC特异的,也难以揭示HCC抗肿瘤耐药的根源。我们的前期研究表明,孕烷X受体(pregnane X receptor,PXR)是一种重要的核受体,多种内/外源小分子药物/毒物都能够作为PXR的配体/激动剂识别和活化PXR,诱导PXR下游基因的表达[7]。PXR的下游基因种类多样、作用广泛,包括各类耐药蛋白(即药物Ⅲ相代谢酶/药物转运体)、细胞色素氧化酶CYP450(即药物Ⅰ相代谢酶/药物氧化代谢酶)、基团转移酶(即药物Ⅱ相代谢酶/基团转移酶)。这些既是人体外源性毒物代谢、清除与解毒所必需的,也是各种药物耐药相关蛋白。PXR作为肝脏对外源性药物和毒物代谢与解毒机制的调控枢纽,活化的PXR最终通过这些代谢相关蛋白加速抗肿瘤药物的代谢与清除等过程,最终影响HCC的治疗效果[8]。由于肝脏是人体代谢中心,而HCC细胞具有更为旺盛的物质摄取和代谢特性,因此PXR介导的抗肿瘤药物的代谢与清除机制可能是HCC对抗肿瘤药物MDR的根本来源和特异性机制。
综上所述,作为配体依赖的转录因子(核受体),PXR的活性与其配体/激动剂等密切相关。抗肿瘤药物、农药、环境污染物及各类固醇类激素等小分子物质,都有可能作为PXR的配体参与调控抗肿瘤药物耐药,研究与确证这些小分子与PXR的相互作用具有重要意义[8]。但目前的研究技术存在诸多限制:萤光素酶报告基因实验、细胞免疫荧光与核质分离、染色质免疫共沉淀等技术仅可在细胞体系中观测小分子化合物对核受体等生物大分子的影响[9];表面等离子共振(sur⁃facep lasmon resonance,SPR)等技术对设备要求较高,也难以直接观测生物大分子与小分子的相互作用[10];对蛋白质等生物大分子可使用抗原-抗体相互识别进行检测,而传统生物医学研究技术、策略难以检测与识别小分子化合物。为解决这一问题,我们选取已知的PXR激动剂利福平为模型药物,采用免疫共沉淀技术,形成生物大分子PXR与小分子利福平的复合物,利用免疫印迹实验识别复合物中的蛋白分子,用液相色谱与质谱联用技术(LC-MS/MS)识别复合物中的小分子,最终建立了基于免疫共沉淀-液质联用技术的新型PXR配体检测方法。
1 材料与方法
1.1 材料
HEK293细胞,肝细胞癌细胞HepG2,前列腺癌细胞系LNCaP、PC-3由本实验室保存;带有Flag标签的雄激素受体(androgen receptor,AR),PXR表达载体,PXR下游基因CYP3A4启动子区序列(XREM与PXRE区域)的萤光素酶报告基因载体XREM-Luc、PXRE-Luc,AR应答元件(andro⁃gen response element,ARE)报告基因载体(ARELuc)等由本实验室保存[11-13];利福平(Rifampicin)购自Selleck公司;雄激素二氢睾酮(dihydrotestos⁃terone,DHT)购自Sigma公司;常规细胞培养试剂[DMEM培养基、RPMI1640培养基、胎牛血清(FBS)等]购自Hyclone公司;细胞培养瓶和培养板等实验耗材购自Corning公司;1.5mLEP管购自Eppendorf公司;真核细胞转染试剂Lipo⁃fectAMINE 2000为Invitrogen公司产品;Flagbeads、Flag抗体、乙腈(acetonitrile,ACN)及二甲亚砜(dimethylsulfoxide,DMSO)等为 Sigma公司产品;蛋白印迹实验使用的化学发光试剂盒为北京天根公司产品;常规仪器均由本实验室提供;液相色谱-质谱联用设备由中国医学科学院基础医学研究所提供。
1.2 细胞培养和转染
HEK293细胞于37℃、5%CO2条件下培养于添加10%FBS的RPMI1640培养液中;HepG2细胞于37℃、5%CO2条件下培养于添加10%FBS的DMEM培养液中。在真核细胞转染过程中,细胞培养至指数增长期,待其状态良好时进行实验,取0.5μLLipofectAMINE2000试剂与Flag-AR、Flag-PXR表达载体(用5μL无血清无抗生素的DMEM培养液充分溶解与稀释)分别加入2个EP管中,每管添加24.5或20μL无血清无抗生素的DMEM培养基,充分混匀后室温静置15min,最后将2管液体等量混合,轻轻混匀后室温静置15 min即为转染工作液。细胞换为无血清培养基,将配制所得转染工作液轻轻、缓慢加入细胞中,37℃孵育4h后换液,用含10%FBS的培养液持续培养细胞。
1.3 药物配制
用精密天平称取药物,用DMSO充分溶解药物。对于小分子、蛋白结合实验,药物用DMSO溶解后,用生理盐水稀释,终浓度为1μmol/L;对于萤光素酶报告基因实验,用DMSO溶解利福平后,配制为10、3、1、0.3、0.1、0.03及 0.01mmol/L等系列浓度梯度的工作液,在进行实验时稀释,最终药物作用于细胞的浓度为 10、3、1、0.3、0.1、0.03及0.01μmol/L,DMSO浓度约为1‰。
1.4 液相色谱-质谱联用实验
用乙腈配制利福平溶液,按照Dompreh等[14]的方法进行液相色谱-质谱联用检测,表1列出具体的实验/检测条件。利福平相对分子质量为823(母离子),在施加电压后利福平离子被打碎,释放出一个相对分子质量约791的分子碎片(为子离子),以在这一过程中的利福平相对分子质量变化(823/791)为其检测特征。
1.5 免疫共沉淀实验
在约2×108HEK293细胞中转染Flag空载体、Flag-AR或Flag-PXR的表达载体48h后收集细胞并裂解,用高盐的免疫共沉淀缓冲液进行免疫共沉淀实验,用Flag-beads将Flag、Flag-AR或Flag-PXR蛋白从体系中分离出来。在此基础上,将Flag-beads-蛋白复合物与1μmol/L利福平溶液于4℃孵育过夜。通过免疫印迹方法检测Flagbeads-蛋白-利福平复合物中的Flag-AR与Flag-PXR,用液相色谱检测复合物中的利福平。按照Ding等[15]的方法进行免疫印迹实验,辣根过氧化物酶(HRP)偶联的Flag单克隆抗体稀释为1∶5000。
1.6 萤光素酶报告基因检测
PXR转录因子活性检测:在HEK293细胞中转染Flag-PXR表达载体以及萤光素酶报告基因表达载体XREM-Luc(含PXR下游基因CYP3A4增强子区域-7836/-7208序列)、PXRE-Luc(含PXR下游基因CYP3A4启动子区域-362/+52序列);在HepG2细胞中转染Flag-PXR表达载体以及萤光素酶报告基因表达载体XREM-Luc。
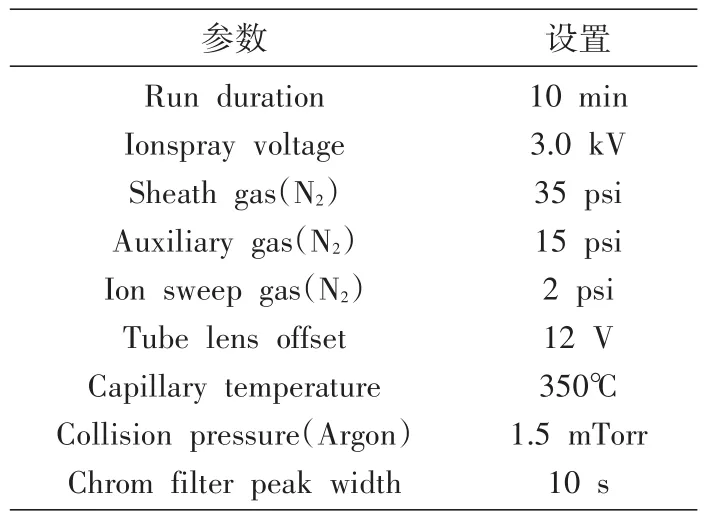
表1 液相色谱-质谱参数
AR转录因子活性检测:在PC-3细胞中转染Flag-AR表达载体及萤光素酶报告基因ARE-Luc表达载体,在LNCaP细胞中转染萤光素酶报告基因ARE-Luc表达载体。
转染实验24h后收集细胞并裂解,依据Yang等的方法检测报告基因的萤光素酶活性[16]。
1.7 统计分析
应用SPSS17.0软件,采用单因素方差分析比较x±s,计算P值。
2 结果
2.1 用液相色谱-质谱联用技术检测利福平
结果如图1,检测到利福平的母离子/子离子对(Pair),表明建立了利福平的液相色谱-质谱联用检测方法。
2.2 Flag-PXR与Flag-AR的免疫共沉淀检测
结果如图2,转染Flag-PXR与Flag-AR的表达载体,能够在HEK293细胞中表达相应融合蛋白;Flag-beads能够从HEK293细胞体系中分离得到Flag-PXR与Flag-AR蛋白。这表明可以利用Flag-beads从HEK293细胞中免疫共沉淀Flag融合蛋白,并用免疫印迹实验对Flag-beads-Flag蛋白复合物中的蛋白质进行检测。
2.3 液相色谱-质谱联用技术检测蛋白-小分子复合物中的利福平
用乙腈将复合物中的利福平萃取出来,采用液相色谱-质谱联用检测,在特异性确证(利用特异性相对分子质量的823/791离子对确证检测到利福平)后,用质谱扫描与记录检测到的823离子信号(图3);在此基础上,能够从利福平溶液(In⁃put)中检测到利福平的液-质信号,从空载体(Flag)组、Flag-AR组微珠中无法检测到利福平,而从Flag-PXR组微珠中能够检测到明确的利福平信号(图4)。这表明,只有PXR而非Flag标签或Flag-AR能够与利福平相互作用。
我们不得不承认,现代诗的进一步成就的学习不能仅仅依靠课堂上的几十分钟,现代诗的美和它的写作艺术都是值得我们学习和考究的。戴望舒在《雨巷》的创作中,不仅将中国诗歌的典雅清韵运用得淋漓尽致,而且还将国外现代诗的精华与之结合,这无疑将现代诗向前推进了一大步。他的大胆和勇敢造就了他,也成就了《雨巷》,成为现代诗的绝唱,使得无数读者被它的美所感染。
2.4 利福平诱导PXR转录因子活性的萤光素酶报告基因活性检测
前述可知,PXR能够与利福平相互作用。为确定利福平作用于PXR的特异性,利用萤光素酶报告基因活性实验检测利福平对PXR转录因子活性的影响,结果如图5,利福平能够剂量依赖地诱导PXR的转录因子活性。在此基础上进一步检测了利福平对AR转录因子活性的影响,结果如图6,利福平不能诱导AR的转录因子活性。转录因子活性实验结果验证了小分子与核受体的相互作用。
3 讨论
进展期肝细胞癌药物研发与临床诊疗面临巨大挑战,阐明抗肿瘤药物耐药的机制,研究与开发逆转耐药的干预策略具有重要意义。我们的前期研究着眼于肝细胞癌自身的特性:肝脏是人体代谢的中心,而HCC细胞具有更为旺盛的物质摄取和代谢特性,因此PXR介导的抗肿瘤药物的代谢与清除机制可能是HCC对抗肿瘤药物MDR的根本来源和特异性机制,最终发现与提出PXR的活化进而诱导抗肿瘤药物代谢与清除,最终造成抗肿瘤药物耐药[3,17]。PXR的配体或激动剂是PXR活化所必需的,因此检测与确证小分子化合物是否能够与PXR结合并相互作用具有重要意义[7-8]。
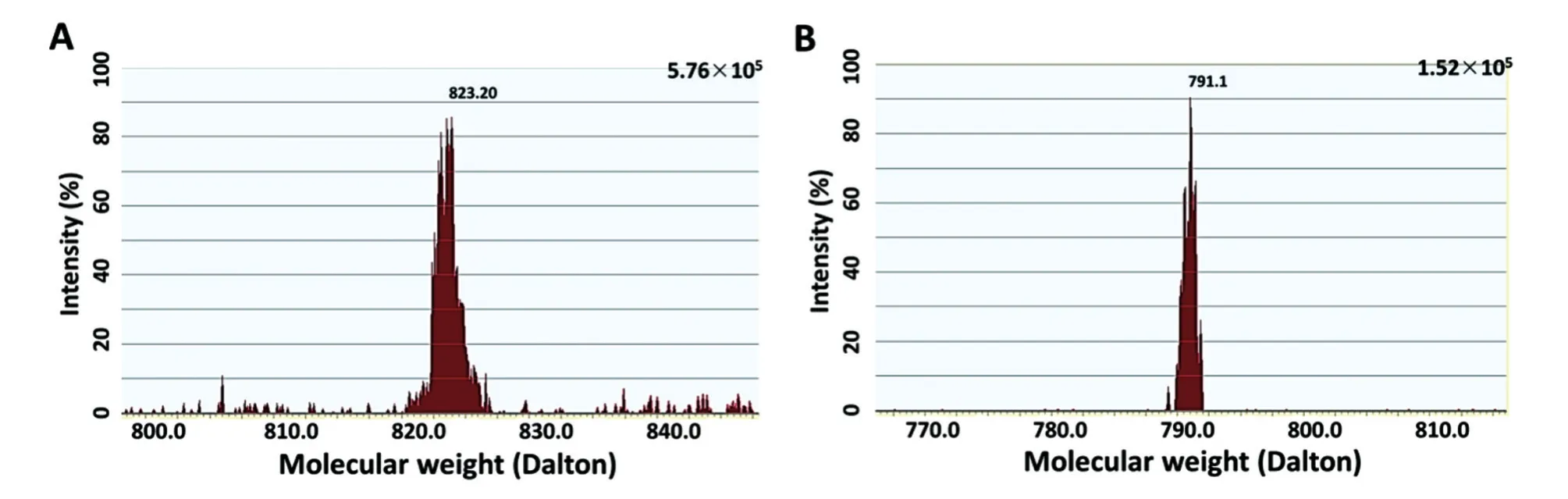
图1 基于母离子/子离子对的利福平液相质谱联用检测方法
尽管发现与鉴定PXR的潜在配体或激动剂具有重要意义,但这一研究也对现有实验技术构成巨大挑战。对于传统生化或细胞学研究者,可通过抗原-抗体识别等技术研究蛋白质等生物大分子,通过PCR等特异性扩增目的核酸片段,但小分子化合物的研究与鉴定是难点。以萤光素酶报告基因等为代表的生化与细胞学研究技术仅能间接反映小分子对生物大分子的影响。最近被广泛应用的SRP等技术虽然能够检测蛋白质与小分子的相互作用,但设备要求很高且实验费用昂贵,仍然是间接检测:蛋白质与小分子结合后,其构象等性质发生变化,通过生物-化学/生物-物理传感器等检测到蛋白性质的变化,间接反应出蛋白与小分子的结合或相互作用。

图2 免疫共沉淀实验检测与识别Flag融合蛋白
为进一步完善相关研究,本研究建立了基于免疫共沉淀-液质联用技术的PXR配体检测方法:用免疫共沉淀与免疫印迹技术识别蛋白-小分子复合物中的蛋白质组分,用LC-MS/MS技术识别蛋白-小分子复合物中的小分子化合物。在HEK3293细胞中表达得到带有Flag标签的目的蛋白Flag-PXR与Flag-AR,用Flag-beads将这些蛋白分离纯化,再与利福平溶液孵育。用Flag抗体可对Flag-PXR、Flag-AR蛋白进行检测,用液质联用技术对复合物中的利福平进行识别。
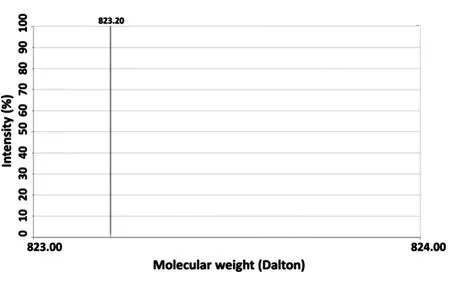
图3 液相色谱-质谱联用检测利福平
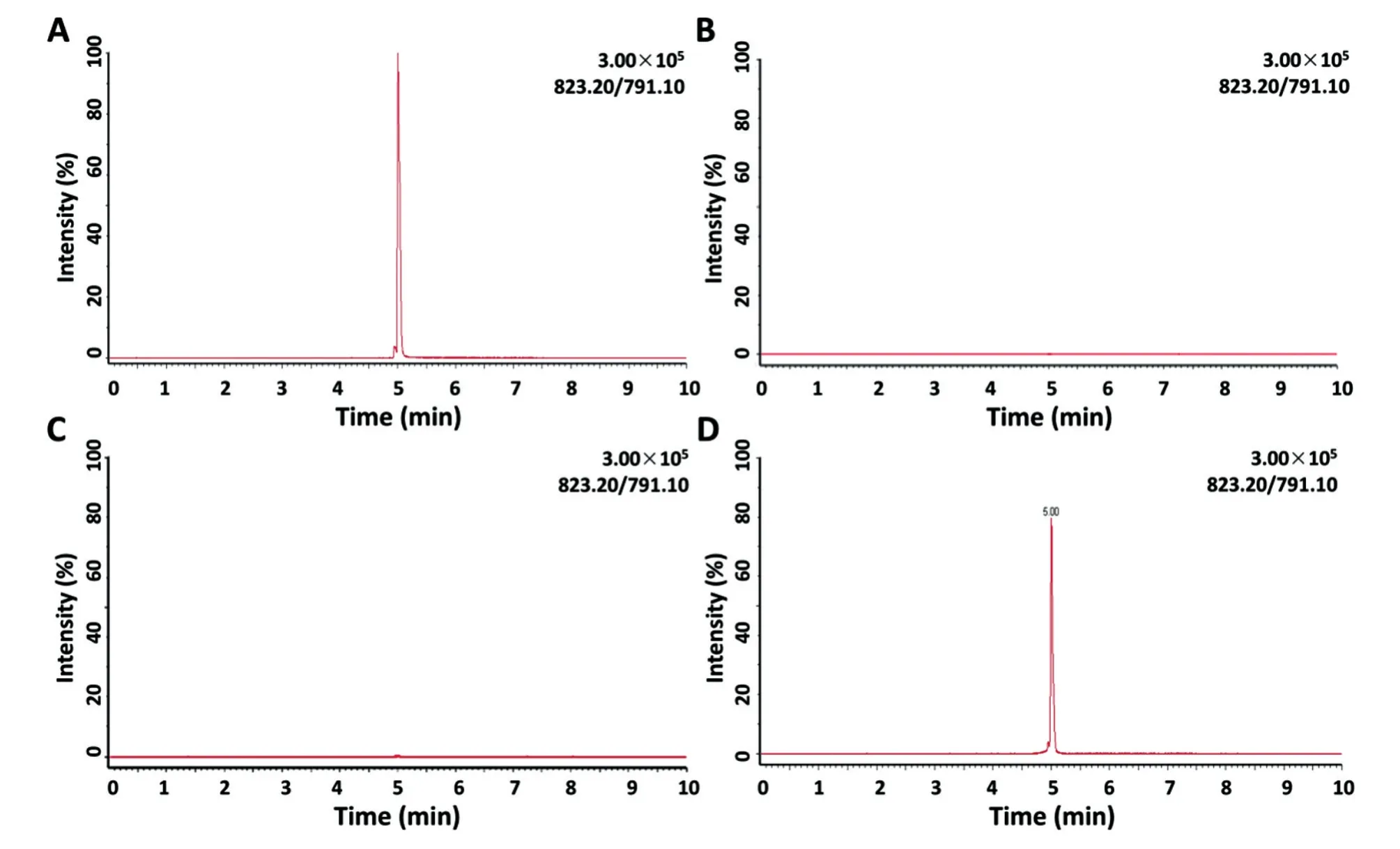
图4 液相色谱-质谱联用检测复合物中的利福平
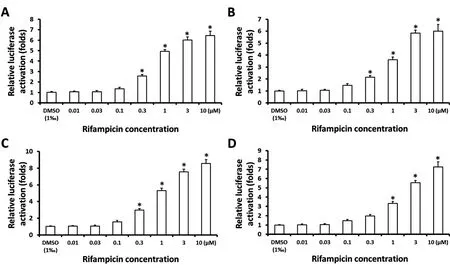
图5 利福平对PXR转录因子活性检测实验
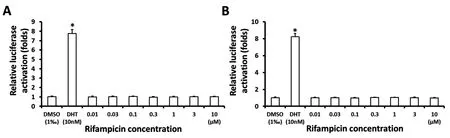
图6 利福平对AR转录因子活性检测实验
作为低背景的细胞模型,HEK293细胞转染效率很高,是研究的理想模型,结果特异性较高。免疫共沉淀相关技术是特异性检测蛋白质的常用技术,同时免疫共沉淀系统对样品有纯化与富集作用,也更利于LC-MS/MS检测。在此基础上,联合使用萤光素酶共沉淀实验能够对小分子作用的特异性进行验证。值得一提的是,雄激素受体被用作无关对照,目前尚无利福平影响AR的报道,本研究中利福平不能与AR相互作用,也不能诱导AR的转录因子活性。综上所述,我们建立了基于免疫共沉淀-液质联用技术的新型孕烷X受体配体检测方法,能够利用液相色谱-质谱联用技术对蛋白质-小分子复合物中的小分子化合物进行直接观测,这不仅拓展了我们对大分子-小分子相互作用的研究,也对抗肿瘤药物耐药研究具有重要意义。
参考文献

