我国生物安全能力评价与建设的思考
杜然然,高东平,池慧
中国医学科学院 医学信息研究所,北京 100020
1 美国健康安全能力评价新进展及启示
美国在2017年进行了健康安全能力评价,虽然区域不平衡现象仍存在,但全国社区卫生突发事件的防范措施年度评估略有改善。罗伯特·伍德·约翰逊基金会(RWJF)公布的《2017年国家健康安全指数报告》显示,美国的健康安全能力得分为6.8(总分为10分),比去年提高了1.5%。
美国健康安全能力通过分析130多种防范措施来计算综合评分,以提供最全面的卫生安全防范情况。例如监测食品和水安全,应急无线电通信业务能力,流感疫苗接种率等。健康安全能力评价工作是研究人员根据公共卫生、应急管理、政府、学术界、医疗卫生等部门专家介绍的方法,从50多个来源收集、整理数据,最后分为6类主题,每个类别都是独立评价(表1)。
美国通过健康安全能力评估的结果可以看到防范中所具有的优势和差距,并以此为依据提供改进美国健康安全的措施。但是平等保护仍是美国健康安全领域难以实现的目标,因为农村和低资源地区的保护力度较弱,故缩小国家和地区的备灾差距仍是国家的重点任务。
可以看出,提高健康安全能力评价对我国各地都很重要,国家应急准备取决于每个省、城市和地区的高水平保护。建议根据我国具体国情,组织专家设置合理的指标体系,定期进行健康安全能力评价工作。
2 美国生物安全能力建设新进展
2.1 美国高度重视生物安全战略规划
美国制定生物技术法规的政策基本原则是,在保护健康和环境的同时,减少法规和不合理的法律抑制创新发明,打压、指责新技术或者制造贸易障碍。
2017年1月4日,白宫发布了“2017年生物技术协调合作框架法规最后修改版(2017 Update to the Coordinated Framework for the Regulation of Biotechnology)”及“制定现代化生物技术产品法规的国家战略(National Strategy for Moderniz⁃ing the Regulatory System for Biotechnology Prod⁃ucts)”。该修订版包含各种生物技术产品及相关部门管辖的产品和法规、195篇过去有关的法律文件的参考资料,以及详细的审批监管流程图解。目的是努力使生物产品法规体系适应现代化,以及理清FDA、EPA和USDA在评估新生物技术产品时各自的作用和职责。
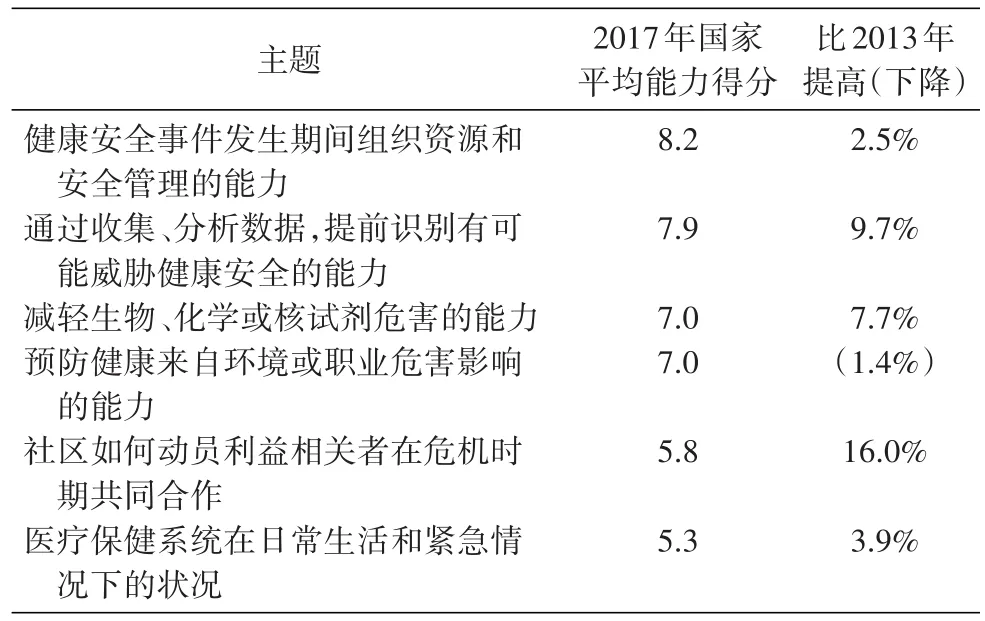
表1 2017年国家健康安全能力
对比美国更新生物技术法规的做法,可以看出,我国在生物技术领域还比较滞后,“限制”远多于“服务”,建议增加“服务”部分,且根据形势的变化及时做出调整。
2.2 美国政府举行多边生物安全战略对话
2017年4月,约翰霍普金斯健康安全中心举行多边生物安全对话会议,与会者有来自新加坡、马来西亚、印度尼西亚和美国的专家。会议讨论了自然发生的、意外的和故意的传染病事件对健康和安全的影响,高遏制实验室生物安全,新兴生物技术和两用科学带来的潜在好处和安全挑战,以及快速确定和应对区域卫生突发事件的困难。参与者来自生物安全相关领域,该项目得到了美国国防部大型防御系统和防御威胁减少机构的高级系统和概念的支持。
通过美国约翰霍普金斯健康安全中心举行多边生物安全对话会议,可以看出美国政府非常重视国际交流,实际上,新加坡、马来西亚和印度尼西亚都是美国在亚太地区的传统盟友,这些地区都有美国的战略利益,这些地区发生传染病、实验室生物安全事件、两用生物技术威胁、区域突发卫生事件等生物安全问题,都会影响美国的国家安全和战略利益。建议我国在“一带一路”倡议下,加强与沿线国家的生物安全问题磋商、交流与研讨,深化科技外交,加强国际对话。
3 思考与建议
借鉴约翰霍普金斯大学健康安全中心、公共卫生学院等权威机构专家就生物安全能力建设部分提出的相关意见,提出发展我国生物安全能力建设的一些思考。
3.1 积极应对生物威胁
建议我国提高开发新药治疗和疫苗的能力,以应对国家面临的生物威胁;建立更有效的医疗服务体系,以便在传染病暴发和灾难中为病人和受伤者提供更好的照料;完善公共卫生体系,对疫情及时进行预警,制定积极有效的健康安全风险防范管理措施;加强国际社会保护,制止传染病来源,努力防范生物、化学试剂和核扩散;切实加强组织领导,全力推进健康安全工作落实[1]。
3.2 提高评估和处理生物安全风险能力
建议建立国家风险评估程序,由国家卫生健康委员会牵头并组织国家风险评估。该风险评估应首先成立一个咨询委员会,委员代表应包括风险评估、公共卫生、医药和国家安全等领域专家,同时确定实施风险评估的机构、应使用的风险评估分析方法,以及定期更新评估的时间[2]。
3.3 防止生物武器开发或使用
防止生物武器的开发利用应成为我国的首要任务。目前我国仍面临诸多挑战,例如制造和使用生物武器所需的知识、材料和技术在世界各地都容易获得;病原体在本质上是普遍存在的,可在医院和实验室、科学文化收藏及各地的病人和动物中找到,特别是病毒,这些技术成本低廉且全球可用。
面对诸多挑战,建议我国政府继续支持“禁止生物武器公约”、防止恐怖主义行为并为发展全球公共卫生基础设施努力;加强对生物武器的威慑,减少生物武器袭击后的危害,并加大监测能力;增加对私营部门进行基因筛选的支持;加强情报收集工作,以便及时识别和发现袭击事件并阻止潜在的生物恐怖主义者[3]。
3.4 加强医疗应对措施
医疗应对措施(MCMS)主要指药物、疫苗、诊断测试和其他治疗和设备,是国家在应对危险病原体、化学试剂、放射和核威胁时最重要的资产。获得MCMS的社区更有能力快速检测故意引起的暴发,免疫易感人群,治疗感染患者,从而减轻生物威胁带来的后果,如疾病和死亡、经济损失、社会动乱、公众健康和医疗保健服务系统等。
美国依靠公共卫生紧急医疗应对措施企业(PHEMCE)开发、批准、购买和分发减轻生物威胁所需的MCMS及其对健康和安全的影响。PHEMCE由卫生与公众服务部(HHS)助理办公室、疾病控制和预防中心(CDC)、食品和药品监督管理局(FDA)及美国国家卫生研究院(NIH)在内的HHS合作伙伴秘书组成,同时还包括国防部(DoD)、退伍军人事务部(VA)、国土安全部(DHS)和美国农业部(USDA)等其他合伙机构。在这些实体中,NIH中的国家过敏和传染性疾病研究所是传染病预防和治疗早期生物医学研究的动力。国防部的医疗对策系统办公室主要致力于开发和部署军事部队的MCMS。此外,生物医学高级研究与发展机构(BARDA)在开发和采购MCMS方面也发挥关键作用。
美国在MCMS收购、监管和分配方面颁布了相关政策和法规。其中最重要的是2004年“生物保护法案”,该法规旨在资助政府采购新型MCMS来抵御传统的生物武器威胁,如肉毒中毒、炭疽和天花。HHS公共卫生和社会服务应急基金的财政年度预算6.46亿美元用于支持BioShield项目活动。2013年3月颁布的“大流行和全民健康重新授权法(PAHPRA)”,将于2018年授权进一步资助MCMS采购、研究与开发工作[4]。
借鉴美国医疗应对措施的经验,建议我国通过资助新技术基础研究和投资的方式加快MCMS的开发和生产;优先发展并采购MCMS来解决抗菌药物阻力,包括非传统MCMS;实施激励措施加速公私部门进行MCMS研发工作;批准在公众场合使用合理的MCMS来应对医疗健康紧急事件;逐步健全国际MCMS共享机制。

