运用数字PCR检测乳腺癌组织FFPE样品中人表皮生长因子受体2拷贝数的变化
董周寰,张晶,王哲,许程程,王芳,宋海峰,付洁,石怀银
1.解放军总医院 病理科,北京 100853;2.军事科学院 军事医学研究院 生命组学研究所,蛋白质药物国家工程研究中心,北京 102206;3.北京金则医学科技发展有限公司,北京 102206;4.军科正源(北京)药物研究有限责任公司,北京 102206
人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2,又称 ERBB2)是人表皮生长因子家族成员,其基因位于17号染色体。HER2过表达是促发多种肿瘤发生发展的关键因素,也是靶向治疗选择的关键指标之一[1-3],抗体药物赫赛汀可有效治疗约25%的HER2高表达型乳腺癌[4]。研究表明,除乳腺癌外,胃癌等癌症中HER2基因拷贝数会发生变异[5-6],因此准确考察HER2基因拷贝数变化(copy number varia⁃tion,CNV),对于靶向治疗意义重大。
目前临床上常通过免疫组化(immunohisto⁃chemistry,IHC)和荧光免疫杂交(fluorescence in situ hybridization,FISH)的方法进行靶点确证,判断患者疾病进程,但研究表明HER2检测有10%~20%结果无法准确反映[7],主要因素为:①操作者技术水平影响;②结果评判存在主观性;③肿瘤的异质性导致取样偏差[7-8]。另外,FISH是用探针检测切片样品中HER2、CEP-17的信号,通过HER2、CEP-17荧光信号的比值来评价HER2的扩增程度,但有文献报道CEP-17本身可能也会异常扩增[9],仅以其作为内参基因可能会导致部分患者不能受益于HER2靶向治疗。
虽然FISH是目前检测HER2CNV的金标准,但由于上述局限性,以及通量低成本较高,仍需要更为准确、客观、较高通量、成本较低的检测技术加以辅助甚至替代。数字PCR(droplet digi⁃talPCR,ddPCR)是目前最具潜力的检测方法之一,早在20世纪90年代就有科学家提出ddPCR的概念[10-12]。近几年,ddPCR在微生物[13]、拷贝数变异[14]、基因突变[15]等分析领域有突破性贡献。ddPCR是组织提取后匀质状态下靶分子的绝对定量技术,具有很高的灵敏度与准确性[16]。我们将ddPCR用于HER2CNV检测,并与IHC、FISH结果进行比较,希望将ddPCR发展为IHC、FISH检测的有力补充手段之一。
1 材料与方法
1.1 材料
收集解放军总医院2015年3~7月经病理确诊为乳腺癌的福尔马林固定石蜡包埋(formalinfixed and parrffin-embedded,FFPE)样本 21例,其中IHC结果显示为“++”样品18例,“+++”样品3例。该批样本均经FISH方法检测HER2CNV。
FFPE样品DNA提取试剂盒购自凯杰公司;细胞基因组DNA(gDNA)提取试剂盒购自天根生化科技(北京)有限公司;ddPCR探针法自动化微滴发生油、检测预混液分析专用油购自Bio-Rad公司;HER2和CEP-17的DNA检测引物探针序列由本实验室参考文献[17]及NCBIGenBank数据库后利用软件Prime5.0设计(表1),由上海生工公司合成;HER2IHC检测一抗为兔IgG,购自中杉金桥生物技术有限公司,克隆号EP3;二抗检测系统为罗氏Ventana公司的UltraView Universal DABDetection试剂盒;FISH检测使用乳腺癌HER2基因检测试剂盒(FISH法)(PathVysion)。
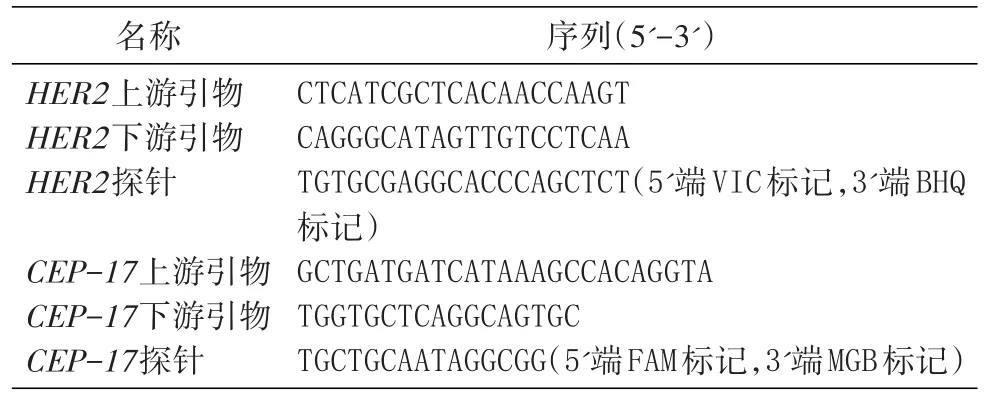
表1HER2及CEP-17引物探针序列
Bio-RadQX200自动化数字PCR系统(微滴生成仪器,微滴读取仪器,T100PCR仪,热封仪);Thermo台式离心机等实验室常规仪器。
1.2 标本核酸提取
21例FFPE样本经石蜡包埋后切片用于IHC及FISH检测判断患者病理情况,同时每个组织再切2片,厚度均为5μm,置于1.5mL无核酸酶EP管中,室温保存。用凯杰公司FFPE样品DNA提取试剂盒提取样品gDNA,用NanoDrop检测浓度、纯度后以10μL/管分装保存于-60℃~-90℃冰箱。
1.3 细胞系DNA提取
HER2表达正常型细胞系人胚肾细胞293T、人口腔上皮细胞HOEC,以及HER2阳性表达卵巢癌细胞系SKOV3购于ATCC并保存于本实验室,收集对数生长期细胞,用细胞gDNA提取试剂盒提取gDNA,并经NanoDrop检测浓度、纯度后10 μL/管分装,-60℃~-90℃保存。
1.4HER2、CEP-17ddPCR检测方法建立
设计、合成HER2、CEP-17引物探针,以293T、HOEC、SKOV3细胞gDNA为模板建立反应体系及程序。ddPCR反应体系包括Supermix 10 μL,上、下游引物各 0.8 μmol/L,探针 0.25 μmol/L,DEPC水 4.3 μL,gDNA40ng/2 μL。将反应体系配置在96孔板后,在Bio-Rad自动化数字PCR微滴生成仪中生成微滴,封板后在普通PCR仪上进行扩增(扩增程序:95℃ 5min;94℃30s,60℃ 40s,40个循环;98℃ 10min)。扩增毕,用微滴分析仪及QuantaSoft软件分析结果,得到每个样品中HER2、CEP-17基因的拷贝数。
1.5 线性稀释
将293T细胞gDNA用DEPC水稀释至20ng/μL,并按1/5梯度稀释为5个浓度水平,上样量均为 2 μL/反应,即上样量分别为 40、8、1.6、0.32、0.064ng/反应。按1.4中的反应体系及程序配置ddPCR样品并进行检测。
1.6 单通道、双通道检测方法比较
以梯度稀释的293T细胞gDNA为模板建立双通道反应体系(上样量分别为40、8、1.6、0.32ng/反应),即HER2、CEP-17引物和探针于同管反应。同时从IHC检测结果为“++”和“+++”的样品中各随机挑选1个(最终选择样本为9#、14#),制备CEP-17(FAM,蓝色)及HER2(VIC,绿色)单通道反应体系和双通道反应体系,反应程序与1.4中描述相同。
1.7 标本样品ddPCR检测
所有样品均采用双通道检测法检测,以Ratio(HER2/CEP-17)表述样品中的HER2CNV。
1.8 标本样品IHC及FFPE检测
IHC检测流程:石蜡切片脱蜡至水;pH9.0 EDTA溶液修复1h;3%H2O2室温孵育10min以消除内源性过氧化物酶的活性;蒸馏水冲洗,PBS浸泡;滴加一抗工作液,37℃孵育1h;PBS冲洗3次;按说明书进行二抗孵育及显色;自来水充分冲洗,复染,脱水,透明,封片。
FISH检测按试剂盒说明书进行。
2 结果
2.1 细胞系HER2/CEP-17检测结果
HER2正常表达型293T细胞和HOEC细胞HER2/CEP-17值分别为 1.20(8020/6700)和 1.24(7880/6360),SKOV3细胞HER2/CEP-17值为4.83(22010/4560)。
2.2 线性稀释结果
为考察引物、探针响应性,以293T细胞gDNA样品系列稀释模板做线性考察,结果表明R2>0.99,2种基因引物探针符合检测要求,典型的ddPCR结果见图1。
2.3 单通道、双通道检测结果
293T细胞gDNA稀释至1/5,分别用CEP-17和HER2引物探针进行单通道、双通道检测,以考察引物探针PCR反应性能。如图2,单、双通道结果一致,线性R2>0.99,引物、探针符合ddPCR检测要求,且在1个反应孔中进行2种靶基因的扩增不会相互干扰。9#、14#样品的单、双通道检测结果显示HER2/CEP-17值精密度高(CV分别为2.4%、3.1%)。
2.4 ddPCR检测结果界定
鉴于293T、HOEC细胞系中HER2/CEP-17值为1.2,结合ddPCR的技术原理,本研究中对标本样本暂定为:当HER2、CEP-17其中之一拷贝数≥20000时,须降低上样量重测;在此基础上,当样本HER2/CEP-17值≥2.1时为HER2扩增阳性,当样本2.1>HER2/CEP-17值≥1.2时为HER2临界阳性,当样本HER2/CEP-17值<1.2时为HER2扩增阴性。
2.5 FISH检测结果
参照ASCO/CAP公布的2013版HER2检测指南,本研究根据FISH检测对HER2CNV的评判标准如下:①当HER2/CEP-17比值≥2.0时,为HER2阳性;HER2/CEP-17比值<2.0,但平均拷贝数/细胞≥6.0时也为HER2阳性;②若众多信号连接成簇时可不计算,视为基因扩增;③HER2/CEP-17比值<2.0且平均拷贝数/细胞<4.0时为HER2阴性;④HER2/CEP-17比值<2.0且平均拷贝数/细胞≥4.0但<6.0,FISH不确定;⑤HER2/CEP-17比值≥2.0,但平均拷贝数/细胞<4.0的病例是否该视为阳性,目前存在一定争议。本研究所取样本的FISH结果均为>2.0的样本为阳性,<2.0的样本为阴性。关键样本FISH结果如图3,FISH染色后,用奥林帕斯显微镜BX53观测(目镜10×,油镜100×),摄像头DP70拍照。
2.6 ddPCR、IHC、FISH结果比较
将同一样品3种检测平台所得结果统一比较(表2)。在14例IHC检测为“++”、FISH检测小于2.0的样品中,13例ddPCR检测阴性,1例(2#)临界阳性,但该例样本的FISH检测结果为1.96,接近FISH的阳性判断标准。在3例IHC检测为“+++”、FISH检测为阳性的样本中,2例ddPCR检测为阳性,1例(17#)检测临界阳性。还有2例IHC检测为“++”的样品,FISH检测为阳性,但ddPCR检测为阴性。
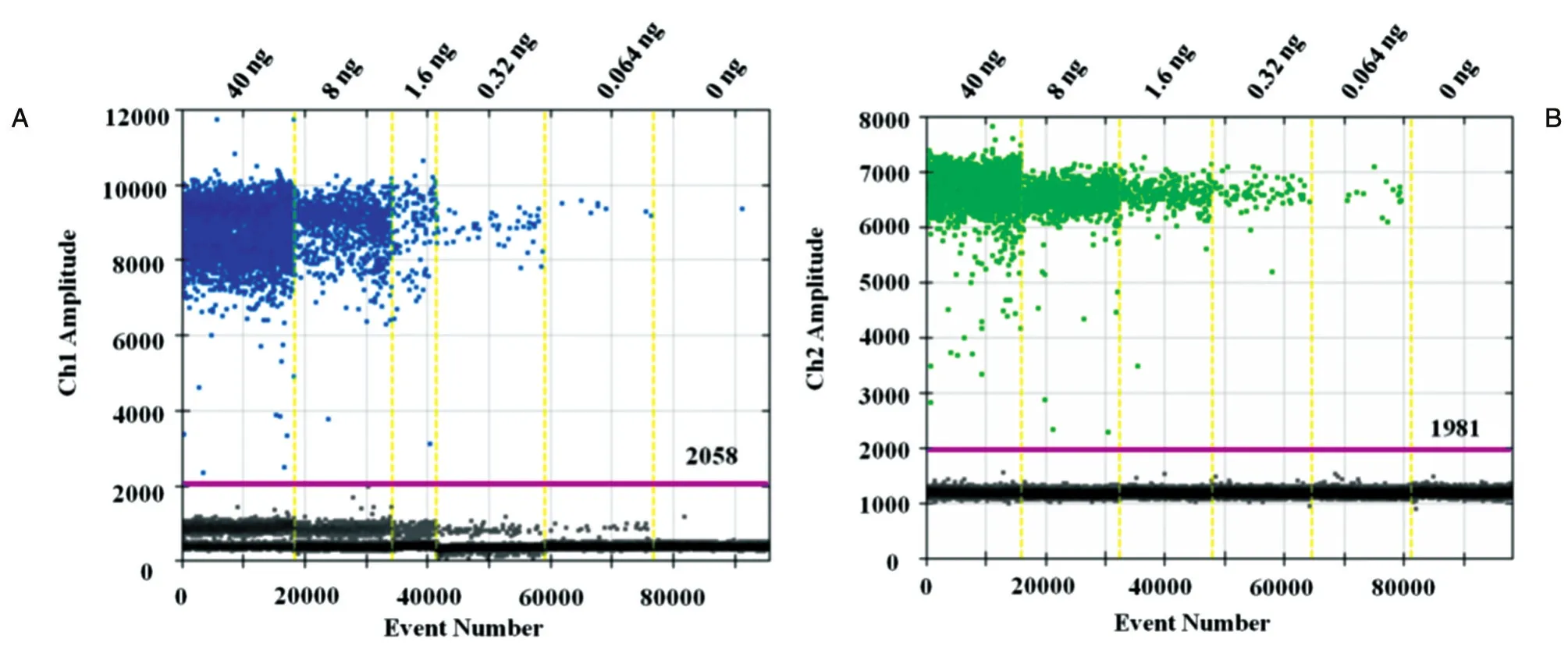
图1 典型CEP-17(A)和HER2(B)ddPCR结果图
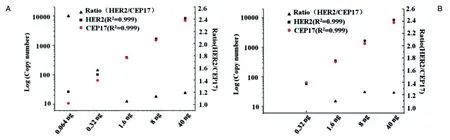
图2 293T细胞DNA单通道(A)和双通道(B)检测结果及HER2/CEP-17值
图3 典型FISH阴性(A)和阳性(B)结果
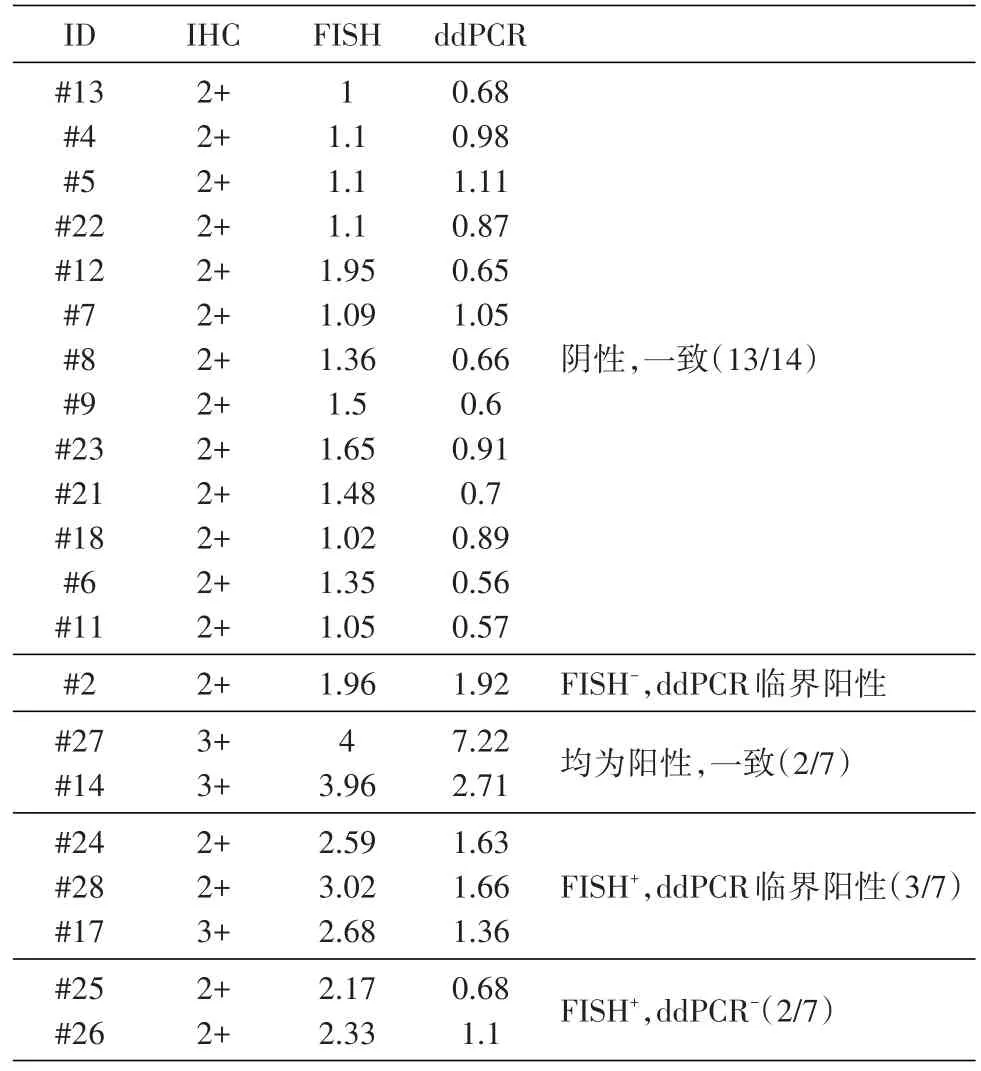
表2 IHC、FISH及ddPCR结果比较
3 讨论
ddPCR与实时定量PCR技术原理相同,通过酶、引物、探针等对靶基因进行扩增并转化成可用于定量的数值。与实时定量PCR“一锅反应”不同的是,ddPCR主要通过微滴生成或芯片将反应体系分成 1×104~2×104个微滴,以形成一个个微小的独立反应器,数据分析时直接给出每个样品中靶基因的拷贝数,对于微量拷贝数的定量更为准确。ddPCR与所有PCR实验一样,在实验过程中须严格操作,保证环境、样品不被气溶胶污染。在ddPCR的引物筛选及条件优化中,我们常选择阴性、阳性微滴信号分布相对集中且间隔较大情况下对应的体系及程序。同时,数据分析中,需要用阴性对照划阈值线判定阴、阳性微滴,与实时定量PCR不同的是,ddPCR可结合分析批中阴性对照设置的数量及检测的结果通过软件计算出分析批的阳性Cut-off值,只有大于Cut-off值的样品才真正含有靶基因,小于Cut-off值的样品为弱阳性/假阳性,阳性微滴的产生可能源于污染或系统误差等,可选择重测(主要看实验者如何设计实验)。但还需要同时考察样品阳性微滴所在的信号范围,如果仅是在阈值线的上方,远达不到阳性对照样品中阳性微滴的信号值,则须更加科学地分析这些微滴是否是真的“阳性”。
为对样品前处理回收率、ddPCR检测上样量进行归一,我们以HER2同一染色体上的CEP-17为对照,采用HER2/CEP-17的形式进行报告,排除切片质量、提取回收效率等因素的干扰。虽然HER2/CEP-17是FISH中HER2检测的金标准,但我们不能仅依靠CEP-17来判断17号染色体的数目[8,18-20]。在检测样品时,应尽量保证相同的切片数量、处理方法、ddPCR体系和程序,在分析结果的过程中关注CEP-17和HER2各自的拷贝数,及时发现异常,科学地分析数据。本研究ddPCR分析结果表明,在切片数量和DNA上样量一致的前提下,CEP-17拷贝数变化范围为几百至几千拷贝,说明存在样本核酸片段化差异显著情况或者异常扩增的情况。该现象提示我们,ddPCR检测应用于临床前需要对FFPE样品保存和样本前处理进一步优化,甚至可用新鲜冻存样本。此外,ddPCR可能需要参比多个内参基因排除CEP-17异常扩增的问题。
本研究中我们检测了21例样品,初步得到用ddPCR法检测HER2CNV(HER2/CEP-17比值)的Cut-off值范围,并且与FISH阴性样品的一致性为13/14,阳性结果完全一致性为2/7(其他5例FISH阳性的样本中,3例ddPCR检测为临界阳性,2例为阴性,其FISH检测结果分别为2.1、2.3)。从上述结果比对中可见,肿瘤的异质性可能导致FISH或ddPCR取样或结果判读存在一定的主观因素,特别是对临界阳性的样本。我们仍须继续增加样本量,并尽量追踪FISH检测与ddPCR检测不一致的个体的其他检测结果,甚至后期疾病进展情况,以建立ddPCR从FFPE切片样品中检测HER2CNV与IHC进程的参数,成为辅助IHC、FISH用于临床研究及诊断的检测手段。

