模拟空间环境下低剪切力对肺炎克雷伯氏菌Ⅲ型菌毛表达调控机制的初步研究
李文亮,王海立,高肖芳,杨瑞馥,倪斌,韩延平
1.江苏大学 医学院,江苏 镇江 212013;2.军事科学院 军事医学研究院 微生物流行病研究所,北京 100071;3.军委装备发展部 原亚运村门诊部,北京 100012
随着航天科技的迅猛发展,人类活动进入地外空间的同时,微生物也伴随各种航天器及人体自身进入太空,空间微生物学研究随之兴起。美国和俄罗斯等国家已经开展了一系列空间微生物的研究,而我国在该领域尚处于起步阶段。但随着我国航天飞行时间的不断延长,在相对封闭狭小的航天器内,航天员的感染风险逐渐升高[1],于是空间微生物学的研究越来越受到国家的重视。有研究表明,地外空间中特殊的环境使得微生物在进入太空后会发生一系列生理改变,包括一些致病因子及毒力、生物膜等。地外空间中的哪些因素会导致此种改变?地外空间存在真空、微重力、宇宙辐射、极端温度等极端生存条件,但是借助于航天器的保护,航天活动中微生物的生理活动主要受微重力影响。目前,多项研究结果表明微重力条件下细菌生物被膜的形成能力增强。最初,McLean等[2]发现铜绿假单胞菌在微重力条件下可以形成生物被膜,Crabbé等[3]也观察到模拟微重力环境中铜绿假单胞菌形成的生物被膜样结构。随后,越来越多的细菌被发现可以形成生物被膜,其中包括肺炎克雷伯菌。
航天员体内及航天器内部环境中曾检出多种致病菌及机会性致病菌,包括大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、流感嗜血杆菌、金黄色葡萄球菌、链球菌等[4]。本研究中的肺炎克雷伯菌ATCCBAA-1705株是肠杆菌科克雷伯菌属的一种革兰阴性杆菌,在自然界中广泛存在,属于机会性致病菌,且耐药严重,为多重耐药菌[5-7]。肺炎克雷伯菌1705株经搭载神舟十号飞船后,原本短杆状、散在分布的菌体中出现链状排列的现象。本实验室使用美国NASA研制的旋转培养系统模拟微重力(simulatedmicrogravity,SMG)[8-9]也发现了这种现象,并分离出不同的亚群菌株,即短杆状的M1亚群和链状排列的M2亚群[10]。在研究生物膜形成特性的过程中,发现了2个有意思的现象。第一个现象是在SMG(低剪切力)条件下,分离到的亚群M1、M2在摇床培养时其生物膜形成能力存在差异[10];第二个现象是在SMG环境中连续传代培养后,肺炎克雷伯菌亚群菌株Ⅲ型菌毛表达能力增强[11-12],这引起了我们的关注。通过文献调研发现,肺炎克雷伯菌生物膜的形成与其Ⅲ型菌毛密切相关[13],而SMG具有悬浮、低剪切力的特点[8-9,14],于是我们推测,不同剪切力可能使得Ⅲ型菌毛表达出现差异。
本研究中除了使用SMG系统,还用不同转速的摇床共同组成了不同的剪切力梯度,即0(静置)、SMG、50、100、200r/min共5种不同的剪切力,剪切力依次增高。通过不同剪切力条件下的培养及实验,观察Ⅲ型菌毛的表达差异,并对这种差异背后可能的分子机制进行研究。
1 材料与方法
1.1 材料
肺炎克雷伯菌ATCCBAA-1705株M1亚群(简称肺炎克雷伯菌,本试验室分离保存);酵母ATCC26603(本实验室保存);LB营养肉汤(Oxoid公司);氨苄青霉素(MPBiomedicals公司);甘露糖(国药集团化学试剂有限公司);NH4Ac;HAc(北京欣经科生物技术有限公司);PureLink RNAMini试剂盒、DNA-free试剂盒、SuperscriptⅢ逆转录酶(Invitrogen公司);SYBRGreenRealt⁃mePCRMasterMix(Toyobo公司);荧光定量PCR仪及配套的PCR连体管(Roche公司);旋转细胞培养系统(RCCS)及高截面比容器(HARV)(Syn⁃thecon公司);恒温振荡培养箱(北京六一仪器厂);Nanodrop核酸浓度测定仪、SpeedVac抽干仪(ThermoFisherscientific公司);透射电镜(日立公司);超高效液相三重四极杆质谱联用仪(岛津公司)。
1.2 细菌培养
取肺炎克雷伯菌甘油种25μL接种于含5 mLLB液体培养基的大试管中,并加入5μL氨苄青霉素(100mg/mL),于37℃摇床中活化过夜,按 1∶200接种到液体培养基中,在 SMG、0、50、100、200r/min这5组不同剪切力条件下培养至相同生长周期。
1.3 生长曲线
取肺炎克雷伯菌甘油种25μL接种于含5 mLLB液体培养基的大试管中,并加入5μL氨苄青霉素(100mg/mL),于37℃摇床中活化过夜;取12个锥形瓶,各装入18mLLB培养基,编号0-1、0-2、0-3、50-1、50-2、50-3、100-1、100-2、100-3、200-1、200-2、200-3;取 3个 HARV 培养皿,注满LB培养基,编号M-1、M-2、M-3;准备EP管,每管加入25μL甲醛,标号0-1-2h、0-1-4h、0-1-6h、0-1-8h等,其余各组按相同方式进行标号。将活化的肺炎克雷伯菌按1∶200接种于锥形瓶中,37℃培养,每1~2h取菌液250 μL加入含甲醛的EP管中(甲醛终浓度约为10%),立即混匀,测定菌液D600nm值并记录。
1.4 甘露糖抑制的凝集试验
甘露糖抑制的酵母凝集试验是针对肺炎克雷伯菌M1亚群Ⅲ型菌毛设计的特异性试验[15]。用PBS将培养至相同生长周期的各组肺炎克雷伯菌洗涤3次后重悬,将各组调节到相同的D600nm值,每组分别取菌液100μL滴加于6孔板板盖上,再先后向2组菌液中加入50μL5%的D-甘露糖溶液及50μL1%酵母细胞,用枪头混匀;将此6孔板板盖置于定轨振荡器上低速摇动,3~5 min后观察各组的凝集情况。对菌液进行倍比稀释后,采用相同方法进行试验,观察凝集情况,确定凝集效价。
1.5 透射电镜观察
用PBS将培养至相同生长周期的各组肺炎克雷伯菌洗涤3次后重悬,与6%的戊二醛溶液1∶1混合;取混合后的菌液10μL滴在铜网上,后续用钼铵酸、乙铵酸1∶1混合液进行负染,染色3.5 min后放置过夜,待铜网完全干燥后用透射电镜观察样品。
1.6 qRT-PCR
将 SMG、0、50、100、200r/min共 5组肺炎克雷伯菌培养至相同生长周期,用RNA提取试剂盒分别提取各组的总RNA,在消化掉各组总RNA中残留的基因组DNA后进行逆转录反应,得到相应的cDNA。
设计引物长度为18~24bp,产物长度为100~150bp。选取肺炎克雷伯菌16SrRNA为内参基因,对mrk基因及GGDEF基因进行qRT-PCR实验及结果分析,比较不同剪切力环境下肺炎克雷伯菌M1亚群目的基因的表达差异。引物见表1。
1.7 转录组测序
将各组肺炎克雷伯菌培养至相同生长周期,用RNA提取试剂盒分别提取SMG、50、200r/min这3组的总RNA,通过北京诺禾致源科技有限公司的HiSeq平台进行三代测序,测序深度为100×。将3组两两组合后进行差异分析,即SMG vs200r/min,50r/minvs200r/min,SMGvs50 r/min,并设定2组间差异表达阈值为比值大于2倍或小于0.5倍。在整体上对差异表达基因进行KEGG分析,确定其所属代谢通路,在局部对Ⅲ型菌毛相关的mrk基因及c-di-GMP表达相关的GGDEF基因表达情况进行分析。

表1 引物及序列
1.8 c-di-GMP提取检测
用PBS将培养至相同生长周期的5组肺炎克雷伯菌各洗涤3次后重悬,并将各组调节到相同的D600nm值。在各组中加入由甲醇∶乙腈∶水(2∶2∶1)配置的裂解液,冰浴15min后立即放入95℃的水浴锅中孵育10min,室温放置10min冷却,4℃下最大转速离心10min,取上清。余下的菌体沉淀中加入200μL裂解液,重复上述提取过程2次,将收取的上清合并,用SpeedVac抽干仪抽干。
在测定c-di-GMP之前,加入200μLEluent A(10mmol/LNH4Ac+0.1%HAc),振荡至充分溶解,4℃下最大转速离心10min,取上清,用0.22 μm超滤膜过滤,采用超高效液相三重四极杆质谱联用仪检测。
2 结果
2.1 生长曲线
通过观察生长曲线可知,SMG、0r/min组24 h左右到达对数后期,50r/min组18h左右到达对数后期,100、200r/min组14h左右到达对数后期。本试验选取对数后期的菌为研究对象,即100、200r/min组的肺炎克雷伯菌培养14h,50r/min组培养 18h,SMG、0r/min组培养 24h。生长曲线如图1。
2.2 Ⅲ型菌毛相关的表型试验
甘露糖抑制的酵母凝集试验中,低剪切力的SMG、0、50r/min组凝集量多,而高剪切力的100、200r/min组凝集量相对少。200r/min组的凝集量比100r/min组少,且在5组中凝集量最少(图2)。随后,SMG、0、50、100、200r/min各组经 1∶5梯度稀释后分别进行凝集试验,以观察到凝集的最大稀释率为其凝集效价,各组凝集效价以5为底取对数后的平均值依次为6.67、5.67、5.67、4、2.67,数据经ANOVA分析后具有统计学意义(P<0.05)(图 3)。
电镜观察发现,低剪切力SMG、0、50r/min条件下培养的肺炎克雷伯菌可观察到的Ⅲ型菌毛多,而高剪切力100、200r/min组菌毛少(图4)。
甘露糖抑制的酵母凝集试验和电镜观察两个表型试验均表明,随着剪切力的增加,Ⅲ型菌毛的表达减弱。
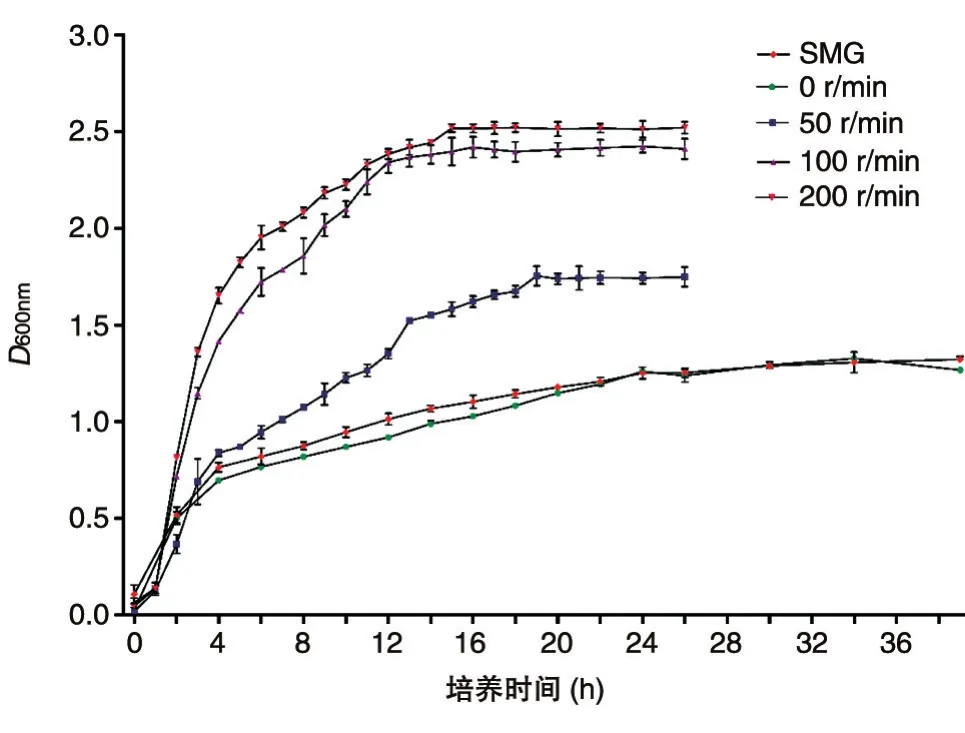
图1 肺炎克雷伯菌M1亚群在不同剪切力下的生长状况

图2 甘露糖抑制的酵母凝集试验
2.3 Ⅲ型菌毛相关表型实验的验证
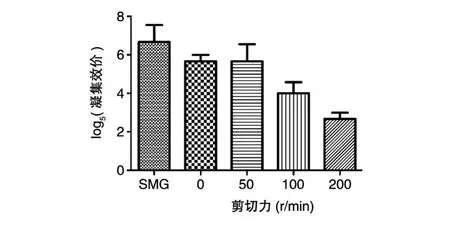
图3 不同剪切力组肺炎克雷伯菌M1亚群菌株凝集效价
针对Ⅲ型菌毛的结构基因和相关调控基因,我们设计了荧光定量PCR及转录组测序分析。从qRT-PCR结果可以看出,与高剪切力的200r/min对比,低剪切力的SMG、0、50、100r/min组的mrkA、mrkD及mrkH表达明显增强,且低剪切力的SMG、0、50r/min组表达值明显强于高剪切力的100和200r/min组;SMG、50、100r/min组的mrkJ表达相对减弱;方差分析均满足P<0.05,差异具有统计学意义(图5)。从转录组测序结果分析,与高剪切力200r/min组相对比,50r/min、SMG组的mrkA、mrkB、mrkC、mrkD、mrkE、mrkF、mrkH、mrkI、mrkJ表达均升高,而SMG组与50r/min组相比,mrk基因的表达并无差异(表2)。
2.4 Ⅲ型菌毛表达与剪切力之间可能的分子机制探究

图4 不同剪切力组肺炎克雷伯菌M1亚群菌株电镜观察

图5 Ⅲ型菌毛相关基因qRT-PCR试验
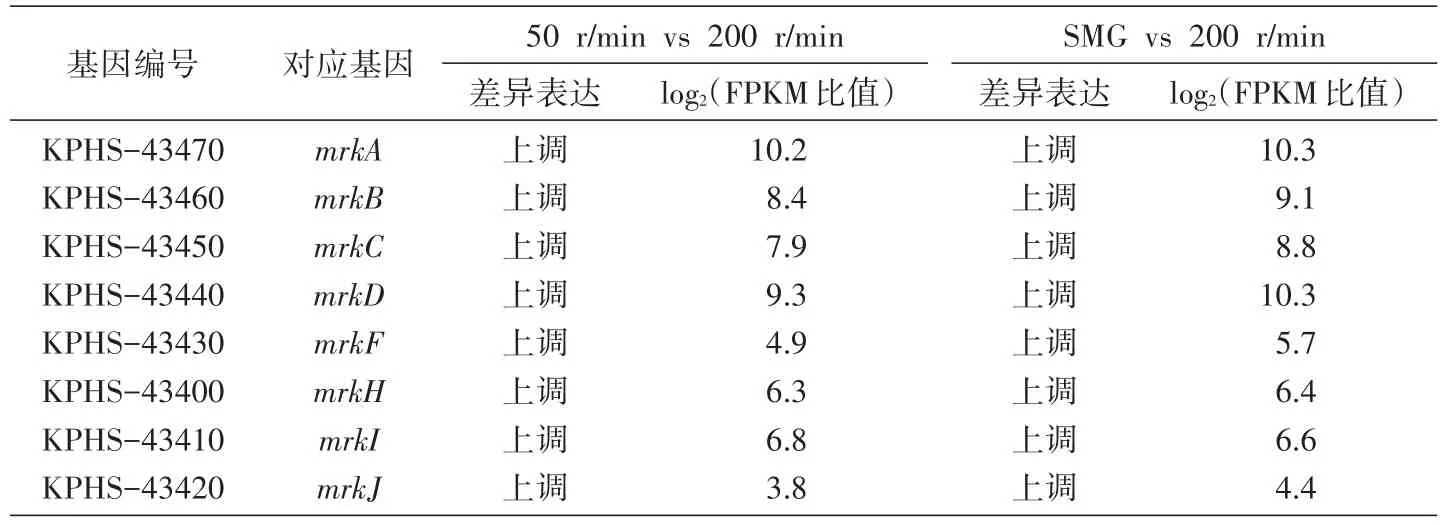
表2 Ⅲ型菌毛相关基因转录组测序分析
2.4.1 第二信使c-di-GMP表达水平检测 SMG、50、200r/min组c-di-GMP的平均表达水平分别为 27.15、56.3 和 84.1ng/mL。经 One-wayanaly⁃sisofvariance分析,P<0.0001,随着剪切力的升高,c-di-GMP的表达水平逐步升高(图6)。
2.4.2 c-di-GMP相关GGDEF基因表达 在基因组完成图中找到18个与c-di-GMP表达相关的基因,由于编码含GGDEF基序的蛋白,故称为GGDEF基因。在得到转录组测序结果后,将此18个基因与之相对照,发现了17个可以匹配的基因,其中8个基因的表达随着剪切力的降低而显著 上 调 ,即 KPHS-06770、KPHS-17760、KPHS-27460、KPHS-29590、KPHS-38170、KPHS-39010、KPHS-39950 和 KPHS-47910(表 3)。

图6 c-di-GMP检测结果
在上述分析基础上,根据17个GGDEF基因设计了qRT-PCR试验。与转录组测序分析中发现的8个表达差异较大的基因相对比发现,随着剪切力的降低,其中7个基因在qRT-PCR试验中也 显 著 上 调 ,即 KPHS-06770、KPHS-17760、KPHS-29590、KPHS-38170、KPHS-39010、KPHS-39950和 KPHS-47910(图 7)。
3 讨论
为研究不同剪切力环境对肺炎克雷伯菌Ⅲ型菌毛表达的影响,我们以肺炎克雷伯菌ATCC BAA-1705株M1亚群为研究对象,在0、SMG、50、100、200r/min共5种不同剪切力条件下进行了甘露糖抑制的酵母凝集试验和电镜观察表型试验。在甘露糖抑制的酵母凝集试验中,低剪切力的SMG、0、50r/min组凝集量多,而高剪切力的100、200r/min组凝集量相对少。在电镜观察实验中,低剪切力SMG、0、50r/min条件下培养的肺炎克雷伯菌可观察到的Ⅲ型菌毛多,而高剪切力100、200r/min组少。通过以上2个表型试验可以发现,随着剪切力的增高,肺炎克雷伯菌M1亚群Ⅲ型菌毛的表达降低,提示低剪切力可能促进肺炎克雷伯菌Ⅲ型菌毛的表达。
针对肺炎克雷伯菌M1亚群Ⅲ型菌毛结构基因及相关调控基因,设计了qRT-PCR和转录组测序分析。mrkA、mrkB、mrkC、mrkD、mrkE和mrkF为肺炎克雷伯菌Ⅲ型菌毛的结构基因,mrkH和mrkI为其正向调控基因,mrkJ为其负向调控基因[13]。从qRT-PCR结果可以看出,与高剪切力的200r/min对比,低剪切力的SMG、0、50、100r/min组的mrkA、mrkD及mrkH表达明显增强,且有随着剪切力增高,Ⅲ型菌毛相关基因表达减弱的趋势。在转录组测序结果分析中,与高剪切力200r/min组相对比,低剪切力的SMG和50r/min组的mrkA、mrkB、mrkC、mrkD、mrkE、mrkF、mrkH、mrkI、mrkJ表达均升高,从正向验证了低剪切力促进Ⅲ型菌毛表达的结论。SMG与50r/min组相对比,由于剪切力差异小,mrk基因的表达并无差异,此事实从反向验证了低剪切力促进Ⅲ型菌毛表达的结论。虽然随着剪切力的降低,负向调控基因mrkJ的表达也上调,但正向调节基因mrkH的上调更显著,且结构基因均表达上调,所以,qRT-PCR试验和转录组测序2种方法得到的结果具有较好的一致性,彼此共同验证了低剪切力促进Ⅲ型菌毛表达的结论。

表3 17个GGDEF基因转录组测序结果分析
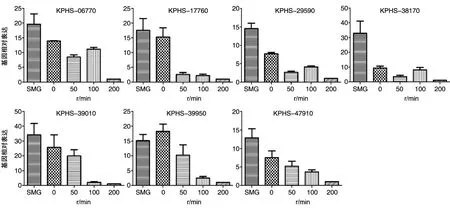
图7 7个显著上调GGDEF基因的qRT-PCR试验
低剪切力可以促进Ⅲ型菌毛的表达,Ⅲ型菌毛的表达与胞内第二信使c-di-GMP的表达水平正相关[13],于是我们推测低剪切力组c-di-GMP的表达水平高。但是检测结果表明,SMG、50、200 r/min组c-di-GMP的平均表达水平分别为27.15、56.3和84.1ng/mL,随着剪切力的升高,c-di-GMP的表达水平逐步升高。这与预期观点不符。文献调研发现,c-di-GMP作为一种广泛的第二信使,其整体表达水平受很多因素影响。c-di-GMP的表达水平对表型的控制分为整体控制和局部控制,有的表型受整体c-di-GMP浓度水平的控制,而有的表型则仅受局部c-di-GMP浓度水平的控制[16]。
通过进一步分析,我们在肺炎克雷伯菌1705株的基因组完成图中找到了17个c-di-GMP表达相关基因,称为GGDEF基因[16-17]。在得到转录组结果后,将此17个基因与转录组测序结果相比对,发现了8个差异表达较显著的基因。随后,根据此17个GGDEF基因设计了qRT-PCR试验,与转录组测序分析中发现的8个表达差异较大的基因相对比,发现其中7个基因在qRT-PCR试验中也显著上调。于是我们推测有可能是这7个基因中的一个或多个基因表达上调,造成局部的c-di-GMP表达水平增高,从而促进肺炎克雷伯菌M1亚群Ⅲ型菌毛的表达。作为肺炎克雷伯菌的重要致病因子之一[18],Ⅲ型菌毛在空间低剪切力的条件下表达增加,这提示在航天环境中肺炎克雷伯菌的致病能力可能发生改变,从而潜在威胁航天员的健康。
参考文献

