钙、铝金属元素螯合对燕麦多肽DPP4抑制活性的影响
任露沛,王 凤,范俊峰
(1北京林业大学生物科学与技术学院食品科学与工程系,北京 100083;2中国农业科学院农产品加工研究所,北京 100000)
二肽基肽酶IV(DPP4)是糖尿病治疗的新靶点,可通过调节其活性来控制餐后血糖的浓度,肠促胰岛素(GLP-1和GIP)是DPP4的天然底物,抑制DPP4活性,可防止肠促胰岛素的降解,进而有效降低餐后血糖浓度,因此DPP4被看作是治疗2型糖尿病的关键靶标酶之一[1-2]。近年来,人们研究了动植物来源的蛋白多肽(鲑鱼、牛奶、鸡蛋、燕麦、大米、大豆、小麦和苋菜种子)对DPP4的抑制活性[3-5]。此外,在体外研究中,牛奶全蛋白水解物、酪蛋白水解物、清蛋白水解物以及苋菜种子蛋白水解物均具有DPP4抑制活性,且大多数研究重点关注水解物中存在的功能性小肽(含2~8个氨基酸序列的肽)[6-7]。一般认为小肽才具有生物活性,且更易于人体消化吸收,而氨基酸序列超过8个以上的肽在消化过程中可能会被进一步水解[8]。
多肽经口腔、胃进入肠道,整个过程经历多种酶解环境。其中,对多肽具有酶解作用的酶主要是胰蛋白酶和胃蛋白酶,多肽在这些酶的作用下分解成分子量更小的肽以及氨基酸,其中多肽经过口腔进入胃部,pH值降为2左右,变化剧烈[9-10]。多肽的利用中,防止多肽的水解是关键,人们采用各种方法如加入糖类、多元醇和明胶等去防止其水解。目前发现,一些矿质元素与肽相互作用,一方面可以改变蛋白和肽的构型或生物活性,另一方面可以改善矿质元素的吸收性[11-12]。但是这种相互作用能否影响多肽的降解还需要深入研究。LQAFEPLR(LQ8)和EFLLAGNNK(EF9)是笔者从燕麦蛋白中获得的长链DPP4抑制肽。本文利用体外模拟胃肠消化模型,研究两种多肽(LQ8和EF9)的钙和铝的螯合肽在胃肠消化环境的稳定性,并测定体外模拟消化前后肽的红外光谱和对DPP4的抑制活性。本研究不仅为金属螯合肽的胃肠消化高耐受性提供理论基础,还可以为研究金属螯合肽促进金属离子转运吸收提供实验基础。
1 材料与方法
1.1 材料与药品
多肽EFLLAGNNK(EF9)与DPP4活性位点的结合能为(-9.1),LQAFEPLR (LQ8)与DPP4的活性位点的结合能为(-8.8),通过上海强耀生物有限公司合成这两条多肽,EF9的纯度 > 96.6%,LQ8的纯度 > 99.0%,EF9分子量1 149.25Da,LQ8分子量1 099.23Da。胃蛋白酶、胰蛋白酶和胰酶粉均购自Sigma 公司;超纯水由AquelixTM 5制备;其他检测试剂均为国产分析纯。
1.2 实验设备
TD5A-WS台式离心机,长沙湘仪离心机仪器有限公司;LL-1 500真空冷冻干燥机,赛默飞世尔科技有限公司;Model 680酶标仪,Bio-RAD;WH-2 型旋涡振荡器(旋涡混合器),常州华奥仪器制造有限公司。
1.3 多肽螯合物的制备
把EF9和LQ8按照 5%(w/v)的比例分别溶于超纯水中,用柠檬酸和NaOH溶液将溶液pH调节到5.4,分别加入无水氯化钙和无水氯化铝(多肽∶Ca=2∶1;多肽∶Al = 2∶1)。溶液在55℃下搅拌1.5h,加入3倍体积的无水乙醇去除未螯合的钙或铝,得到LQ8-Ca、EF9-Ca、LQ-Al和EF9-Al溶液。将得到的EF9-Ca、LQ8-Ca、EF9-Al和LQ-Al溶液,以8 000 r/min 的转速离心10 min,将析出物分离冷冻干燥,采用EDTA 络合滴定法,分别测定Ca和Al的螯合率。
螯合率(%)=V1/V2×100
(1)
式(1)中:V1为滴定螯合态钙离子或铝离子所消耗的EDTA溶液体积(mL);V2为滴定钙离子或铝离子总量所消耗的EDTA溶液体积(mL)。
1.4 体外模拟胃肠道消化
体外模拟胃肠道消化水解参照王凤[13]的方法进行。分别取5 mg样品(LQ8、EF9、LQ8-Ca、EF9-Ca、LQ8-Al和EF9-Al)溶解于10 mL 0.03 mol/L NaCl(pH值2.0),混合液在80℃水浴5 min后冷却至室温。以酶和多肽溶液的比例为1∶20(W/W)加入猪胃蛋白酶,在37℃恒温水浴振荡器水解,保持稳定的pH为2.0,水解时间3 h。调节pH到7.5,以酶和多肽溶液比1∶20的比例加入胰蛋白酶和胰酶粉的混合物(1∶1 w/w 胰蛋白酶∶胰酶,提前溶解于0.1 N NaHCO3),保持恒定pH值7.5和恒温37℃水解持续3 h,在75℃水浴20 min终止反应。将水解液离心(10 000×g,30 min)后取上清液冻干,干燥粉末在-20℃保存。水解后得到的样品分别记为LQ8-H、EF9-H、LQ8-HCa、EF9-HCa、LQ8-HAl和EF9-HAl。
1.5 DPP4抑制活性测定
DPP4活性检测根据王凤[13]的方法进行。反应在96孔板内进行,加入10μL DPP4(终浓度为100 ng/mL),50μL发光底物Gly-Pro-pNA(终浓度为500μmol/L),40μL待检测的多肽样品,所用的溶解液均为100 mmol/L Tris-buffer缓冲液(pH 8.0),反应在37℃下培养1.0h,酶标仪405 nm处测其吸光值。每个实验至少做3组平行。100% 酶活组将以上加样品步骤换成加Tris-buffer缓冲液,加入量与样品量一致;自身对照将以上加酶步骤换成Tris-buffer缓冲液,加入量与酶量一致。实验结果用DPP4抑制性(%)和IC50值(DPP4抑制活性达到50%时的样品浓度,mg/mL)表示。
DPP4抑制性(%)=(样品吸光值-自身对照吸光值)/(100% 酶活吸光值)× 100
(2)
1.6 红外光谱检测
采用傅里叶变换红外光谱仪进行扫描,仪器预热稳定后,采用KBr可拆卸液体池加样,扫描红外吸收光谱,扫描范围400~4 000cm-1,分辨率4cm-1,扫描次数70,保存谱图。采用点平滑、归一化及基线校正等预处理方法对光谱进行处理。将所得特征峰的面积比值作为坐标,用Origin 8.0作图。
1.7 数据处理
数据显著性由SPSS处理,图像绘制由GraphPad Prism 5.01和Origin 8.0完成。数据表示为平均值±标准差。
2 结果与分析
2.1 多肽与金属元素的螯合率
如图1所示,多肽LQ8-Ca、EF9-Ca、LQ8-Al和EF9-Al的螯合率分别为12.7%、9.0%、9.3%和12.3%,相比于天然多肽,LQ8和EF9与金属元素的螯合率比较低。张美玲等[12]研究了大豆分离蛋白与钙的螯合,终产物的螯合率达到了76.6%,远高于笔者研究的多肽与钙的螯合率;崔潇等[14]研究了罗非鱼鱼皮胶原多肽与镁离子的螯合,螯合率达到84.6%;刘永等[15]对罗非鱼鱼鳞胶原蛋白肽锌螯合物进行了研究,螯合率为91.96%。LQ9和EF8都是短肽,羧基和氨基这些基团含量少,可以螯合金属的位点比较少,因此螯合率低。

图1 LQ8和EF9与钙和铝的螯合率
2.2 LQ8和EF9及其金属螯合物的DPP4抑制活性
如图2所示,LQ8有很强的DPP4抑制活性,且抑制活性具有浓度依赖性,其IC50值为103.5μM,而研究发现,EF9的DPP4的抑制活性比较弱,在样品浓度达到400μg/mL时,其抑制活性仅为31%。LQ8与钙螯合后,LQ8-Ca对DPP4的抑制活性与LQ8相比变化不大,IC50值为91.6μM;LQ8与铝螯合后,LQ8-Al对DPP4的抑制活性显著下降(P<0.05),在样品浓度达到400 μg/mL时,其抑制活性仅为57%。EF9-Ca对DPP4的抑制活性相对于EF9显著升高(P<0.05),但对DPP4的抑制活性仍然较低,在样品浓度达到400μg/mL时,其抑制活性仅为45%;EF9-Al对DPP4的抑制活性显著升高,其IC50值为156μM。这些结果说明,多肽与金属元素螯合后,其结构发生了比较大的变化,导致其活性发生改变。
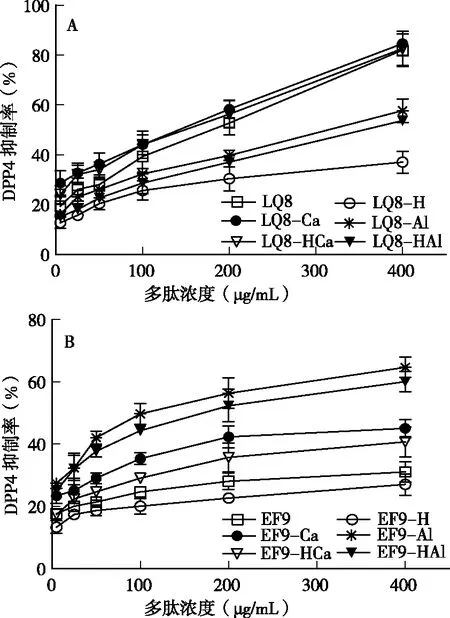
图2 多肽及多肽金属螯合物体外模拟水解前后的DPP4抑制活性 注:DPP4的终浓度为100 ng/mL;底物的浓度为500μmol/L;多肽的终浓度为5.0、25、50、100、200和400μg/mL
2.3 LQ8和EF9及其金属螯合物的红外光谱
当金属离子与多肽氨基酸残基结合后,其变化可以通过肽的羧酸酯和酰胺的特征红外吸收峰的变化观察出来[16-17]。图3A和3B表示多肽及多肽钙和多肽铝红外光谱图。在3 285~3 347 cm-1处属于酰胺A带的N-H 收缩振动峰,1 600~1 647cm-1之间出现的强吸收峰属于酰胺I带,是由蛋白多肽骨架C=O伸缩振动所引起的,1 426~1 453 cm-1属于多肽氨基酸残基的侧链基团,由苯环骨架振动造成的,1 027~1 088 cm-1处为C-O-C收缩振动峰。LQ8和EF9分别在3 366 cm-1、3 321 cm-1处有吸收峰,当LQ8和EF9分别与钙和铝螯合后,LQ8-Ca、EF9-Ca、LQ8-Al和EF9-Al出峰位置都出现了迁移,吸收峰分别变为3 347cm-1、3 300cm-1、3 327 cm-1、3 285 cm-1,原因是因为钙或铝与蛋白螯合后,N-H伸缩振动峰参与了氢键的形成[18]。在1 639 cm-1和1 620 cm-1处LQ8和EF9都出现了较强的吸收峰,两种多肽分别和钙螯合后,LQ8-Ca和EF9-Ca的吸收峰分别为1 647cm-1和1631 cm-1,说明钙与氨基有结合,并发生了红移;两种多肽分别与铝螯合后,LQ8-Al和EF9-Al的吸收峰分别为1 621cm-1和1 600 cm-1,说明铝与氨基有结合,并向短波位移动,这与Shi[19]报道的结果一致。
2.4 体外模拟水解前后LQ8和EF9及其金属螯合物对DPP4的抑制活性
利用体外胃肠道模拟消化模型对LQ8、LQ8-Ca、LQ8-Al、EF9、EF9-Ca和EF9-Al进行水解后,这6种多肽仍具有DPP4抑制活性,且对DPP4的抑制活性呈浓度依赖性。相比于LQ8,LQ8-H对DPP4的抑制活性显著下降(P<0.05),在样品浓度达到400μg/mL时,其抑制活性仅为37%;体外模拟水解对LQ8-HCa和LQ8-HAl的影响不大,LQ8-HCa对DPP4仍具有很高的抑制活性,其IC50值为97.6μM,LQ8-HAl对DPP4的抑制活性虽然不高,但相对于LQ8-Al的变化并不大。EF9-HCa和EF9-HAl对DPP4的抑制活性相对于水解前变化也不大,EF9-HCa和EF9-HAl在在样品浓度达到400μg/mL时,对DPP4的抑制率分别达到了41%和60%。LQ8和EF9两种多肽经体外模拟胃肠道消化后,对DPP4的抑制活性显著降低,原因是两种多肽经酶水解后,它们的空间结构发生改变,导致其活性降低;LQ8和EF9与钙或铝的螯合可以改变这两种多肽的构象,抑制其进一步发生水解,保持多肽的活性[10]。
2.5 体外模拟水解前后LQ8和EF9及其金属螯合物的红外光谱图
多肽及多肽的金属螯合物经体外模拟水解后,仍具有典型的蛋白吸收峰(图3)。LQ8经酶水解后,LQ8-H的C=O伸缩振动峰由1 639cm-1移至1 637cm-1,向短波位移动,且吸收峰加强,且LQ8-H在1 051cm-1处的C-O-C吸收峰消失;LQ8-HCa和LQ8-HAl的C=O伸缩振动峰只发生了迁移,分别从1 647cm-1移动至1 641cm-1和1 621cm-1移动至1 619 cm-1。多肽EF9经过体外模拟水解后,EF9-H的C=O伸缩振动峰也发生了较大的变化,C=O伸缩振动峰由1 620 cm-1移至1 616cm-1,向短波位移动,与LQ8-H的不同的是,EF9-H的吸收峰变弱;EF9-HCa和EF9-HAl的吸收峰与EF9-Ca和EF9-Al相比变化不大。
3 结论
多肽LQ8和EF9对DPP4都有抑制活性,但EF9的抑制活性不高,EF9螯合钙或铝之后,EF9-Ca和EF9-Al对DPP4的抑制活性显著升高;LQ8和EF9被酶水解后,对DPP4的抑制活性显著下降;LQ8和EF9与金属元素螯合后,其水解产物LQ8-HCa、LQ8-HAl、EF9-HCa和LQ8-HAl对DPP4的抑制活性基本保持不变;通过傅里叶红外光谱发现,多肽金属螯合物经体外模拟水解后,其水解前后红外光谱基本保持不变,而LQ8和EF9水解前后的红外光谱变化较大。本研究表明,多肽LQ8和EF9螯合金属元素后,其构象发生改变,导致其对蛋白酶的耐受性和生物活性发生变化。◇
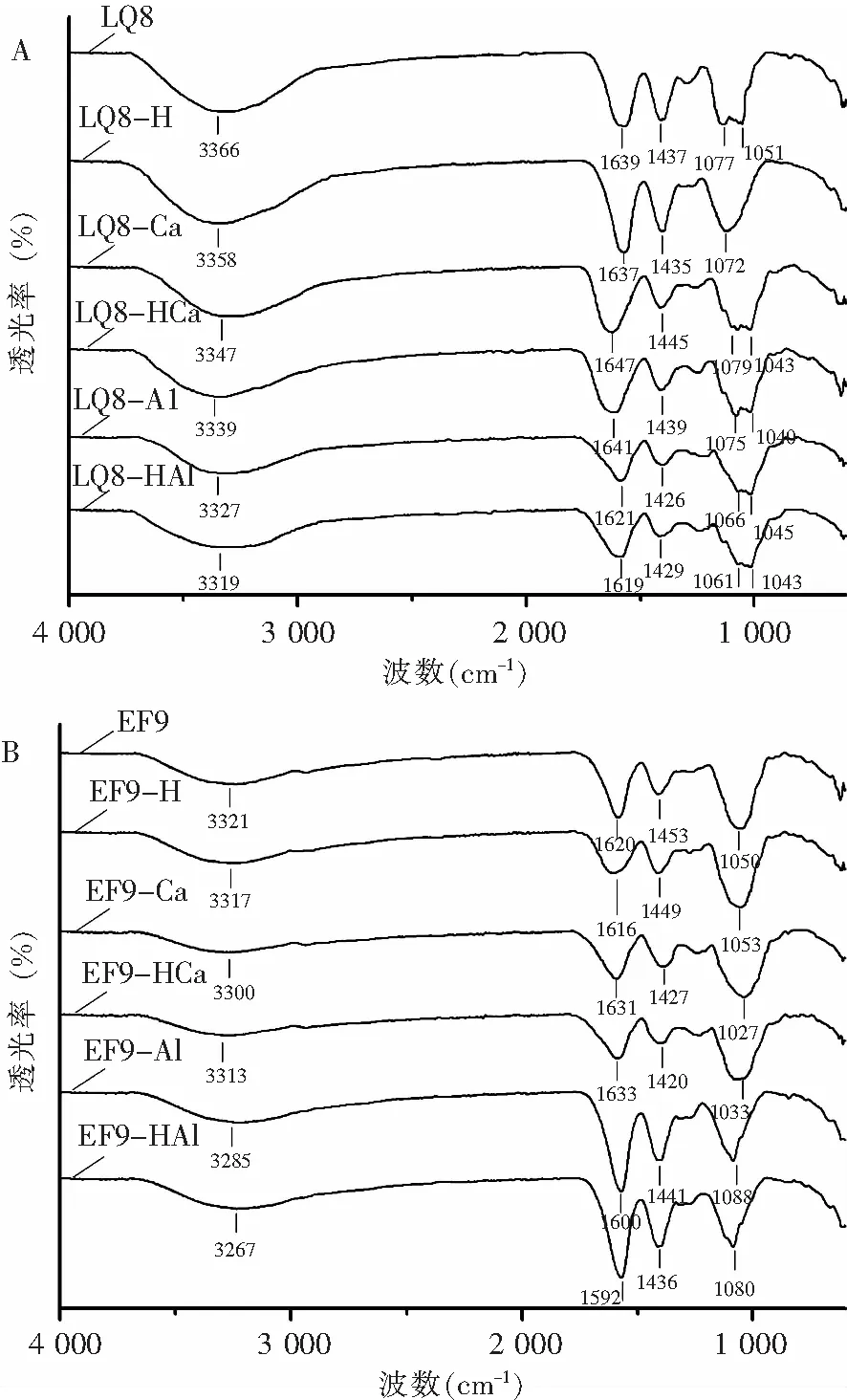
图3 多肽及多肽金属螯合物体外模拟水解前后的红外光谱图
[1]李璀.靶向DPP4和PTP1B的Ⅱ型糖尿病药物设计研究[D]. 华东理工大学,2011.
[2]陆菊明.DPP4抑制剂单药治疗和联合治疗方案及疗效分析[J]. 药品评价,2012(34):31-36.
[3]Nongonierma A.B.,Fitzgerald,R.J.Dipeptidyl peptidase iv inhibitory and antioxidative properties of milk protein-derived dipeptides and hydrolysates [J]. Peptides,2013,39(1):157-163.
[4]Cavazos A.,Mejia E.G.D.Identification of bioactive peptides from cereal storage proteins and their potential role in prevention of chronic diseases [J]. Comprehensive Reviews in Food Science and Food Safety,2013,12(4):364-380.
[5]Velarde-Salcedo A.J.,Barrera-Pacheco A.,Lara-González S.,et al.In vitro,inhibition of dipeptidyl peptidase iv by peptides derived from the hydrolysis of amaranth proteins [J]. Food Chemistry,2013,136(2):758-764.
[6]Lacroix I.M.E.,Li-Chan E.C.Y.Evaluation of the potential of dietary proteins as precursors of dipeptidyl peptidase DPP4 inhibitors by an in silico,approach [J]. Journal of Functional Foods,2012,4(2):403-422.
[7]Nongonierma A.B.,Fitzgerald R J.Susceptibility of milk protein-derived peptides to dipeptidyl peptidase iv (dpp-iv)hydrolysis [J]. Food Chemistry,2014,145(145C),845-852.
[8]黎金.荞麦多肽制备及其抗氧化活性研究[D]. 西北农林大学,2009.
[9]赵力超,宁德山,龙梓祺,等.酪蛋白磷酸肽副产物中ACEI肽的分离鉴定及稳定性研究[J].现代食品科技,2014,30(10):52-57.
[10]杜芬,侯虎,赵玉然,等.鳕鱼源金属螯合肽体外模拟胃肠消化稳定性研究[J].现代食品化学,2016,32(7):33-38.
[11]高红梅,桑宏庆,李淑贤.小麦肽-锌螯合物的制备[J].饮料工业,2013,16(7):23-26.
[12]张美玲,赵新淮.大豆蛋白水解物的酶法修饰及其亚铁和钙离子的螯合能力[J].食品与发酵工业,2012,38(12):26-30.
[13]王凤.燕麦多肽的结构特征及DPP4抑制作用[M].北京:北京林业大学,2016.
[14]崔潇,江虹锐,刘小玲,等.响应面法优化罗非鱼鱼皮胶原多肽螯合镁的工艺条件的研究[J].食品工业科技,2013,34(15):238-245.
[15]刘永,黎彬庆,韦寿莲.罗非鱼鳞胶原蛋白肽锌螯合物制备工艺优化[J].食品与发酵工业,2013,39(4):125-129.
[16]Mizuguchi M.,Fujisawa R.,Nara M.,et al.Fourier-transform infrared spectroscopic study of Ca2+-binding to osteocalcin[J].Calcified Tissue International,2001,69(6):337-342.
[17]Nara M.,Morii H.,Tanokura M.Coordination to divalent cations by calcium-binding proteins studied by ftir spectroscopy [J]. Biochimica Et Biophysica Acta,2013,1828(10):2319-2327.
[18]Zhe P.,Hu H.,Kai Z.,et al.Effect of calcium-binding peptide from pacific cod (gadus macrocephalus)bone on calcium bioavailability in rats [J]. Food Chemistry,2017,221:373-378.
[19]Shi J.,Wang J.Interaction between metal cation and unnatural peptide backbone mediated by polarized water molecules:study of infrared spectroscopy and computations [J]. Journal of Physical Chemistry B,2014,118(43):12336-12347.
[20]邵剑钢,钱平,刘晋,等.小麦低聚肽的功能作用研究进展及应用前景展望[J]. 中国食物与营养,2016,22(10):72-74.
[21]李雪芬,杜斌,丁轲,等.金属螯合肽分离纯化及其抗氧化活性的研究进展[J]. 中国食物与营养,2016,22(3):35-39.

