有机磷酸盐-与无机磷酸盐-钙化诱导培养基诱导主动脉瓣膜间质细胞钙化效果的对比研究
薛清,李宁,褚恒,刘晓红,韩林,徐志云
主动脉瓣钙化是临床常见的心脏瓣膜疾病,也是导致主动脉瓣狭窄的常见原因,其发生机制目前尚未完全明确,主要治疗措施为外科手术[1]。主动脉瓣膜间质细胞(AVICs)是构成主动脉瓣的主要细胞之一,对维持瓣膜正常形态和功能、促进瓣膜疾病发生发展均具有重要作用,被认为是主动脉瓣异位钙化中成骨细胞的主要来源[2]。有机磷酸盐(OP)-钙化诱导培养基(OIM)诱导AVICs钙化约需要21 d,周期较长,且诱导钙化过程易受微生物污染等因素干扰[3],而OP转化为无机磷酸盐(IP)后才能发挥诱导钙化作用[4-5]。本研究旨在比较OP-OIM与IP-OIM诱导AVICs钙化的效果,为快速构建体外AVICs钙化模型提供参考依据,现报道如下。
1 材料与方法
1.1 标本采集 主动脉瓣膜来源于2017年1—10月在第二军医大学附属长海医院行心脏移植的患者,取外观正常的主动脉瓣膜备用。本研究获得第二军医大学附属长海医院医学伦理委员会审核批准,患者及其家属均签署知情同意书。排除术前伴主动脉瓣膜疾病、冠心病者。
1.2 主要试剂与仪器
1.2.1 主要试剂 人Ⅱ型胶原酶、β-甘油磷酸、抗坏血酸、地塞米松购自Sigma-Aldrich公司;DMEM培养基、胎牛血清、青霉素/链霉素双抗液、0.25%胰蛋白酶购自Gibco公司;鼠抗人Vimentin抗体、Alexa Flour594标记的羊抗鼠IgG、鼠抗人CD31抗体、Alexa Flour568标记的羊抗鼠IgG、鼠抗人β-actin抗体购自Santa Cruz公司;二水合磷酸二氢钠、三氯甲烷、异丙醇、甲醇购自国药集团化学试剂有限公司;生物合成人胰岛素注射液购自丹麦诺和诺德公司;Trizol裂解液、SDS蛋白裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白浓度测定试剂盒、彩色预染蛋白质分子量标准、SDS-PAGE蛋白上样缓冲液(5X)、SDS-PAGE凝胶配制试剂盒、Western封闭液、Western一抗稀释液、兔抗人Runt相关转录因子2(RUNΧ2)抗体、辣根过氧化物酶标记的羊抗兔IgG、辣根过氧化物酶标记的羊抗鼠IgG、超敏ECL化学发光试剂盒购自Beyotime公司;DEPC处理水购自Solarbio公司;PrimeScriptTMRT reagent Kit、SYBR Premix Ex Taq Ⅱ购自TaKaRa公司;三羟甲基氨基甲烷、十二烷基硫酸钠、甘氨酸购自广东金砂化工厂;茜素红购自上海生工生物工程股份有限公司;钙测定试剂盒(邻甲酚酞络合酮比色法)购自中生北控生物科技股份有限公司。
本研究背景:
经典的有机磷酸盐-钙化诱导培养基完成1次细胞钙化约需21 d,周期较长,且在培养过程中易受到各种因素干扰,如微生物污染等。笔者所在课题组通过查阅文献发现,有机磷酸盐是在转化为无机磷酸盐后才发挥诱导钙化作用,故提出是否可以直接采用无机磷酸盐-钙化诱导培养基培养细胞钙化的假设,以寻找一种快速有效的钙化诱导方法,为今后基础研究提供便利条件。
1.2.2 主要仪器 MP200B电子天平购自上海第二天平衡器厂;IX70激光扫描共聚焦显微镜购自Olympus公司;流式细胞仪、NanoDrop2000分光光度计购自ThermoFisher公司;低温高速离心机购自Eppendorf公司;GeneAmp聚合酶链反应(PCR)扩增仪、ABI Step One实时荧光定量PCR仪购自Applied Biosystems公司;酶标仪购自普林斯顿公司;蛋白电泳仪、电泳槽、SX-100凝胶成像分析系统购自Bio-Rad公司;PVDF膜购自Millipore公司。
1.3 方法
1.3.1 AVICs分离和培养 采用改良的二次胶原酶消化法分离AVICs,具体如下:取正常主动脉瓣膜组织经人Ⅱ型胶原酶消化处理两次后去除组织残渣,剩余液体1 500 r/min离心5 min(离心半径168 mm),去上清,底部沉淀即为AVICs。将细胞重悬后接种于培养板,于培养箱中培养,2 d换液1次,至细胞融合度达到90%~100%传代,取第3~5代细胞备用。
1.3.2 AVICs鉴定 (1)采用细胞免疫荧光法检测Vimentin,具体如下:AVICs贴壁生长,当细胞融合度达到40%~50%时去除培养基,磷酸盐缓冲液(PBS)润洗1次;加入免疫染色固定液室温下静置15 min,去除固定液,PBS润洗3次;加入0.3% Triton X-100室温下静置10 min,去除破膜液,PBS润洗3次;加入免疫染色封闭液室温下静置10 min,去除封闭液,加入一抗工作液(鼠抗人Vimentin抗体:免疫染色一抗稀释液为1:200)4 ℃过夜,室温下复温1 h,PBS润洗3次;加入二抗工作液(Alexa Flour594标记的羊抗鼠IgG:PBS为1:400)室温下避光静置30 min,PBS润洗3次;加入DAPI荧光染色液室温下避光静置3 min,PBS润洗3次;荧光显微镜下观察并拍照,其中红色荧光为Vimentin、蓝色荧光为细胞核。(2)采用流式细胞术检测CD31,具体如下:AVICs贴壁生长2~3 d,当细胞融合度达到90%~100%时去除培养基,PBS润洗1次;加入0.25%胰蛋白酶室温下静置5 min,加入等体积普通培养基(含10%胎牛血清的DMEM培养基)中和胰蛋白酶,1 200 r/min 离心5 min(离心半径168 mm),去除上清液;加入PBS重悬细胞,1 200 r/min离心5 min(离心半径168 mm),去除上清液;加入一抗工作液(鼠抗人CD31抗体:免疫染色一抗稀释液为1:200)室温下静置1 h,1 200 r/min 离心5 min(离心半径168 mm),去除上清液;加入PBS重悬细胞,1 200 r/min离心5 min(离心半径168 mm),去除上清液;加入二抗工作液(Alexa Flour568标记的羊抗鼠IgG:PBS为1:400)室温下避光静置30 min,1 200 r/min离心5 min(离心半径168 mm),去除上清液;加入PBS重悬细胞,1 200 r/min离心5 min(离心半径168 mm),去除上清液;加入PBS重悬细胞,上机检测。
1.3.3 实验分组 将备用AVICs于6孔板中贴壁生长,当细胞融合度达到40%~50%时随机分为A组与B组。A组采用普通培养基+OP-OIM进行培养,每2 d换液1次;B组采用普通培养基+IP-OIM进行培养,每2 d换液1次。OP-OIM:β-甘油磷酸10 mmol/L、抗坏血酸10 μg/ml、地塞米松10 nmol/L;IP-OIM:二水合磷酸二氢钠2 mmol/L、抗坏血酸50 μg/ml、生物合成人胰岛素注射液100 nmol/L。
1.3.4 茜素红染色 采用茜素红染色观察钙化结节,具体如下:去除AVICs培养基,采用4%多聚甲醛固定10 min,95%乙醇冲洗后采用1%茜素红染色10 min,去除染色液,采用95%乙醇冲洗后于显微镜下观察并拍照,其中橘红色结节为钙化结节,以出现钙化结节为AVICs钙化模型构建成功。
1.3.5 邻甲酚酞络合酮比色法 采用邻甲酚酞络合酮比色法检测A组细胞培养21 d、B组细胞培养7 d钙含量,具体如下:去除AVICs培养基,PBS润洗后加入0.6 mol/L盐酸脱钙24 h,取上清液,采用邻甲酚酞络合酮比色法检测钙浓度;脱钙后的细胞经PBS润洗3次,加入0.1 mol/L氢氧化钠(NaOH)和0.1% SDS蛋白裂解液裂解细胞30 min,采用BCA法检测蛋白浓度,并计算钙含量,钙含量=钙浓度/蛋白浓度。
1.3.6 实时荧光定量PCR 采用实时荧光定量PCR检测A组细胞培养0、21 d及B组细胞培养0、7 d RUNΧ2、碱性磷酸酶(ALP)mRNA表达情况,具体如下:采用Trizol裂解液抽提总mRNA,逆转录为互补脱氧核糖核酸(cDNA),并以cDNA为模板行实时荧光定量PCR。实时荧光定量PCR引物由上海生工生物工程股份有限公司合成,引物序列详见表1。反应步骤:pre-incubation:95 ℃(30 s),1个循环;amplification:95 ℃(10 s),60 ℃(20 s),40个循环;Melting Curve:95 ℃(15 s),60 ℃(60 s),95 ℃(60 s),1个循环;Cooling:40 ℃(60 s)1个循环。以β-actin作为内参,采用ΔΔCT法计算各样本间目的基因mRNA表达的倍比关系即为各样本目的基因mRNA相对表达量。

表1 实时荧光定量PCR引物序列Table 1 Primer sequence for RT-qPCR
1.3.7 蛋白质免疫印迹法 采用蛋白质免疫印迹法检测A组细胞培养0、21 d及B组细胞培养0、7 d RUNΧ2蛋白表达情况,具体如下:抽提总蛋白,经超声破碎仪辅助裂解,采用BCA法测定蛋白浓度,并于沸水中煮10~15 min制成蛋白样本;配制SDS-PAGE分离胶、浓缩胶、电泳缓冲液,每组蛋白样本取20 μl进行电泳,湿转法转膜后根据目的蛋白分子量裁剪目的条带和内参条带,Western封闭液封闭1 h,将目的条带和内参条带分别浸没在由Western一抗稀释液、目的蛋白抗体或内参蛋白抗体配制成的一抗工作液中,4 ℃摇床摇晃过夜;室温下复温1 h,TBST清洗3次,10 min/次;配制二抗工作液并浸没目的条带和内参条带,摇床摇晃1 h,TBST清洗3次,10 min/次;将目的条带和内参条带分别置于SX-100凝胶成像仪中,滴加化学发光工作液并拍照;采用Image J软件进行图像处理,以目的条带灰度值与内参条带灰度值的比值作为目的蛋白相对表达量。
1.3.8 对硝基苯酚比色法 采用对硝基苯酚比色法检测A组细胞培养0、21 d及B组细胞培养0、7 d ALP活性,具体如下:去除AVICs培养基,加入1 ml GENMED清理液覆盖细胞表面,小心吸除清理液,使用细胞刮脱棒轻柔刮脱细胞;再次加入1 ml GENMED清理液,混匀后移至预冷的1.5 ml离心管中,1 200 r/min离心5 min(离心半径168 mm),去除上清液;加入200 μl GENMED裂解液,混匀后移至新的预冷的1.5 ml离心管中,震荡15 s,冰上孵育30 min,13 000 r/min离心5 min(离心半径47 mm);移取500 μl上清液至新的预冷的1.5 ml离心管中,采用BCA法检测蛋白浓度;96孔板依次加入220 μl GENMED缓冲液、25 μl GENMED反应液,37 ℃孵育3 min,分别加入5 μl GENMED清理液或待测样本,放入酶标仪中检测405 nm波长时0、5 min读数,并计算ALP活性,ALP活性=〔(待测样本读数-对照样本读数)×样本稀释倍数×0.25〕×(0.005×18.5×0.6×5)-1×待测样本蛋白浓度-1。
1.4 统计学方法 采用SPSS 22.0统计软件进行数据处理,计量资料以(±s)表示,两组比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AVICs鉴定结果 Vimentin是间叶源性细胞标志物,细胞免疫荧光检测结果显示,分离得到的细胞Vimentin阳性率接近100%,见图1。CD31是内皮细胞标志物,流式细胞术检测结果显示,分离得到的细胞CD31阳性率为1.17%,见图2。
2.2 钙化结节和钙含量 A组细胞培养21 d可见大量橘红色钙化结节,B组细胞培养7 d可见大量橘红色钙化结节,见图3。A组细胞培养21 d钙含量为(0.107±0.007)mg/mg蛋白,B组细胞培养7 d钙含量为(0.105±0.011)mg/mg蛋白。A组细胞培养21 d和B组细胞培养7 d钙含量比较,差异无统计学意义(t=0.266,P=0.804)。
2.3 RUNΧ2和ALP mRNA相对表达量 以细胞培养0 d作为对照,A组细胞培养21 d RUNΧ2 mRNA相对表达量为(1.568±0.302),ALP mRNA相对表达量为(1.345±0.118);B组细胞培养7 d RUNΧ2 mRNA相对表达量为(1.907±0.214),ALP mRNA相对表达量为(2.171±0.178)。A组细胞培养21 d与B组细胞培养7 d RUNΧ2 mRNA相对表达量比较,差异无统计学意义(t=1.586,P=0.188);但A组细胞培养21 d与B组细胞培养7 d ALP mRNA相对表达量比较,差异有统计学意义(t=6.699,P=0.003)。

图1 细胞免疫荧光法检测结果(DAPI复染,×200)Figure 1 Cell immunofluorescence detection results

图2 流式细胞术检测结果Figure 2 Flow cytometry test results
2.4 RUNΧ2蛋白相对表达量 A组细胞培养0 d RUNΧ2蛋白相对表达量为(0.218±0.015),培养21 d为(1.031±0.024);B组细胞培养0 d RUNΧ2蛋白相对表达量为(0.197±0.014),培养7 d为(0.991±0.032)。两组细胞培养0 d RUNΧ2蛋白相对表达量比较,差异无统计学意义(t=1.773,P=0.151);A组细胞培养21 d与B组细胞培养7 d RUNΧ2蛋白相对表达量比较,差异无统计学意义(t=1.732,P=0.158)。
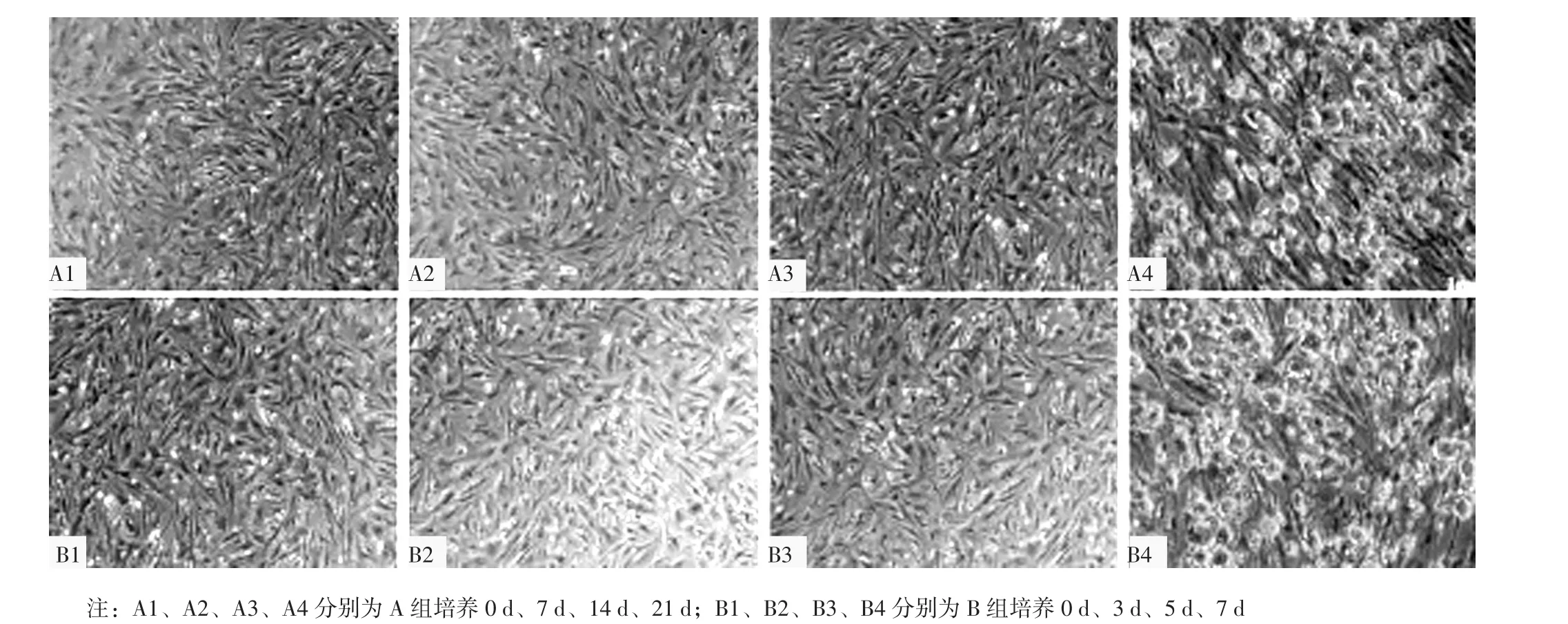
图3 两组细胞培养不同时间点钙化结节(茜素红染色,×100)Figure 3 Calcified nodes in the two groups at different time points of cultivation
2.5 ALP活性 A组细胞培养0 d ALP活性为(0.011±0.002)U/mg蛋白,培养21 d为(0.185±0.019)U/mg蛋白;B组细胞培养0 d ALP活性为(0.012±0.003)U/mg蛋白,培养7 d为(0.196±0.024)U/mg蛋白。两组细胞培养0 d ALP活性比较,差异无统计学意义(t=0.480,P=0.656);A组细胞培养21 d与B组细胞培养7 d ALP活性比较,差异无统计学意义(t=1.732,P=0.158)。
3 讨论
主动脉瓣钙化类似于成骨,是一个主动的可逆的病理过程[6],涉及瓣膜间质细胞和内皮细胞转分化、细胞外基质重塑、新生血管形成、血流机械应力改变、脂质浸润、钙磷代谢紊乱、炎性刺激等[7-8]。主动脉瓣钙化可引起主动脉瓣狭窄、关闭不全等,已成为临床研究热点。AVICs是构成主动脉瓣膜的主要细胞之一,也是主动脉瓣异位钙化中成骨细胞的主要来源。因此获取优质的AVICs是建立体外钙化模型的前体条件,本研究采用改良的二次胶原酶消化法分离AVICs,结果显示,分离得到的细胞Vimentin阳性率接近100%,CD31阳性率为1.17%,提示采用改良的二次胶原酶消化法分离得到的AVICs纯度较高,符合细胞实验要求。
OIM是建立体外AVICs钙化模型的关键,目前常用的OP-OIM主要由β-甘油磷酸、抗坏血酸、地塞米松组成[9],其中β-甘油磷酸被认为是最重要的钙化诱导因素之一,其经ALP分解后可产生IP,进而诱导钙化[10];抗坏血酸能促进软骨细胞成熟,提高软骨细胞中ALP含量,进而加速钙化[11]。但OP-OIM诱导AVICs钙化周期较长,约为21 d,且诱导钙化过程易受到多种因素干扰而导致建模失败[12]。因此,寻找一种培养周期较短、易操作的OIM具有重要的研究价值。李寰等[13]研究结果显示,β-甘油磷酸诱导细胞钙化无浓度依赖性,12 mmol/L时效果最佳;>100 nmol/L地塞米松对细胞生长、增殖均具有抑制作用,而100 nmol/L地塞米松有利于细胞成骨化[14]。近年研究结果显示,碱性环境、炎性因子、骨形态发生蛋白2等均可与β-甘油磷酸协同诱导钙化,但其对缩短钙化时间均无明显作用[15-18]。鉴于OP是转化为IP后才发挥钙化诱导作用,本研究分别采用OP-OIM与IP-OIM培养AVICs,并比较两种OIM对AVICs钙化的影响。
本研究结果显示,A组细胞培养21 d、B组细胞培养7 d可见大量橘红色钙化结节,提示A组细胞培养21 d时成功建立AVICs钙化模型,B组细胞培养7 d时成功建立AVICs钙化模型。钙含量可直观地反映钙化程度,RUNΧ2和ALP是AVICs向成骨细胞转分化的标志物,亦可有效评估钙化程度。本研究结果显示,A组细胞培养21 d与B组细胞培养7 d 钙含量间无差异,A组细胞培养21 d与B组细胞培养7 d RUNΧ2 mRNA相对表达量、RUNΧ2蛋白相对表达量、ALP活性间均无差异,但A组细胞培养21 d与B组细胞培养7 d ALP mRNA相对表达量间有统计学差异,提示A组细胞培养21 d与B组细胞培养7 d AVICs钙化效果相当;虽然A组细胞培养21 d与B组细胞培养7 d ALP mRNA相对表达量间有统计学差异,但A组细胞培养21 d与B组细胞培养7 d ALP活性间无差异,故对评价钙化效果无影响。
综上所述,IP-OIM培养7 d与OP-OIM培养21 d诱导的AVICs钙化效果相当,IP-OIM诱导AVICs钙化较OP-OIM缩短14 d,可替代OP-OIM快速有效地建立体外AVICs钙化模型。
参考文献

