7个马铃薯新品系的主要农艺性状与营养品质及其细胞学和SSR分析
张明飞,于 卓,于肖夏*,李晓宇,郭云汉,王殿清
(1 内蒙古农业大学 农学院,呼和浩特 010019;2 呼和浩特市农业技术推广中心,呼和浩特 010050)
马铃薯是世界四大重要粮食作物之一[1-3],其块茎富含淀粉、膳食纤维、维生素、矿物质及抗氧化物质花青素和酚类等成分,营养价值高,素有“地下苹果”之称,且有一定的药用价值[4-7]。近几年来,中国逐渐意识到马铃薯在国民经济、粮食保障、生态安全和居民膳食营养中的重要作用,并不断强化马铃薯产业发展的政策支持,使得马铃薯种植面积呈扩大趋势,总产量明显提高。但与美国、加拿大、荷兰等马铃薯产业化发达国家相比,中国马铃薯加工等专用品种数量严重不足。如荷兰马铃薯加工等专用品种有200余种,分为鲜食型、淀粉型、全粉型、薯条和薯片及高花青素含量特色专用型等。而中国马铃薯生产和推广应用的品种多以鲜食菜用品种为主,用于加工薯条薯片、全粉和淀粉及彩色等特色马铃薯品种甚少[8]。在中国马铃薯主粮化战略的驱动下,消费市场对加工专用型及彩色马铃薯等特色品种的需求量日益增大,选育加工专用型等马铃薯新品种实属必要。
为培育出抗病性和适应性强、商品性能好、品质性状优异且高产稳产的马铃薯新品种,近几年来我们依据生态型差异大、优缺点互补的亲本组配原则,用美国引进的马铃薯材料YSP-4、AM-27和MIN-21与国内育成的马铃薯品种‘陇薯7号’、‘黑美人’作亲本,通过人工授粉杂交,获得了3个杂交组合YSP-4×MIN-21、AM-27ב黑美人’、YSP-4ב陇薯7号’的F1代分离单株群体,并利用常规表型选择与DNA分子鉴定相结合的方法,育成了综合农艺性状表现突出的7个马铃薯杂种新品系NMS-A42、NMS-A187、NMS-A217、NMS-B53、NMS-B107、NMS-B327和NMS-C92。2015~2016年,分别在内蒙古的呼和浩特市托克托县古城镇和赤峰市巴林左旗林东镇两地的马铃薯试验基地,同时进行了品比试验和区域试验,对照为当地主栽品种‘克新1号’及杂交亲本‘黑美人’和‘陇薯7号’。
本试验重点对这7个新品系的主要性状(熟性、薯形、产量、营养品质)、育性和染色体配对构型以及DNA水平的遗传差异进行分析,以期为下一步马铃薯新品种的育成登记和利用提供依据。
1 材料和方法
1.1 试验材料
试验材料为优良新品系NMS-A42、NMS-A187和NMS-A217及其亲本YSP-4和MIN-21,新品系NMS-B53、NMS-B107和NMS-B327及其亲本AM-27和‘黑美人’,新品系NMS-C92及其亲本YSP-4和‘陇薯7号’,以亲本材料作为对照。种薯由内蒙古农业大学马铃薯遗传育种研究所提供。
1.2 试验地概况及栽培管理方法
试验于2017年4~10月,在内蒙古农业大学农学院作物试验场网棚内及室内进行。试验区年降水量400 mm左右,无霜期140 d。土壤质地为沙壤质土,pH 7.8,肥力中等。按不同品系随机区组排列设计,种植方式为穴播起垄种植,种植深度约为12 cm,株距25 cm,行距90 cm。小区面积30 m2,每种材料3次重复。播种时施入0.09 kg/m2的马铃薯专用复合肥作基肥。出苗后生长期内适时浇水,并依据长势情况追施氮肥和钾肥各0.03 kg/m2。在株高约15和30 cm时,分别中耕培土1次。
1.3 PMCMⅠ染色体配对行为和花粉可育率观测
在现蕾期,上午10:00左右于网棚内分别取7个马铃薯新品系及其双亲的幼小花蕾,放入卡诺液中,带回室内于4 ℃冰箱中固定24 h后,清水洗去花蕾表面的卡诺液后转入70%乙醇中4 ℃保存备用。制片时,将花蕾中花粉母细胞挤在载玻片上,卡宝品红溶液染色压片[9]。用Olympus BX51显微镜在100倍油镜下观察、选取染色体分散好的细胞,观察其染色体形态确定单价体、二价体、三价体和四价体类型,统计其染色体数目并照相,每种材料观察细胞数150个以上(表1),各品系染色体构型观察统计参照李懋学等提出的方法[10]。
在盛花期取各材料的花药带回室内,置于载玻片上用镊子挤出花粉,1%醋酸洋红染液染色,在10倍显微镜下观察花粉粒形态,每种材料观察视野100个以上,分别统计可育和不育花粉粒数目。花粉可育率(%)=(可育花粉粒总数/观察花粉粒总数)×100%。观察标准:花粉粒饱满充实、染色深的为可育花粉,而花粉粒瘪缩、着色浅或不着色的为不育花粉。
1.4 块茎性状的观测
在马铃薯成熟期观测生育期和熟性;收获时,调查记录各供试材料块茎表现特征及产量性状,包括单株结薯数和产量、商品薯率、结薯集中性、芽眼深浅度、表皮光滑度、薯形、皮色、肉色等,每种材料单株产量、结薯数和商品薯率均随机取50个单株进行测定,并计算其平均值。商品薯率用薯块的不同重量表示,薯重<100 g记为小薯,100 g≤薯重≤150 g记为中薯,薯重>150 g记为大薯,商品薯率为单株大中薯数量占单株结薯总数的百分率,商品薯率=(单株大中薯数/单株结薯数)×100%[11]。
1.5 块茎营养品质性状的测定
在收获后2周内,随机选取各材料150 g以上的薯块测定其块茎淀粉、干物质、蛋白质、还原糖、维生素C含量及彩色马铃薯新品系的花青素含量。
淀粉含量测定用碘-碘化钾比色法[11],6次重复。干物质含量测定采用烘干法,测量块茎鲜重后,切片置于烘箱中105 ℃杀青30 min,60 ℃烘干72 h,至样品恒定后测其干重,6次重复,块茎中干物质含量(%)=(干重/鲜重)×100%。蛋白质含量测定用双缩脲法[11],5次重复。还原糖含量测定用3,5-二硝基水杨酸(DNS)比色法[12],6次重复。VC含量测定用紫外分光光度计法[13],7次重复。花青素含量测定采用pH示差比色法[14],6次重复。
1.6 DNA提取与检测
在苗期,随机取7个马铃薯杂种新品系及其亲本的幼嫩叶片约1.5 g,用天根生化科技有限公司生产的植物基因组试剂盒提取DNA,1.7%琼脂糖凝胶电泳检测DNA纯度,用日本岛津产UV-2401紫外分光光度计测定各材料DNA浓度后,稀释至50 ng/μL,置-20 ℃冰箱中备用。
1.7 SSR适宜引物筛选
本试验所用引物是从NCBI网站上公布的马铃薯SSR特异性引物中选取的,引物来源详见参考文献[15-16],由上海生工有限公司合成。以亲本材料YSP-4、AM-27、‘陇薯7号’、‘黑美人’、MIN-21的基因组DNA为模板,进行PCR扩增,从55对引物中筛选条带清晰、多态性丰富、重复性好的SSR特异性引物。
1.8 SSR扩增及检测
PCR扩增体系:ddH2O 14.11 μL,dNTPs(0.225 mmol/L)1.4 μL,10×PCR buffer(含Mg2+)2.0 μL,上、下游引物各(0.5 μmol/L)0.7 μL,5U的TaqDNA聚合酶0.09 μL,模板DNA(50 ng/μL)1.0 μL。
扩增程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸90 s,重复5个循环;94 ℃变性30 s,54 ℃退火45 s,72 ℃延伸90 s,重复35个循环;72 ℃延伸10 min后4 ℃终止并低温保存[17]。
PCR扩增产物用6%聚丙稀酰胺凝胶电泳检测,对各引物扩增出的SSR等位基因多态性条带和总条带数进行统计,计算多态性条带百分率[18](percentage of polymorphic bands,P):P=(k/n)×100%,其中k为扩增出的多态性条带数目,n为扩增出的总条带数。
1.9 数据处理
采用Excel2007和SPSS22.0软件对试验数据进行处理统计及差异显著性分析。
2 结果与分析
2.1 新品系的PMCMⅠ染色体配对构型和花粉育性
由表1和图1可知,7个新品系间的单价体频率变幅为1.93~6.57,二价体变幅为7.6~15.54,三价体变幅为2.0~5.06,四价体变幅为1.63~4.26,与其亲本间的PMCMⅠ染色体配对行为均有一定差别。各新品系NMS-A42、NMS-A187、NMS-A217、NMS-B53、NMS-B107、NMS-B327和NMS-C92的染色体配对构型依次分别为2n=4x=48=6.57Ⅰ+9.66Ⅱ+5.06Ⅲ+1.74Ⅳ、2n=4x=48=5.38Ⅰ+8.98Ⅱ+4.63Ⅲ+2.69Ⅳ、2n=4x=48=4.05Ⅰ+ 15.54Ⅱ+2.12Ⅲ+1.63Ⅳ、2n=4x=48=4.55Ⅰ+12.12Ⅱ+2.39Ⅲ+3.01Ⅳ、2n=4x=48=1.93Ⅰ+11.52Ⅱ+2.0Ⅲ+4.26Ⅳ、2n=4x=48=4.37Ⅰ+9.97Ⅱ+3.19Ⅲ+3.53Ⅳ、2n=4x=48=6.08Ⅰ+7.6Ⅱ+3.4Ⅲ+4.13Ⅳ。
各亲本可育花粉率变幅为11.82%~81.38%(表1和图2),其中以亲本AM-27可育花粉率最低,仅为11.82%,其余亲本材料可育花粉率均大于50%。各新品系可育花粉率变幅为48.82%~87.69%,可作为父本或母本材料进一步杂交利用。
进一步对比各材料花粉育性与PMCMⅠ染色体配对构型结果发现,单价体和三价体频率高的材料比二价体和四价体频率高的材料花粉育性要低,如亲本AM-27、杂种新品系NMS-A42等,这是造成可育花粉率高低的重要细胞遗传学原因。
2.2 新品系植株生育期及块茎表型特征
新品系块茎表型特征如表2和图3所示。各新品系结薯集中整齐、芽眼浅,仅表皮光滑度、薯形、薯块皮色肉色等有一定的差别。
5个亲本中,‘黑美人’生育期最短(93 d),较早熟;‘陇薯7号’生育期最长(132 d),晚熟型;其余3个亲本AM-27、YSP-4和MIN-21的生育期在100~105 d,为中熟型。新品系NMS-A42、NMS-A187、NMS-A217和NMS-B107的生育期分别为102、99、105和102 d,属中熟类型;新品系NMS-B327生育期为85 d,属中早熟类型;品系NMS-C92生育期为113 d,属于中晚熟类型。
3个新品系NMS-A42、NMS-A187和NMS-A217的薯形均接近其母本YSP-4,为长圆形。品系NMS-B53、NMS-B107和NMS-B327均为近圆形,与其母本AM-27相近。品系NMS-C92薯形为长椭圆形,呈双亲中间型。
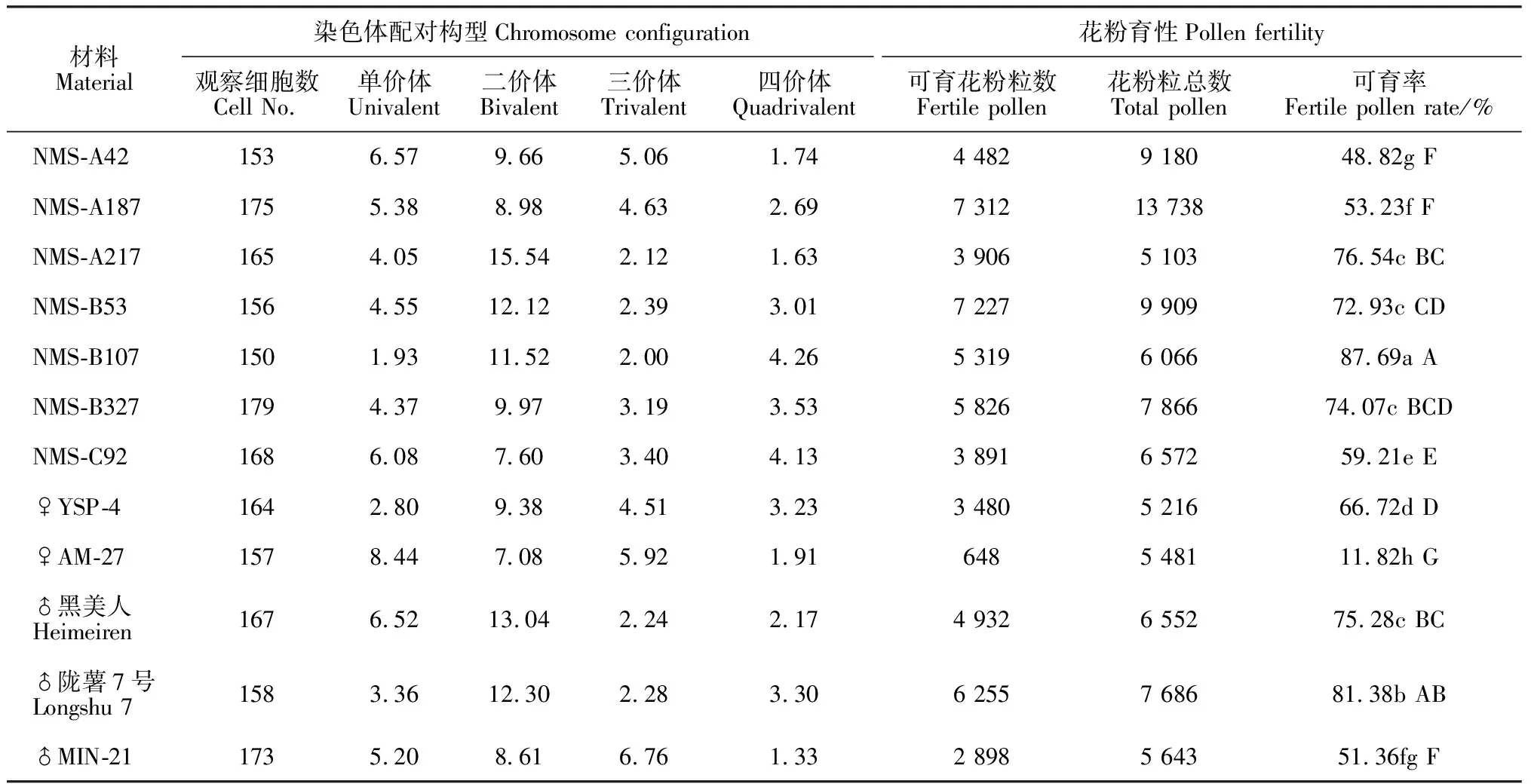
表1 各新品系及其亲本的花粉可育率
注:小写和大写字母分别表示在0.05和0.01水平存在显著性差异;下同
Note: The normal and capital letters show significant differences at 0.05 and 0.01 levels, respectively; The same as below
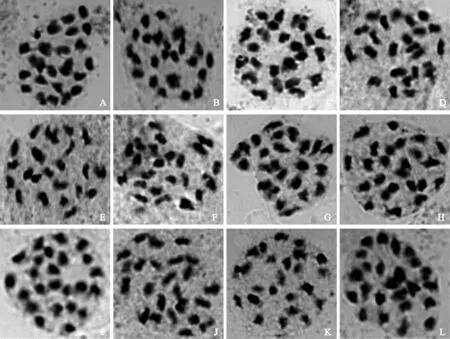
A.NMS-A42;B.NMS-A187;C.NMS-A217;D.NMS-B53;E.NMS-B107;F.NMS-B327;G.NMS-C92;H.♂MIN-21;I.♀YSP-4;J.♂黑美人Heimeiren;K.♀AM-27;L.♂陇薯7号Longshu 7图1 各新品系及其亲本的PMCMⅠ染色体配对Fig.1 Chromosome configuration of the new strains and their parents at PMCMⅠ

A.NMS-A42;B.NMS-A187;C.NMS-A217;D.NMS-B53;E.NMS-B107;F.NMS-B327;G.NMS-C92;H.♂MIN-21;I.♀YSP-4;J.♂黑美人Heimeiren;K.♀AM-27;L.♂陇薯7号Longshu 7图2 各新品系及其亲本花粉育性比较Fig.2 The pollen fertility of the new strains and their parents

A.NMS-A42;B.NMS-A187;C.NMS-A217;D.NMS-B53;E.NMS-B107;F.NMS-B327;G.NMS-C92;H.♀YSP-4;I.♂MIN-21;J.♂黑美人Heimeiren;K.♀AM-27;L.♂陇薯7号Longshu 7图3 各新品系及其亲本的块茎表观特征比较Fig.3 The comparison of tuber phenotypic characteristic of the new strains and their parents
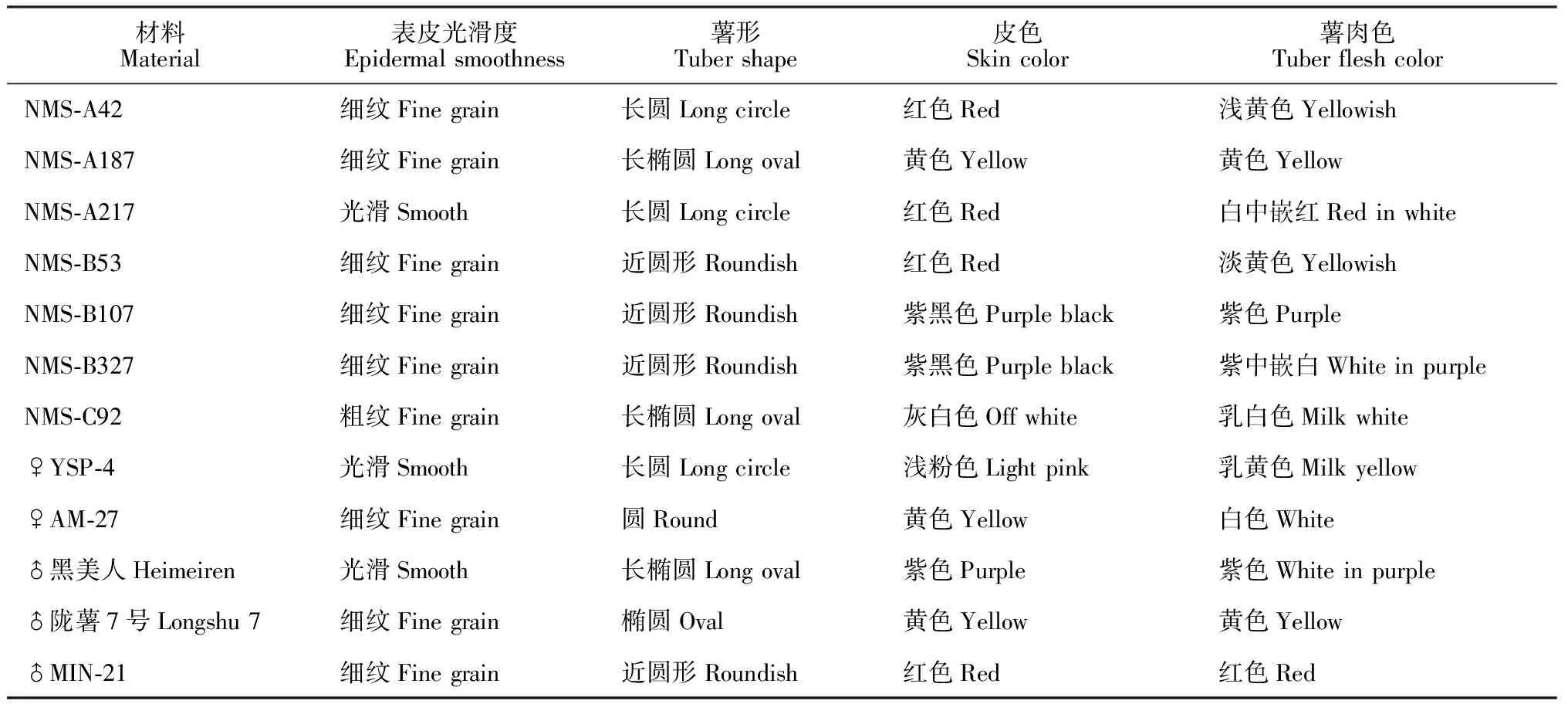
材料Material表皮光滑度Epidermal smoothness薯形Tuber shape皮色Skin color薯肉色Tuber flesh colorNMS-A42细纹Fine grain长圆Long circle红色Red浅黄色YellowishNMS-A187细纹Fine grain长椭圆Long oval黄色Yellow黄色YellowNMS-A217光滑Smooth长圆Long circle红色Red白中嵌红Red in whiteNMS-B53细纹Fine grain近圆形Roundish红色Red淡黄色YellowishNMS-B107细纹Fine grain近圆形Roundish紫黑色Purple black紫色PurpleNMS-B327细纹Fine grain近圆形Roundish紫黑色Purple black紫中嵌白White in purpleNMS-C92粗纹Fine grain长椭圆Long oval灰白色Off white乳白色Milk white♀YSP-4光滑Smooth长圆Long circle浅粉色Light pink乳黄色Milk yellow♀AM-27细纹Fine grain圆Round黄色Yellow白色White♂黑美人Heimeiren光滑Smooth长椭圆Long oval紫色Purple 紫色White in purple♂陇薯7号Longshu 7细纹Fine grain椭圆Oval黄色Yellow黄色Yellow♂MIN-21细纹Fine grain近圆形Roundish红色Red红色Red
亲本YSP-4与MIN-21的块茎皮色分别为浅粉色和红色,薯肉色分别为乳黄色和红色,其杂交新品系NMS-A42、NMS-A217薯皮颜色均为红色,与其父本一致,但NMS-A42薯肉颜色却与其母本相近;NMS-A187皮色为黄色,表现出与亲本完全不同的表型性状,薯肉颜色与其母本相近,为黄色。
亲本AM-27、‘黑美人’皮色分别为黄色和紫色,薯肉色分别为白色和紫色;新品系NMS-B107、NMS-B327皮色和肉色均与其父本相近,而NMS-B53皮色和肉色介于两亲本之间。新品系NMS-C92薯皮薯肉颜色不同于双亲,薯皮灰白色,薯肉呈乳白色。
2.3 新品系产量性状表现
表3显示,各新品系单株结薯数变幅在5.1~9.4个之间,其中新品系NMS-A42最多(9.4个),新品系NMS-B53最少(5.1个)。各新品系单株产量较高,均在1.0 kg以上,品系NMS-A42、NMS-A217、NMS-B327单株产量均显著超过其各自亲本,其中品系NMS-B327的单株产量最高(1.84 kg)。各新品系平均单株薯重变幅在122.79~227.75 g之间;新品系商品薯率较高,均在81.10%以上,其中NMS-B327商品薯率最高,为94.36%(表3)。
2.4 新品系块茎营养品质性状表现
在马铃薯块茎收获2周内,对各新品系干物质、淀粉、蛋白质、还原糖、维生素C及花青素的含量测定结果如表4所示。
7个新品系块茎干物质含量变幅为19.26%~24.15%,其中品系NMS-A42的干物质含量达到了国家全粉加工型品种的标准;新品系NMS-B53、NMS-B107、NMS-B327干物质含量相近,分别为20.49%、20.45%和20.29%,且均显著高于其父本‘黑美人’;新品系NMS-A187、NMS-A217、NMS-C92干物质的含量均小于其各自亲本。
各新品系块茎淀粉含量变幅在13.36%~18.72%之间,其中品系NMS-A42淀粉含量较高(18.72%),与其母本YSP-4接近;新品系NMS-B53、NMS-B107、NMS-B327淀粉含量均显著高于其父本‘黑美人’。
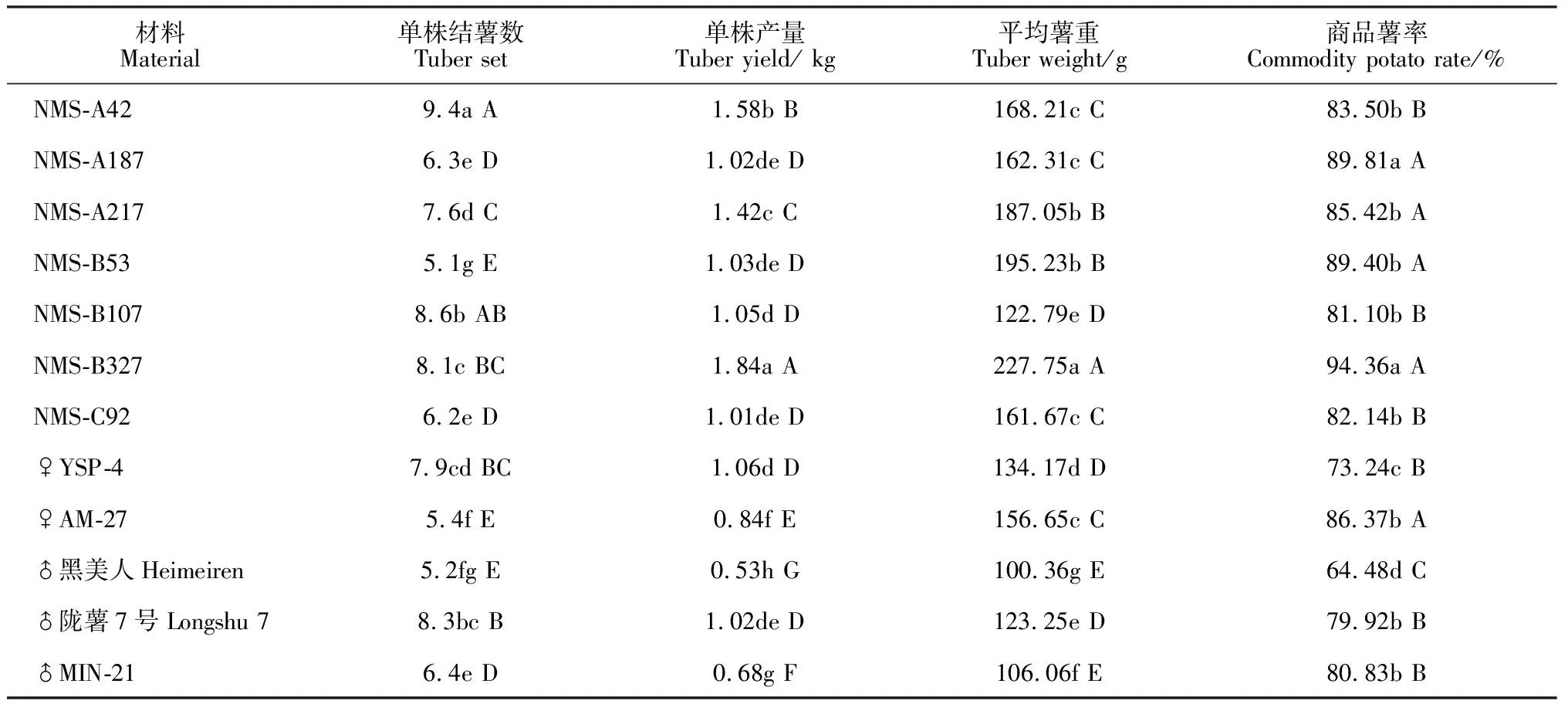
表3 各新品系及其亲本的产量性状比较
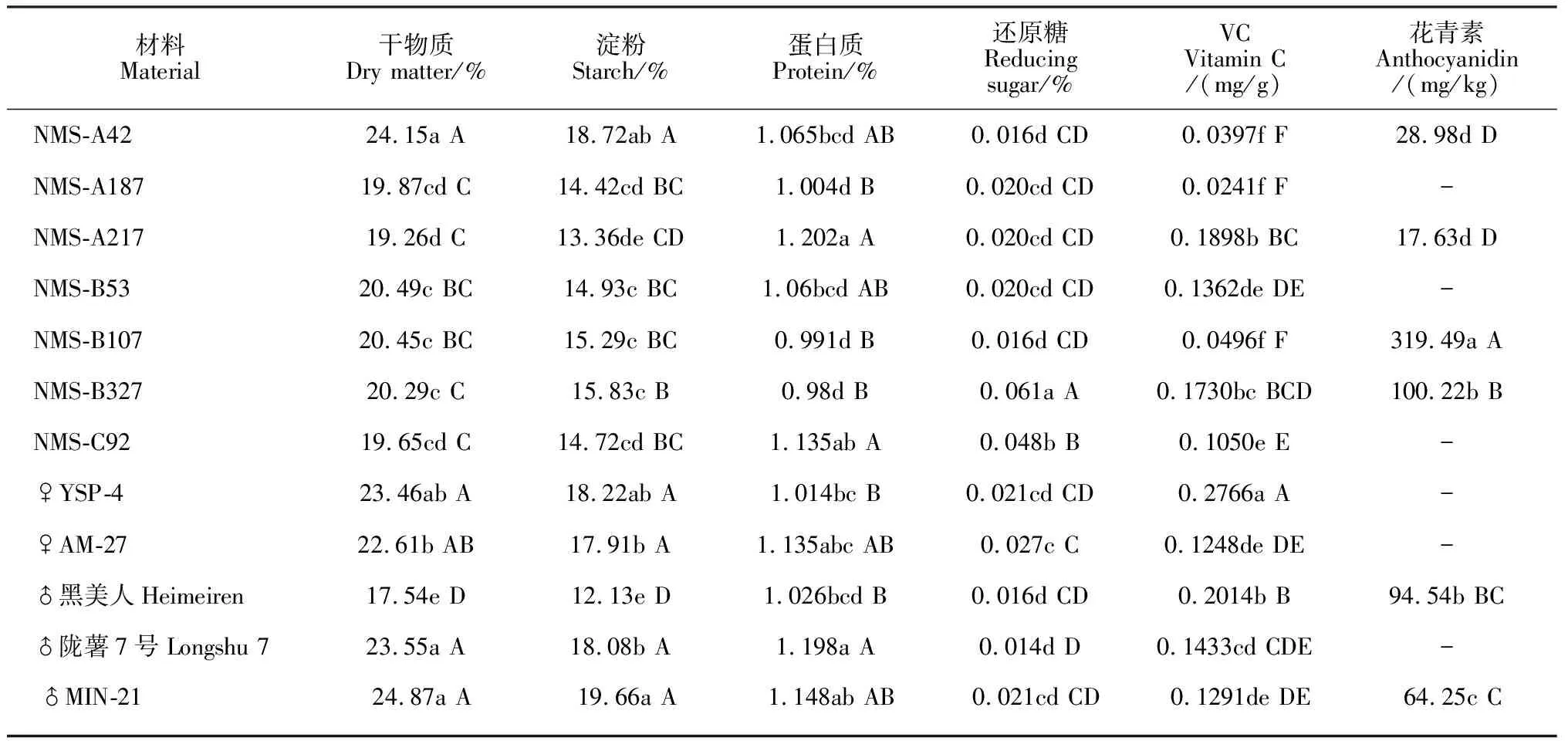
表4 新品系及其亲本块茎各物质含量
各新品系块茎蛋白质含量变幅在0.98%~1.202%之间,其中新品系NMS-A217蛋白质含量较高,为1.202%,显著高于其余新品系。新品系鲜薯VC含量变幅为0.024 1~0.189 8 mg/g,其中品系NMS-A217 VC含量显著高于其余6个新品系。
各新品系还原糖含量均很低,变幅在0.016%~0.061%之间,其中新品系NMS-B327的含量相对较高,品系NMS-C92次之。
花青素含量仅对彩色薯肉的新品系NMS-A42、NMS-A217、NMS-B107、NMS-B327及亲本‘黑美人’、MIN-21进行了测定,以品系NMS-B107的花青素含量最高(319.49 mg/kg),品系NMS-B327含量次之(100.22 mg/kg),且这2个新品系花青素含量均极显著高于其亲本,为彩薯新品系。
2.5 新品系及其亲本基因组DNA的SSR指纹特征
由图4,A可知,天根基因组试剂盒提取的7个马铃薯新品系及其亲本基因组DNA,电泳条带清晰、稳定,纯度很高,符合SSR标记分析的要求。
利用筛选出的3对SSR特异引物,对12个材料的基因组DNA进行PCR扩增,结果(表5和图4,B~D)显示,3对引物扩增出SSR多态性位点稳定,多态性高达84.62%以上。另外,每对引物扩增的SSR指纹图均能清晰地将7个马铃薯新品系及其亲本区分开来,这为新品系的鉴定及其新品种育成登记提供了可靠的分子依据。
3 讨 论
3.1 干物质含量的差异
品质是马铃薯最重要的经济性状,品质的优劣决定马铃薯加工产品的应用价值和市场竞争力。根据马铃薯的最终用途与加工产品的不同,对其品质需求也不尽相同。干物质含量是加工型品种的重要品质性状,其高低关系到加工制品的质量、产量和经济效果。金黎平等[19]研究表明基因累加作用对干物质含量的改良极为重要,严凤喜等[20]研究发现马铃薯块茎干物质含量在F1代与亲本存在显著正相关。所以在选育高干物质含量的马铃薯加工型品种时,选择干物质含量高的亲本材料尤为重要。本试验选用干物质含量较高的YSP-4、AM-27、MIN-21和‘陇薯7号’作为亲本,选育出的新品系干物质含量均在19.26%以上。其中杂交组合YSP-4×MIN-21中选育出的新品系NMS-A42干物质含量高达24.15%,而同一杂交组合选育出的NMS-A187和NMS-A217的干物质含量分别为19.87%和19.26%,干物质含量出现较大的差异。另外,杂交组合YSP-4ב陇薯7号’选育出的NMS-C92的干物质含量(19.65%)明显低于其母本YSP-4(23.46%)和父本‘陇薯7号’(23.55%)的干物质含量。这可能是遗传的复杂性造成的差异,干物质含量不仅受基因累加作用影响,可能还受微效多基因控制以及土壤、施肥、气候等环境因素的影响,此点有待深入研究。
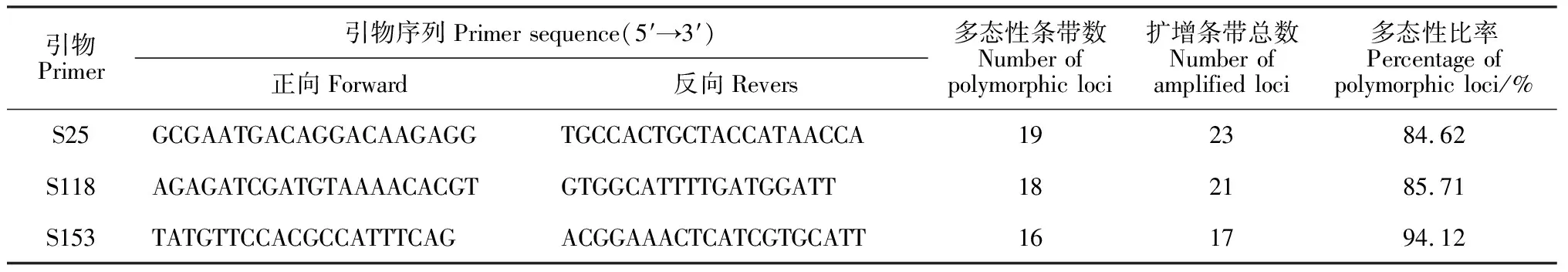
表5 3对SSR特异性引物对马铃薯新品系及其亲本的基因组DNA扩增结果
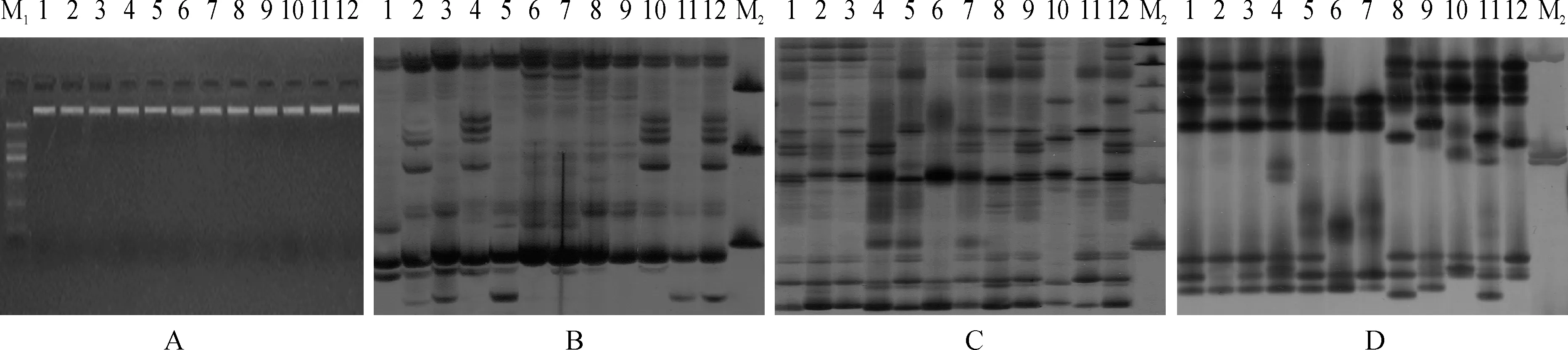
A.DNA purity test;B.S25;C.S118;D.S153;M1.DL100;M2.DL2000;1.♂MIN-21;2.NMS-A42;3.NMS-A187;4.NMS-A217;5.♀AM-27;6.♂黑美人Heimeiren;7.NMS-B53;8.NMS-B107;9.NMS-B327;10.♀YSP-4;11.♂陇薯7号Longshu 7;12.NMS-C92.图4 7个马铃薯新品系及其亲本基因组DNA纯度检测结果及用3对特异性引物PCR扩增的SSR指纹图Fig.4 The results of 7 new potato strains and parents DNA for purity and SSR fingerprints by 3 pairs of specific primers PCR amplified
3.2 彩色马铃薯新品系间花青素成分及含量的差异
彩色马铃薯简称彩薯,是人类获得优质花青素色素的理想来源之一。已查明彩薯所含色素组分主要是具稳定性和抗氧化活性的酰基化花青素[21-23],是一类水溶性天然色素,属类黄酮化合物。有研究[24-25]表明在彩薯中有6种花青素最为常见,分别是天竺葵色素、矢车菊色素、飞燕草色素、芍药花色素、矮牵牛花色素和锦葵色素及其衍生物。Lewis等[25]发现块茎薯肉呈紫色的马铃薯富含矮牵牛色素和锦葵色素,而块茎薯肉呈红色马铃薯富含天竺葵色素和少量芍药色素。Rodriguez-Saona等[26]研究发现红色马铃薯材料主要花青素为天竺葵色素。Brown等[22]的研究也发现红色马铃薯主要花青素为天竺葵色素,紫色马铃薯主要花青素为锦葵色素、矮牵牛色素、芍药色素和飞燕草色素。已有研究[27]发现天竺葵色素呈现砖红色,矢车菊素及芍药花色素表现为紫红色,而飞燕草素、矮牵牛色素及锦葵色素表现为蓝紫色系。本试验选育出的彩薯新品系NMS-B107和NMS-B327薯肉颜色为蓝紫色系,其花青素主要成分是否为飞燕草素、矮牵牛色素及锦葵色素等,尚需进一步试验证明。
另外,彩薯新品系NMS-B107块茎花青素含量为319.49 mg/kg,极显著高于其薯肉为紫色的父本‘黑美人’(94.54 mg/kg),由于母本AM-27块茎薯肉为白色(不含花青素),该杂种新品系表现出的强超亲优势,可能与杂交重组后的遗传变异使得控制花青素合成积累的结构基因和调控基因时空特异表达的相互作用有关,有待今后深入研究,查明彩薯新品系NMS-107花青素含量表现出显著超亲优势的原因。
3.3 小 结
本试验表明,从3个组合YSP-4×MIN-21、AM-27ב黑美人’和YSP-4ב陇薯7号’的杂种F1代分离群体中培育出的7个马铃薯新品系,其块茎的薯形、熟性、单株产量、商品薯率及品质性状等综合表现优良。NMS-A42为高干物质含量(24.15%)的全粉加工型新品系,NMS-B107为高花青素含量(319.49 mg/kg)新品系,NMS-B327为彩薯新品系,其余均为鲜食型新品系。NMS-B327为中早熟型品系,NMS-C92为晚熟型品系,其余均为中熟型品系。各新品系平均单株产量和商品薯率均较高,变幅分别为1.02~1.84 kg和81.10%~94.36%,以品系NMS-B327为最高。
7个新品系花粉可育率变幅在48.82%~87.69%之间,品系NMS-A42最低,品系NMS-B107最高,它们均可作为父本或母本的中间材料用于进一步杂交改良。查明了7个新品系NMS-A42、NMS-A187、NMS-A217、NMS-B53、NMS-B107、NMS-B327和NMS-C92的染色体配对构型,依次分别为6.57Ⅰ+9.66Ⅱ+5.06Ⅲ+1.74Ⅳ、5.38Ⅰ+8.98Ⅱ+4.63Ⅲ+2.69Ⅳ、4.05Ⅰ+15.54Ⅱ+2.12Ⅲ+1.63Ⅳ、4.55Ⅰ+12.12Ⅱ+2.39Ⅲ+3.01Ⅳ、1.93Ⅰ+11.52Ⅱ+ 2.0Ⅲ+4.26Ⅳ、4.37Ⅰ+9.97Ⅱ+3.19Ⅲ+3.53Ⅳ和6.08Ⅰ+7.6Ⅱ+3.4Ⅲ+4.13Ⅳ。
筛选出3对SSR特异引物S25、S118和S153,PCR扩增构建了7个新品系及其亲本的SSR指纹图。
参考文献:
[1] 杨小刚,王艳红,魏 阳,等. 我国马铃薯生产与发达国家对比[J]. 农业工程,2014,4(4): 178-180,185.
YANG X G,WANG Y H,WEI Y,etal. Potato production contrast between China and developed country[J].AgriculturalEngineering, 2014,4(4): 178-180,185.
[2] 隋启君. 中国马铃薯育种对策浅见[J]. 中国马铃薯,2001,(5): 259-264.
SUI Q J. Some suggestions of improving the work of potato breeding in China[J].ChinesePotato,2001,(5): 259-264.
[3] 金黎平. 我国马铃薯育种和品种应用[J]. 农业技术装备,2007,(9): 14-15.
JIN L P. Potato breeding and variety application in China[J].AgriculturalTechnology&Equipment,2007,(9): 14-15.
[4] 吕巨智,染 和,姜建初. 马铃薯的营养成分及保健价值[J]. 中国食物与营养,2009,(3): 51-52.
LÜ J Z,RAN H,JIANG J C. Potato nutrition and health value[J].FoodandNutritioninChina,2009,(3): 51-52.
[5] 屈冬玉,谢开云,金黎平,等. 中国马铃薯产业发展与食物安全[J]. 中国农业科学,2005,38(2): 358-632.
QU D Y,XIE K Y,JIN L P,etal. Development of potato industry and food security in China[J].ScientiaAgriculturaSinica,2005,38(2): 358-632.
[6] 谢从华. 马铃薯产业的现状与发展[J]. 华中农业大学学报(社会科学版),2012,(1): 1-4.
XIE C H. Potato industry: status and development[J].JournalofHuazhongAgriculturalUniversity(Social Sciences Edition),2012,(1): 1-4.
[7] 张秋燕,张福平. 马铃薯品种的营养成分分析[J]. 中国食物与营养,2010,(6): 75-77.
ZHANG Q Y,ZHANG F P. Determination of nutritional components in different potato varieties[J].FoodandNutritioninChina,2010,(6): 75-77.
[8] 卢肖平. 马铃薯主粮化战略的意义、瓶颈与政策建议[J]. 华中农业大学学报(社会科学版),2015,(3): 1-7.
LU X P. Strategy of potato as staple food: significance, bottlenecks and policy suggestions[J].JournalofHuazhongAgriculturalUniversity(Social Sciences Edition),2015,(3): 1-7.
[9] 王 丹,于肖夏,鞠天华,等. 马铃薯杂种无性株系的SSR鉴定及花粉育性和染色体构型分析[J]. 西北植物学报,2015,35(7): 1 326-1 331.
WANG D,YU X X,JU T H,etal. SSR identification of potato hybrid lines and pollen fertility and chromosome configuration analysis[J].ActaBotanicaBoreali-OccidentaliaSinica, 2015,35(7): 1 326-1 331.
[10] 李懋学,张敩方. 植物染色体研究技术[M]. 哈尔滨: 东北林业大学出版社,1991.
[11] 张永成,田 丰. 马铃薯试验研究方法[M]. 北京: 中国农业科学技术出版社,2007.
[12] 朱海霞,石 瑛,张庆娜,等. 3,5-二硝基水杨酸(DNS)比色法测定马铃薯还原糖含量的研究[J]. 中国马铃薯,2005,19(5): 266-269.
ZHU H X,SHI Y,ZHANG Q N,etal. Applying 3,5-dinitrosalicylic acid (DNS) method to analyzing the content of potato reducing sugar[J].ChinesePotato,2005,19(5): 266-269.
[13] 马宏飞,卢生有,韩秋菊,等. 紫外分光光度法测定五种果蔬中维生素C的含量[J]. 化学与生物工程,2012,29(8): 92-94.
MA H F, LU S Y, HAN Q J,etal. Determination of vitamin C content in five kinds of fruits and vegetables by UV spectrophotometry[J].Chemistry&Bioengineering,2012,29(8): 92-94.
[14] LEE J,DURST R W,WROLSTAD R E. Determination of total monomeric anthocyanin pigment content of fruit juices,beverages,natural colorants,and wines by the pH differential method: collaborative study[J].JournalofAoacInternational,2005,88(5): 1 269-1 278.
[15] GHISLAIN M,SPOONER D M,RODRGUEZ F,etal. Selection of highly informative and user-friendly microsatellites (SSRs) for genotyping of cultivated potato[J].TheorApplGenet,2004,108: 881-890.
[16] FEINGOLD S,LLOYD J,NORERO N,etal. Mapping and characterization of new EST-derived microsatellites for potato (SolanumtuberosumL.)[J].TheorApplGenet,2005,111: 456-466.
[17] 张自强,于肖夏,鞠天华,等. 36个马铃薯品种的SSR分析[J]. 华北农学报,2012,27(1): 93-97.
ZHANG Z Q,YU X X,JU T H,etal. SSR analysis on 36 potato varieties[J].ActaAgriculturaeBoreali-Sinica,2012,27(1): 93-97.
[18] NEI M. Analysis of gene diversity in subdivided populations[J].ProceedingsoftheNationalAcademyofSciencesoftheUSA,1973,70(12): 3 321-3 323.
[19] 金黎平. 二倍体马铃薯加工品质及重要农艺性状的遗传分析[D]. 北京: 中国农业科学院,2006.
[20] 严凤喜,李景华. 马铃薯近缘栽培种种间杂种块茎还原糖和干物质含量的遗传研究[J]. 中国马铃薯,1988,(4): 193-200.
YAN F X,LI J H. A study on the inheritance of the tuber inducing sugar and dry matter content potato hybrids derived from intercultivated species[J].ChinesePotato,1988,(4): 193-200.
[21] GISELA J,WILHELM F. Coloured potatoes (SolanumtuberosumL.)-anthocyanin content and tuber quality[J].GeneticResourcesandCropEvolution,2006,53(7): 1 321-1 331.
[22] BROWN C R,WROLSTAD R,DURST R,etal. Breeding studies in potatoes containing high concentrations of anthocyanins[J].AmericanJournalofPotatoResearch,2003,80(4): 241-249.
[23] REYES L F,JCJR M,CISNEROSZEVALLOS L. Antioxidant capacity,anthocyanins and total phenolics in purple-and red-fleshed potato (SolanumtuberosumL.) genotypes[J].AmericanJournalofPotatoResearch,2005,82(4): 271-277.
[24] HARBORNE J B. Plant polyphenols. I. Anthocyanin production in the cultivated potato[J].BiochemicalJournal,1960,74(5): 262-269.
[25] LEWIS C E,WALKER J R,LANCASTER J E. Changes in anthocyanin,flavonoid and phenolic acid concentrations during development and storage of coloured potato (SolanumtuberosumL.) tubers[J].JournaloftheScienceofFoodandAgriculture,1999,79(2): 311-316.
[26] RODRIGUEZ-SAONA L E,GIUSTI M M,WROLSTAD R E. Anthocyanin pigment composition of red-fleshed potatoes[J].JournalofFoodScience,1998,63(3): 458-465.
[27] KONG J M,CHIA L S,GOH N K,etal. Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5): 923-933.

