甜瓜果肉颜色相关的分子标记开发和应用
杨旭辉,华德平,付金玉,张乔玲,谢梅婷,刘 莉*
(1 天津大学 环境科学与工程学院,天津 300072;2 天津大学 生命科学学院,天津 300072)
甜瓜(CucumismeloL.)为一年生黄瓜属(Cucumis)作物,其色香味俱全,并且具有较高的营养价值,是一种世界性的果品,深受人们喜爱。果肉颜色作为甜瓜的一个重要农艺性状,直接影响消费者的需求与选择。甜瓜果肉颜色主要分为橘色、浅绿色和白色,与绿色和白色果肉甜瓜相比,橘色果肉甜瓜颜色更加诱人,尤其是其具有更高的营养价值,所以受到消费者的偏爱。因此培育橘色果肉的甜瓜品种,是当前甜瓜育种的重要目标之一。
甜瓜果肉颜色由叶绿素和类胡萝卜素共同决定[1],其中类胡萝卜素,特别是β-胡萝卜素是决定甜瓜橘色果肉的关键色素[2]。β-胡萝卜素广泛存在于新鲜蔬菜和水果中,是人体必不可少的营养元素之一[3]。适量摄入β-胡萝卜素可以缓解由维生素A缺乏引起的多种病症,并具有预防癌症、心脑血管疾病和眼部疾病的功效,还有抗氧化和预防衰老的作用[4-6]。橘色果肉市场品种甜瓜是类胡萝卜素(主要指β-胡萝卜素)的重要饮食来源[5]。前人的研究表明甜瓜果肉颜色由2个等位基因决定,分别为gf(决定果肉绿色)和wf(决定果肉白色)。Gf决定橘色果肉,它同时对gf和wf呈显性上位效应[7]。值得注意的是Tzuri 等在甜瓜中发现1个可以增加果肉β-胡萝卜素含量的基因CmOr[8],被证明是甜瓜中的gf位点,它是控制甜瓜果肉颜色的关键因子,含有正常功能CmOr基因的甜瓜表现为橘色的果肉,含有突变形式CmOr基因的甜瓜表现为绿色或白色果肉。
目前,有关甜瓜类胡萝卜素研究的报道较少,对于橘色果肉甜瓜的选育,一般还采用传统方法,即对育种材料成熟期的果实颜色进行鉴定,具有费时、费力、周期长等缺点。近年来,由于甜瓜可用遗传信息包括转录组(http://www.icugi.org)和基因组序列(http://melonomics.net)信息的公布和完善,可以开发更多的分子标记用于甜瓜实际育种中。分子标记辅助育种(marker-assisted selection)是直接从DNA水平对性状进行选择,具有省时、省力、不受环境影响等优点,可以大幅缩短育种周期,是传统育种技术的有力补充。
InDel(insertion-deletion length polymorphism)标记具有准确性高、稳定性好等优点,能够基于插入/缺失位点两侧的序列设计特异引物进行PCR扩增,直接在电泳技术平台上检测即可,检测简单便捷,对仪器设备和技术要求较低。本研究旨在利用当前已知的甜瓜基因组序列信息,通过对橘色果肉和非橘色果肉甜瓜材料CmOr基因序列进行比对,开发出与甜瓜果肉颜色共分离的功能型 InDel分子标记,以期利用该分子标记能够快速、准确地鉴定出橘色果肉和非橘色果肉甜瓜,从而用于甜瓜果肉颜色的选育,通过分子标记辅助选择,能够有效降低育种成本,提高育种效率,具有重要的实际应用价值。
1 材料和方法
1.1 甜瓜材料
供试甜瓜包括橘色果肉材料12份;白色果肉材料6份;绿色果肉材料6份,橘绿果肉‘一窝狼’和‘红到边’各1份,纯合橘肉和纯合白肉材料杂交得到的2个F1组合F358和F361。以上所用甜瓜材料除F1代材料之外,均为高代纯合自交系,果肉颜色性状区分明显,遗传稳定(表1)。分别选取2个纯合橘肉材料(Nb590和Nb647)与2个纯合白肉材料(Nb627和Nb652)杂交得到2个F1组合(Nb627×Nb590)及(Nb647×Nb652),F1自交后得到2个F2分离群体用于橘色果肉的分子标记检测。上述所有材料均由天津大学植物资源及育种实验室提供。
1.2 实验方法
1.2.1果肉颜色鉴定供试材料于2016年8月在天津市北辰区甜瓜实验基地进行育苗,塑料大棚定植,采用常规吊蔓栽培。在果实成熟期调查果肉颜色。
1.2.2引物设计与合成根据甜瓜基因组重测序信息,通过对比橘肉和非橘肉甜瓜材料间CmOr基因序列,在其内含子区域发现一插入/缺失突变,根据此插入/缺失位点开发出 InDel-Or1标记,依照突变两侧的 DNA 序列以及引物设计的一般原则,利用Primer 5.0引物设计软件,设计正向引物InDel-Or1-For(5′-AGAGGAGACTGTAGCCGATGTTTGG-3′)和反向引物InDel-Or1-Rev(5′-CAACCTTTCTTCTCCCATTGCACATTGC-3′)。所开发的 InDel 标记为共显性标记,利用该引物对甜瓜材料进行扩增,在琼脂糖凝胶电泳分析时容易区分纯合子和杂合子,对于橘肉性状甜瓜材料DNA能扩增出大小为560 bp的条带,而非橘肉甜瓜材料DNA扩增出的产物片段大小为488 bp,设计得到的标记为共显性。
1.2.3DNA提取、PCR扩增及产物电泳对所有供试材料取0.5 g 幼嫩叶片,参照 Murray 等[9]的 CTAB 方法提取叶片总 DNA。以该DNA为模板,利用设计引物进行PCR扩增,采用10 μL反应体系,包括:1.0 μL 10×PCR Buffer、0.2 μL 2.5 mmol·L-1dNTP、0.4 μL 10 μmol·L-1引物、0.2 μL 5 U·μL-1Taq、1.5 μL 50 ng·L-1DNA、6.7 μL ddH2O。PCR扩增采用的程序为:94 ℃预变性5 min;94 ℃变性30 s,59 ℃复性30 s,72 ℃延伸30 s,35 个循环;72 ℃终延伸5 min。对PCR扩增产物用1.5%的琼脂糖凝胶在150 V恒压条件下电泳30 min,EB染色后,凝胶成像系统观察结果。
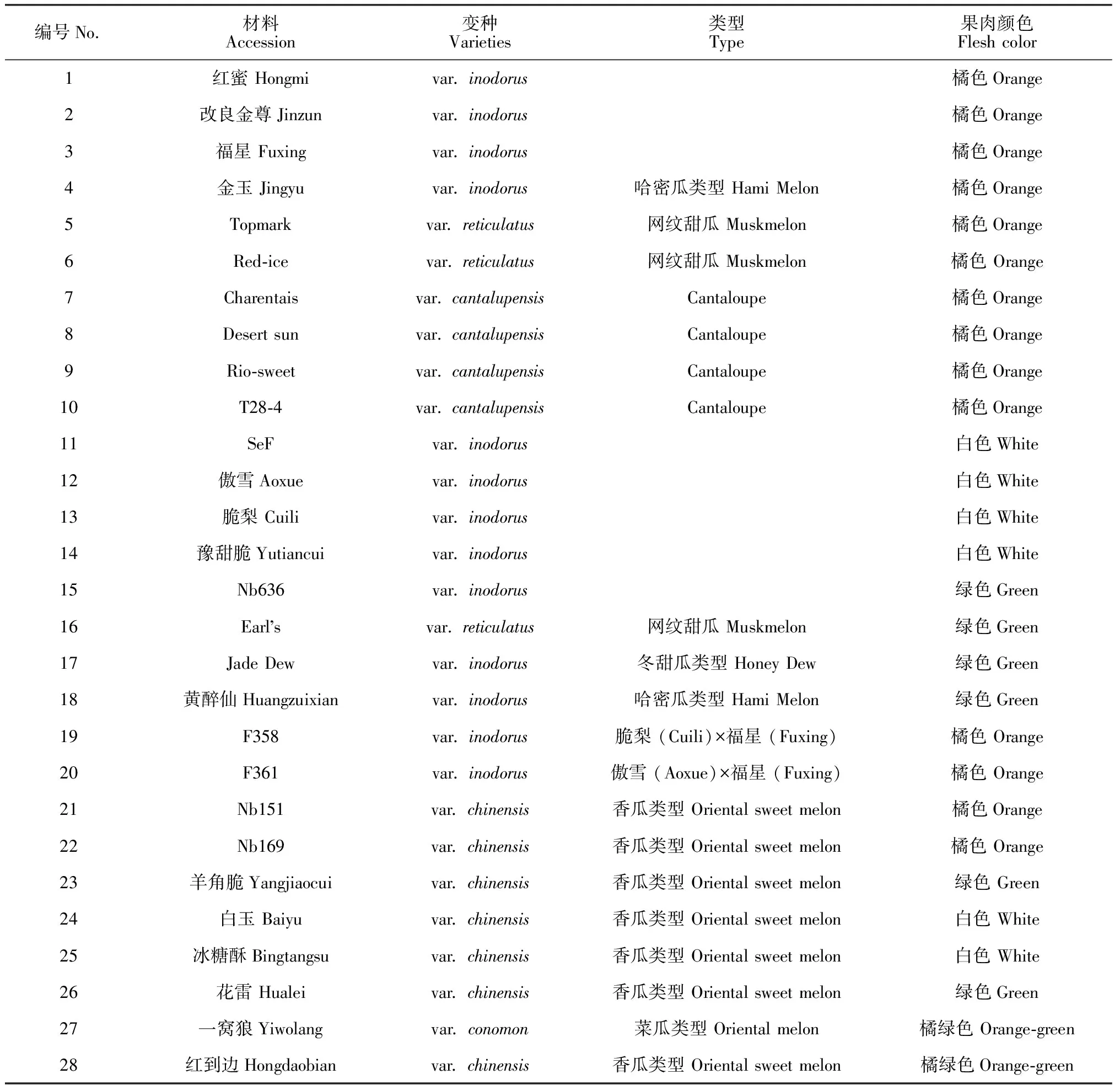
表1 供试甜瓜材料
2 结果与分析
2.1 CmOr基因功能标记InDel-Or1的开发
CmOr(MELO3C005449)是控制甜瓜果肉颜色的关键基因,并且已经被克隆。根据甜瓜基因组重测序信息,于CmOr基因内含子区域发现一InDel分子标记,将其命名为InDel-Or1,与非橘肉甜瓜相比,橘肉甜瓜CmOr内含子区域内存在73个核苷酸的插入和1个核苷酸的缺失(图1),根据其插入/缺失位置两侧的碱基序列信息,利用Primer 5.0软件设计引物,来检测甜瓜是否为橘色果肉。理论上来说,该引物对于橘肉纯合材料DNA能扩增出大小为560 bp片段,在非橘肉材料DNA中能扩增出的产物片段大小为488 bp,而在橘肉杂合甜瓜材料中则能扩增出488 bp及560 bp两条带。利用琼脂糖凝胶电泳能很好区分。
2.2 InDel-Or1分子标记在橘肉和非橘肉甜瓜材料中的验证
使用本研究开发的InDel-Or1标记对选取的28份甜瓜材料进行PCR扩增。对所选材料的田间表型和分子标记的鉴定结果进行比较。结果(图2)显示,12份橘肉材料只扩增出了560 bp条带;有14份材料只扩增出了488 bp条带,果肉颜色包括白色、绿色和橘绿色。以上26份材料检测结果均表现出单一条带的纯合基因型。2个F1代甜瓜材料则扩增出了488和560 bp两条带,表现为杂合基因型(图2)。利用该分子标记对材料基因型检测结果与田间表现型完全一致(表2)。
在本研究中,非橘肉材料除了常用白肉和绿肉类型以外,还选用了2个果肉颜色较为特殊的材料,如‘一窝狼’和‘红到边’,其果肉颜色介于橘色和绿色之间,称之为橘绿肉类型,如图2,B所示,这2个材料(27和28)扩增出488 bp条带,即非橘肉条带。由此可见,只有标准的橘肉类型甜瓜才能扩增出560 bp条带。
2.3 InDel-Or1对甜瓜分离群体的果肉颜色鉴定分析
2016年春季,选取纯合橘肉和白肉材料配置2个杂交组合(Nb627×Nb590)和(Nb647×Nb652),自交收获F2代种子。2017年春,对这2个F2群体分别获得601株和578株的幼苗进行挂牌取样,提取单株的单片子叶DNA,利用InDel-Or1标记进行PCR扩增,电泳结果见表3。将2个组合中仅扩增出560 bp条带的110株和123株幼苗,以及在仅扩增出488 bp条带的幼苗中随机选10株定植到田间。最终待果实成熟时调查果肉颜色。比较基因型与表型鉴定结果(表4)显示:杂交组合(Nb590×Nb627)的分离群体中,筛选出的560 bp条带植株田间收获104株,其中96株表现为橘肉,分子标记符合率为97.1%;在具有纯合488 bp条带的10株果实中,6株为白肉,4株为绿肉。组合(Nb647×Nb652)的分离群体中,筛选出的560 bp条带植株田间收获119株,其中113株表现为橘肉,分子标记符合率为95.0%;在具有纯合488 bp条带的10株果实中,8株为白肉,2株为绿肉(表4)。
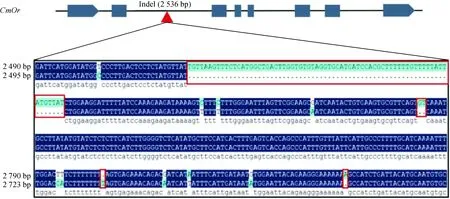
灰色方格为外显子,灰色方之间为内含子区域;红色箭头为本研究发现InDel标记所处位置。框线内为橘肉甜瓜与非橘肉甜瓜在InDel标记附近序列比对结果,红色框线内为插入缺失位点,与非橘肉甜瓜相比,橘肉甜瓜在此区域存在大小为73 bp插入和1 bp缺失图1 InDel-Or1分子标记在CmOr基因中所处位置Gray blocks represent exons and the regions between them stand for introns. Red arrow denotes the location of InDel marker we found here in CmOr gene. Sequences in black box are the results of sequence alignment between orange flesh melon and non-orange flesh melon, base sequences in red boxes are InDel loci. There are 73 bp insertion and 1 bp deletion in orange flesh melon compared with non-orange flesh melonFig.1 Location of InDel-Or1 marker in the CmOr gene
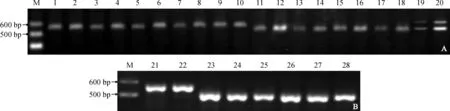
A. 厚皮甜瓜材料; B. 薄皮甜瓜材料; M. DNA MarkerⅠ; 1~28. 28份供试甜瓜材料的序号、果肉颜色见表1图2 InDel-Or1标记对28份甜瓜材料PCR产物电泳结果A. Muskmelon accessions; B. Oriental sweet melon accessions; M. DNA MarkerⅠ; 1-28. Numbers of 28 melon accessions listed in Table 1Fig.2 PCR amplification products of 28 melon accessions using InDel-Or1 marker
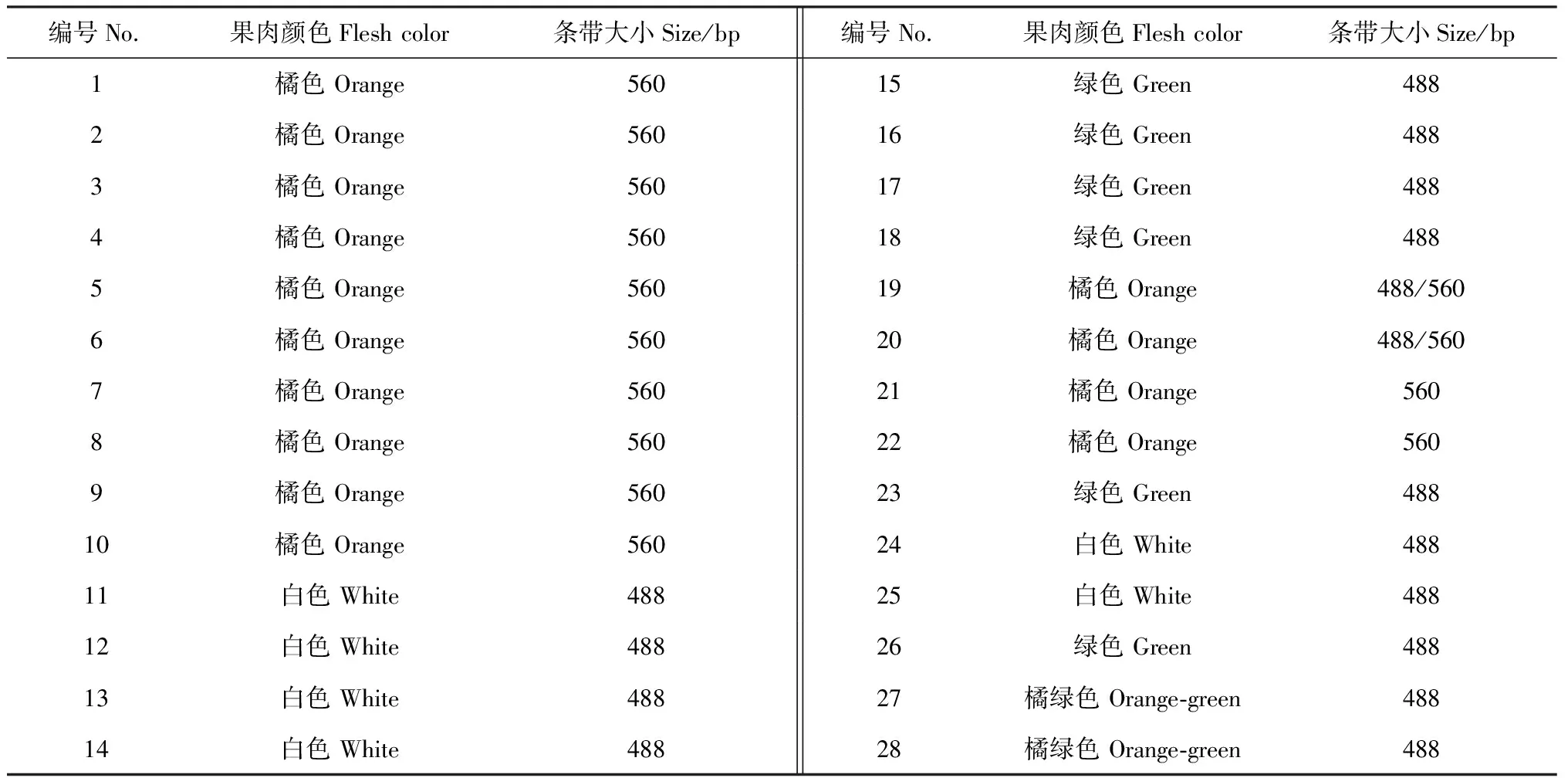
编号No.果肉颜色Flesh color条带大小Size/bp编号No.果肉颜色Flesh color条带大小Size/bp1橘色 Orange56015绿色 Green4882橘色 Orange56016绿色 Green4883橘色 Orange56017绿色 Green4884橘色 Orange56018绿色 Green4885橘色 Orange56019橘色 Orange488/5606橘色 Orange56020橘色 Orange488/5607橘色 Orange56021橘色 Orange5608橘色 Orange56022橘色 Orange5609橘色 Orange56023绿色 Green48810橘色 Orange56024白色 White48811白色 White48825白色 White48812白色 White48826绿色 Green48813白色 White48827橘绿色 Orange-green48814白色 White48828橘绿色 Orange-green488

表3 F2代群体基因型检测结果
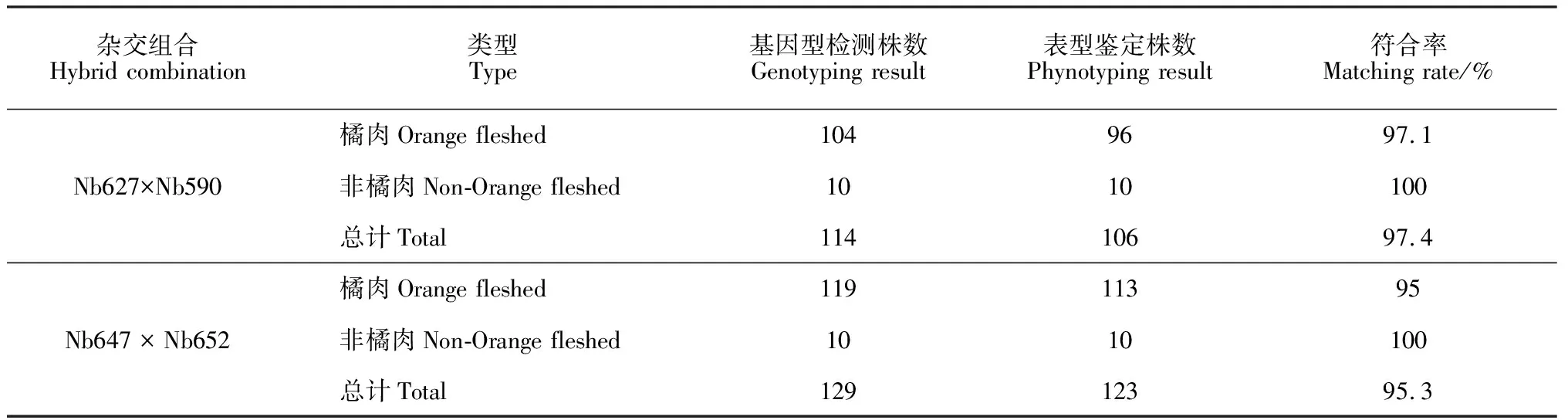
表4 F2代部分植株田间表型鉴定与基因型检测结果对比
3 讨 论
分子标记通常是指狭义概念上的DNA标记,即利用种内个体间 DNA 序列差异而设计的,主要有RFLPs、SSR、AFLPs、InDel 和SNPs等,在分子标记的开发中,通常有2类标记具有较大的应用意义,基因连锁标记[10]和基因标记[11]。开发基因连锁标记或基因标记,利用分子标记辅助育种策略通过基因型的选择来判断表型,不受环境因素的制约,可在种子或苗期进行选择。近年来,越来越多的关于甜瓜果肉颜色调控基因的分离以及类胡萝卜素累积机制方面的研究被报道[8, 12-15],但甜瓜果肉颜色的调控机理尚未完全清楚。Tzuri等[8]通过测序比对发现CmOr基因编码区内一单核苷酸突变位点导致了编码氨基酸的改变。进一步研究证明该氨基酸的突变导致了甜瓜果肉颜色的变异。根据该SNP位点设计引物,能够很好地鉴定出橘色果肉甜瓜。SNP作为最新一代分子标记,依托高通量测序平台和基因芯片技术,能够实现对大群体样本的快速分型。然而如今许多育种实验室对SNP的分型还是基于PCR的技术水平,并且还需要对PCR产物进行限制性内切酶消化处理。而InDel作为另一种被广泛应用的分子标记,具有遗传稳定、检测简便等优点,不需要对PCR产物进行酶切,可以适合不同检测条件的需求。
本研究通过橘肉和绿肉CmOr基因的基因组序列比对,发现橘肉CmOr基因及绿肉CmOr基因内含子区域存在插入/缺失位点,片段大小为72 bp。此插入/缺失位点的发现为CmOr基因 InDel分子标记的开发提供了序列参考信息。由此成功开发出的InDel-Or1分子标记与果肉颜色主效基因/QTL共分离。此标记通过琼脂糖凝胶电泳即能清晰地分析出条带差异,并且此标记设计为共显性,能够清晰地区分纯合子和杂合子,在甜瓜种子或幼苗期即可鉴定果肉颜色的基因型。在2个杂交分离群体中,InDel-Or1标记对橘肉植株鉴定符合率分别达到97.1%和95.0%。完全可用于甜瓜果肉颜色的分子标记辅助育种选择。
甜瓜果肉颜色主要有橘色、绿色和白色。而在本研究选取的薄皮材料中,存在一些特殊果肉颜色的甜瓜类型,例如橘绿肉类型的‘一窝狼’和‘红到边’,这2个材料的橘色表现与本研究中其他橘肉类型不同,在未熟时期果肉颜色为绿色,随着果实成熟而逐渐显现为橘色,但绿色并未消失,最终在果实完全成熟时期表现为橘绿色,果实中的橘色部分由瓤向外呈现扩散趋势,并且离瓤越近橘色越深。分子检测结果显示这2份橘绿肉材料仅出现488 bp条带即非橘肉条带,并未出现560 bp的橘肉条带,无法解释果肉中橘色的来源。而薄皮材料的Nb151和Nb169为本实验室经过改良得到的高代纯合橘肉类型甜瓜材料,与厚皮材料中橘肉类型甜瓜果肉颜色表现一致,在成熟过程中,果肉呈现出由幼果的白色逐渐到浅橘,再到成熟时期均匀的橘色。这些材料扩增产物仅有560 bp条带。由此推测可能在薄皮类型的‘一窝狼’和‘红到边’中,其果肉中橘色来源与以上其他材料的橘肉类型不同,存在其他控制果肉颜色的基因,仍需进一步研究。
另外,本研究所设计分子标记主要用于区分橘肉类型和非橘肉类型甜瓜,当前尚未开发出用于鉴定绿色果肉和白色果肉甜瓜的分子标记,对于控制它们的基因也尚不清楚。在本研究利用橘肉和白肉亲本得到的F2代分离群体中,不但出现了橘肉和白肉类型甜瓜,也出现了少量的绿肉类型甜瓜。先前的研究也已证明在甜瓜果肉颜色遗传中,绿肉和白肉性状对橘肉性状为隐性,同时控制绿肉的基因gf与控制白肉的基因wf之间存在上位效应。当基因型为wf+_/gf+_或wf+_/gfgf时,果肉颜色为橘色;当基因型为wfwf/gf+_时果肉颜色为白色;当基因型为wfwf/gfgf时果肉颜色为绿色[16]。并且wf已经被证实与甜瓜果实由白色到绿色的转变有关,并且已经被定位到了08染色体[17]。Gur等研究发现由于人工选择的作用,使得在甜瓜亚种ssp.melo中,橘肉材料多出现在reticulatus和cantalupensis变种中,白色果肉甜瓜大都出现在inodorous变种,以分子标记辅助选择技术为指导,已经可以快速准确地实现甜瓜颜色性状在不同遗传背景材料中的转移[18]。当前亟需进行更进一步的探究控制甜瓜颜色的基因以及它们之间的作用和联系,开发可用于区分绿色和白色果肉类型甜瓜的分子标记,建立和完善甜瓜果肉颜色分子标记辅助育种体系。
参考文献:
[1] CARVALHO N, CANELA F M, LEITE P H S,etal. Analysis of genetic variability of commercial melon cultivars using SSR molecular markers[J].GenetMol.Res., 2017,16(3): 16039739.
[3] WONG J C, LAMBERT R J, WURTZEL E T,etal. QTL and candidate genes phytoene synthase and ζ-carotene desaturase associated with the accumulation of carotenoids in maize[J].TheorApplGenet, 2004,108(2): 349-359.
[4] FRASER P D, BRAMLEY P M. The biosynthesis and nutritional uses of carotenoids[J].ProgressinLipidResearch, 2004,43(3): 228-265.
[6] KRINSKY N I, LANDRUM J T, BONE R A. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J].AnnualReviewofNutrition, 2003,23(1): 171-201.
[7] CUEVAS H E, STAUB J E, SIMON P W,etal. A consensus linkage map identifies genomic regions controlling fruit maturity and beta-carotene-associated flesh color in melon (CucumismeloL.)[J].TheorApplGenet, 2009,119(4): 741-756.
[8] TZURI G, ZHOU X, CHAYUT N,etal. A ‘golden’ SNP inCmOrgoverns the fruit flesh color of melon (Cucumismelo)[J].PlantJournal, 2015,82(2): 267-279.
[9] MURRAY M G. Rapid isolation of high-molecular-weight plant of high-molecular-weight plant DNA[J].NucleicAcidsResearch, 1980,8(19): 4 321-4 326.
[10] 陈学好, 王 佳, 徐 强, 等. 一个与黄瓜单性结实基因连锁的ISSR标记[J]. 分子植物育种, 2008,6(1): 85-88.
CHEN X H, WANG J, XU Q,etal. An ISSR marker linked to the parthenocarpic gene of cucumber[J].MolecularPlantBreeding, 2008,6(1): 85-88.
[11] 王 军, 杨 杰, 陈志德, 等. 水稻香米基因标记的开发与应用[J]. 分子植物育种, 2008,6(6): 1 209-1 212.
WANG J, YANG J, CHEN Z D,etal. Development and application of fragrance gene markers in rice[J].MolecularPlantBreeding, 2008,6(6): 1 209-1 212.
[12] CHAYUT N, HUI Y, OHALI S,etal. A bulk segregant transcriptome analysis reveals metabolic and cellular processes associated with orange allelic variation and fruit β-carotene accumulation in melon fruit[J].PlantBiology, 2015,15(1): 274-291.
[13] 吕丽华, 王怀松, 付秋实, 等. 甜瓜果肉β-胡萝卜素含量的QTL分析[J]. 华北农学报, 2012,27(5): 80-85.
LÜ L H, WANG H S, FU Q S,etal. QTL analysis of β-carotene content inCucumismeloL. flesh[J].ActaAgriculturaeBoreali-Sinica, 2012,27(5): 80-85.
[14] 杨光华, 范 荣, 杨小锋, 等. 甜瓜果实颜色3个质量性状基因的定位[J]. 园艺学报, 2014,41(5): 898-906.
YANG G H, FAN R, YANG X F,etal. Construction of a highly dense genetic map using SNP and mapping of three qualitative traits inCucumismelo[J].ActaHorticulturaeSinica, 2014,41(5): 898-906.
[15] 赵军林, 于喜艳, 王秀峰. 橙色果肉甜瓜β-胡萝卜素积累的分子机理[J]. 山东农业科学, 2014,46(5): 7-11.
ZHAO J L, YU X Y, WANG X F. Molecular mechanism of β-carotene accumulation in orange-fleshed muskmelon[J].ShandongAgriculturalSciences, 2014,46(5): 7-11.
[16] CLAYBERG C D. Interaction and linkage test of flesh color genes inCucumismeloL.[J].CucurbitGenetCoopRep, 1992,15: 53.
[17] MONFORTE, A J, OLIVER M, GONZALO M J,etal. Identifcation of quantitative trait loci involved in fruit quality traits in melon (CucumismeloL.)[J].Teor.Appl.Genet, 2004,108(4): 750-758.
[18] GUR A, TZURI G, MEIR A,etal. Genome-wide linkagedisequilibrium mapping to the candidate gene level in melon (Cucumismelo)[J].ScientificReports, 2017,7(1): 9 770.

